大鼠嘌呤能受体P2X4稳定表达细胞系的建立及功能的验证
李琳琳,周培岚,苏瑞斌
(军事医学科学院毒物药物研究所新药评定研究室,北京 100850)
神经病理性痛(neuropathic pain,NPP)是指由躯体感觉神经系统损伤或疾病造成的疼痛,是中枢及外周神经组织由于多种原因受到损伤或出现功能障碍而引起的一种慢性病理性疼痛,主要表现为痛觉过敏、痛觉超敏及持续性自发痛[1]。由于NPP发生机制复杂,因此成为较难治疗的疾病。
嘌呤能P2X4受体是ATP-门控、非选择性阳离子通道P2X受体家族成员,广泛分布于哺乳动物脑、脊髓、肺、膀胱和输卵管等组织中,在脑及脊髓表达量较高。近年来研究表明,P2X4受体在NPP发生发展过程中可能具有重要的调节作用。一方面,脊髓损伤后,随着大鼠痛觉敏感性的增加,脊髓P2X4受体表达量相应上调,显示P2X4受体激活与痛觉敏感性密切相关[2];另一方面,当敲除小鼠的P2X4受体后,外周神经损伤引起的NPP的发展明显改善[3]。上述研究提示,如能在 NPP形成初期调节P2X4受体的表达或功能,可能会对治疗NPP起到较大的作用。
2009年,Kawate等[4]首次解析了斑马鱼P2X4(zfP2X4)受体的晶体结构。2012年,Young等[5]将zfP2X4受体结合ATP开放状态晶体结构分辨率提升至2.8Å。zfP2X4受体晶体结构的解出为P2X4受体分子机制及功能的探索奠定了基础。近年来,国内外对P2X4受体的功能进行了初步探索。研究表明,P2X4受体在小胶质细胞中的表达量较高,其对NPP的调节起着重要作用。当有害刺激发生时,体内释放ATP激活P2X4受体,胞外Ca2+内流,并进一步刺激下游信号分子,引起胞内Cl-浓度改变,改变胞内Cl-的稳态平衡,最终产生NPP反应[6]。P2X4受体可以被ATP及其类似物激活,其非选择性拮抗剂主要有三硝基苯酚(trinitrophenyl,TNP)-ATP[7-8]。近年来的研究发现,P2X4受体与高血压及肿瘤等疾病的发生也有一定的联系[9-11]。由于目前缺乏高选择性P2X4受体激动剂和拮抗剂,无法特异性地开展P2X4受体的生理功能研究。因此,本实验拟建立稳定表达大鼠 P2X4受体(rP2X4)的 HEK293 细胞系(HEK293-pEGFP-N1-rP2X4),以期为研究P2X4受体的生理功能及靶向P2X4受体的药物提供技术支撑。
1 材料与方法
1.1 试剂及仪器
E.coli DH5α菌株购自天根生化科技(北京)有限公司,人胚胎肾细胞(HEK293)由中国协和医科大学基础医学研究所细胞中心提供。pEGFP-N1-GFP载体由军事医学科学院放射与辐射医学研究所丛玉文教授惠赠,pExpress-1-P2rx4购自美国Source BioScience公司。脂质体LipofectamineTM2000购自美国Invitrogen公司,质粒小提试剂盒、Fast HiFidelity PCR Kit购自天根生化科技(北京)有限公司,引物由北京奥克鼎盛生物科技有限公司合成,EcoRⅠ和XhoⅠ限制性内切酶购自Fermentas公司;G418、胰蛋白酶购自 Amresco公司,MEM培养基(粉剂)、Opti-MEM 培养基购自美国Gibco公司,胎牛血清购自中国ExCell Biology公司;抗P2X4受体兔多克隆抗体购自美国Abcam公司,抗β肌动蛋白小鼠单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG,HRP标记的羊抗小鼠IgG购自北京中杉生物技术有限公司;5×加样缓冲液、ECL显影试剂盒购自普利来公司,产品蛋白预染相对分子质量标志物购自立陶宛Fermentas公司;Power SYBR Green PCR Master Mix购自美国 Life Technologies公司;ATP 购自中国 J&K Chemical公司,TNP-ATP购自美国Santa Cruz公司。
电泳仪购自北京六一仪器厂,电泳槽购自美国Bio-Rad公司,凝胶成像仪购自美国Kodak公司;荧光定量PCR仪购自美国Applied Biosystems公司;电极微管、P-97型水平拉制仪、M-225型三维微操仪购自美国 Sutter Instrument公司;DigiData 1322A数-模转换器、MultiClamp 700B型膜片钳放大器购自美国Axon Instrument公司。
1.2 pEGFP-N1-rP2X4重组质粒构建
以 pExpress-1-P2rx4质粒为模板,采用上游引物:5'-GCCTCGAGGCGGGCTGCTG-3',下 游 引物:5'-CCGAATTCCTCACTGGTTCATCTCC-3',进行 PCR扩增。扩增条件:95℃ 2 min;95℃15 s,62℃ 10 s,70℃ 30 s,35 个循环;72℃ 5 min。产物进行琼脂糖凝胶电泳后胶回收,回收产物用XhoⅠ和EcoRⅠ限制性内切酶双酶切后再次胶回收,并与双酶切pEGFP-N1载体连接(14℃过夜)。将连接产物转化50 μL E.coli DH5α感受态,混匀并于冰浴中静置30 min,42℃水浴中60 s,迅速转移至冰浴中冷却3 min;加入预热的450 μL SOC培养基(不含抗生素)后混匀,其后于37℃,250 r·min-1震摇45 min;取转化菌液300 μL均匀涂布于卡那霉素阳性的LB固体培养平板,37℃培养过夜;挑取培养板上的单克隆接种于含卡那霉素的液体LB培养液,37℃,250 r·min-1震荡培养 8 h。应用碱裂解法提取重组质粒,经XhoⅠ和EcoRⅠ限制性内切酶双酶切后进行琼脂糖凝胶电泳,将含目的条带的克隆测序(北京奥克鼎盛生物科技有限公司),测序结果以PubMed Blast进行序列比对,序列完全正确的重组质粒用于建立稳转细胞系。
1.3 rP2X4受体稳转HEK293细胞系建立
将HEK293细胞接种于培养皿,当细胞60%~70%汇片时,用Lipofectamine 2000将pEGFP-N1-rP2X4重组质粒转染至HEK293细胞。转染6 h后,移除含转染复合物的培养基,加入MEM完全培养基;转染24 h后,观察GFP荧光。用胰酶消化并转入培养瓶,加入 G418 1 g·L-1[12]压力筛选 8 d,消化细胞并稀释传至96孔板;培养3 d后,挑选单细胞孔继续培养。待细胞长满孔底后,转种至24孔培养板扩大培养。
1.4 单克隆绿色荧光筛选细胞株
将细胞传至24孔板玻璃片,培养24 h后吸出培养基并用500 μL 4%多聚甲醛固定,用PBS清洗后加 入 300 μL 1 μmol·L-1Hoechst 溶 液 染 核30 min;再用PBS清洗后,封片并用激光共聚焦显微镜观察选出绿色荧光强度较高的细胞株。
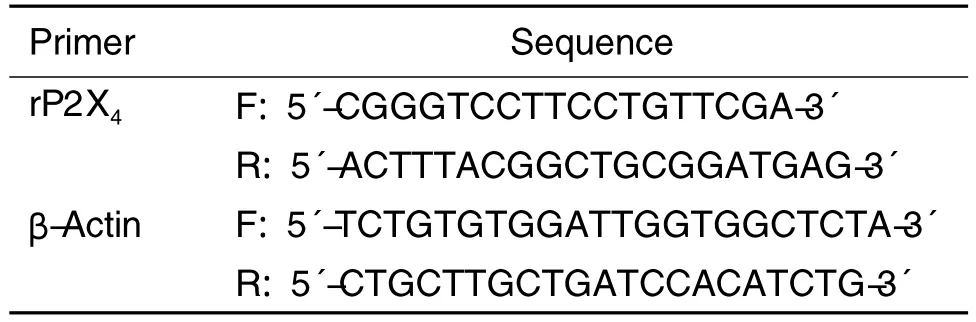
Tab.1 PCR and qRT-PCR primers
1.5 qRT-PCR验证rP2X4受体mRNA的表达
采用 Primer 3.0软件设计 qRT-PCR引物(表1)。分别取培养24h的HEK293细胞及HEK293-pEGFP-N1-rP2X4细胞,TRIzol法提取细胞总RNA并以总RNA为模板逆转录合成cDNA一链。反应体系:1 μg 总 RNA,4 μL 5 × 逆转录酶缓冲液,2 μL dNTPs Mix 10 mmol·L-1,1 μL RRI 40 U·μL-1,1 μL oligo d(T)1850 μmol·L-1,0.5 μL M-MLv 200 U·μL-1,加 DEPC H2O 至20 μL。逆转录 条 件:40℃ 1 h,70℃ 10 min。 逆 转录得cDNA一链并进行qRT-PCR反应。qRT-PCR反应体系:0.6 μL 模板 cDNA,4.0 μL DEPC H2O,5 μL 2×PCR Master Mix,上下游引物10 μmol·L-1各0.2 μL;反应条件:95℃ 2 min;95℃ 15 s,62℃10 s,70℃ 30 s,35 个循环;72℃ 5 min。以 2-ΔΔCt表示基因相对表达量。
1.6 Western蛋白质印迹法检测 HEK293-pEGFP-N1-rP2X4上 rP2X4受体蛋白的表达
取培养 24 h的 HEK293细胞及 HEK293-pEGFP-N1-rP2X4细胞,用PBS清洗后加入预冷的RIPA细胞裂解液,收集细胞并于4℃旋摇15 min;4℃,12 000×g离心15 min,取上清测定蛋白浓度,剩余蛋白清液加入5×梯度缓冲液加热变性5 min,10%SDS-PAGE电泳分离,转至 NC膜上,含5%脱脂奶粉的TBS-T缓冲液室温封闭1.5 h;剪下其相应位置膜,分别加入P2X4受体一抗(1∶50)及β 肌动蛋白一抗(1∶4000),4℃孵育过夜,TBS-T 缓冲液洗膜后分别加入HRP标记的山羊抗兔二抗(1∶3000)及山羊抗小鼠二抗(1∶5000),室温孵育1 h。TBS-T和TBS缓冲液洗膜后加入ECL显影液,曝光。
1.7 全细胞膜片钳法记录电流
利用全细胞膜片钳技术记录单细胞离子通道电流。培养24 h,用细胞外液清洗后置于倒置显微镜工作台;选取大小相近、纹理清晰的细胞进行实验。保持细胞外液灌流,流速1.5 mL·min-1。电极入液后电阻为4.0~5.0 MΩ,液接电位补偿,形成高阻封接后,进行电容补偿。负压破膜后,进行全细胞电容补偿、串联电阻补偿。待细胞稳定后,在Gap free模式下记录ATP激活电流。采用自身对照观察多次给药后同一细胞的电流变化。在电压钳模式下记录细胞电流。细胞破膜稳定后,每隔1 min向细胞表面喷射药物(喷射时间6 ms)。给药后保持细胞外液以1.5 mL·min-1的流速灌流。给药顺序为:ATP 3.0 μmol·L-1,ATP 3.0 μmol·L-1,TNPATP 30.0 μmol·L-1+ATP 3.0 μmol·L-1混合溶液、ATP 3.0 μmol·L-1。
细胞内液(mmol·L-1)[13]:KCl 140,MgCl22,TEA-Cl 2,EGTA 11,HEPES 10,用 KOH 调节 pH 7.2,渗透压为 300 ~320 mOsmol·kg-1;细胞外液(mmol·L-1):NaCl 140,KCl 5.4,MgCl20.5,CaCl22,HEPES 10 和D-葡萄糖10,用NaOH 调节pH 7.4,渗透压为 310 ~330 mOsmol·kg-1。
1.8 统计学分析
2 结果
2.1 构建pEGFP-N1-rP2X4 重组质粒
pExpress-1-P2rx4扩增结果与1166bp的P2rx4吻合,目的条带胶回收、经双酶切后与pEGFPN1连接并转化(图1A);阳性克隆提取质粒用XhoI和EcoRI限制性内切酶双酶切鉴定(图1B),表明rP2X4基因成功克隆至pEGFP-N1载体。重组质粒测序后,通过 PubMed Blast验证,与 GenBank BC078792.1 序列 100%吻合。pEGFP-N1-rP2X4重组质粒可用于稳转细胞系构建。
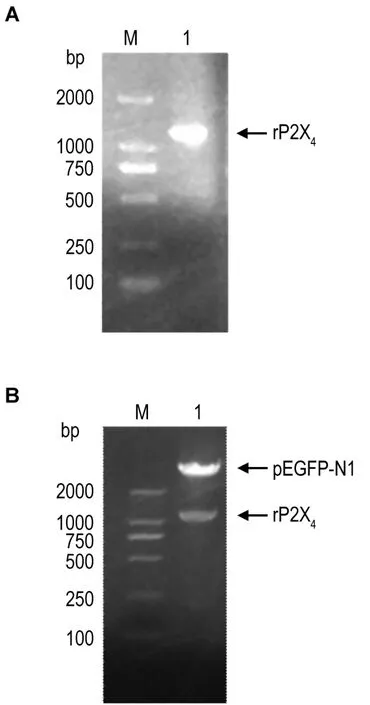
Fig.1 Construction of rP2X4product(A)and recombinant plasmids pEGFP-N1-rP2X4digested with XholⅠ and EcoR(B).M:marker.Lane 1 was construction of rP2X4product in A and recombinant plasmids pEGFP-N1-rP2X4in B.
2.2 质粒转染及单克隆
荧光显微镜下观察,确定转染效率为30% ~40%。经G418筛选,获得可能稳定表达 pEGFPN1-rP2X4细胞的单克隆20个。对所得单克隆进行绿色荧光筛选、激光共聚焦显微镜观察,筛选出荧光强度较高的细胞株,P2X4受体分布于胞浆与胞膜上,在胞浆中呈点簇状分布(图2A),Hoechst染核后,细胞核呈蓝色(图2B),两图叠合成完整细胞(图2C)。
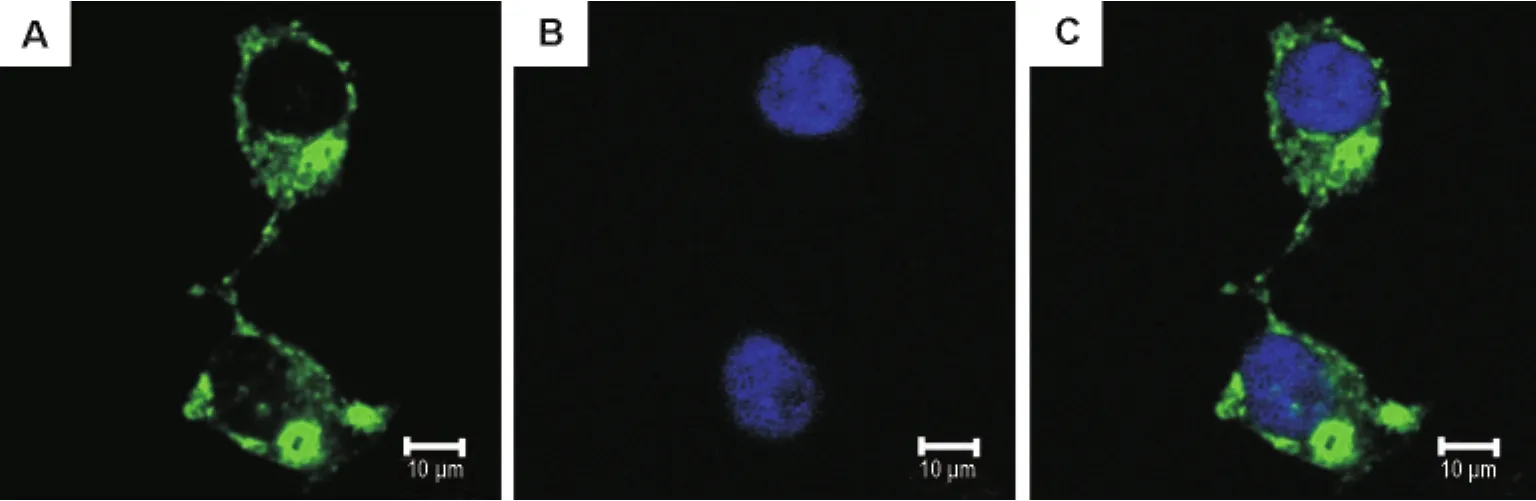
Fig.2 Green fluorescence screening of HEK293-pEGFP-N1-rP2X4.A:GFP-rP2X4;B:cell nucleus;C:merge.
2.3 rP2X4受体mRNA在HEK293-pEGFP-N1-rP2X4细胞系的表达水平
表2 结果显示,HEK293-pEGFP-N1-rP2X4 细胞系在传代1,3,5,10,15,20 和 25 代后均能稳定表达 rP2X4受体mRNA(P<0.05),提示在基因水平该细胞系能够稳定表达rP2X4受体。

Tab.2 Level of rP2X4receptor mRNA in HEK293-pEGFP-N1-rP2X4cells of different generations
2.4 rP2X4受体蛋白在HEK293-pEGFP-N1-rP2X4细胞系rP2X4受体的蛋白表达水平
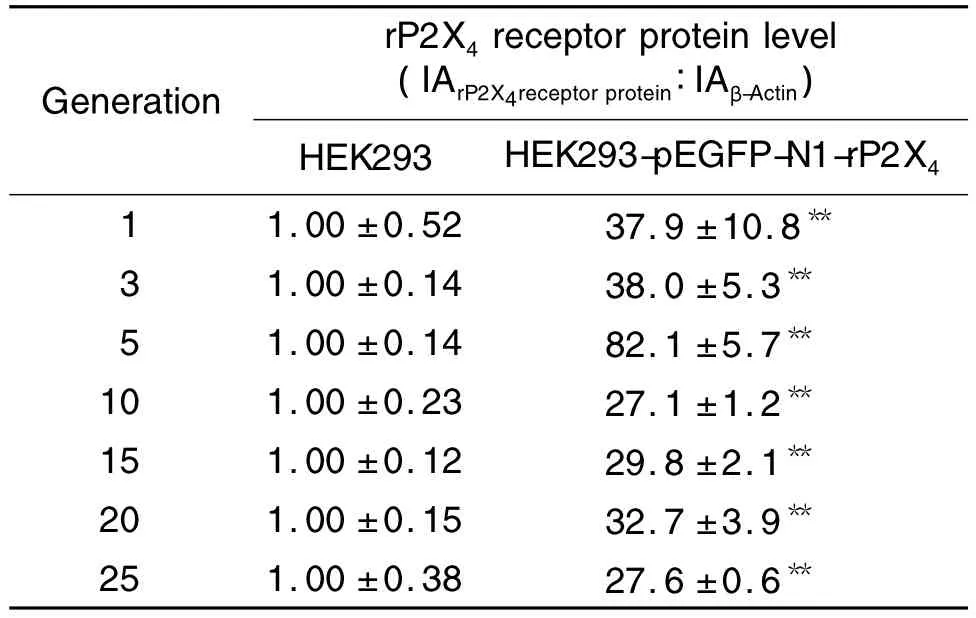
Western蛋白质印迹法结果(图3)及处理后数据(表 3)显示,HEK293-pEGFP-N1-rP2X4细胞系在传代1,3,5,10,15,20和25代后均能稳定表达rP2X4受体蛋白(P<0.05),提示在蛋白水平该细胞系能稳定表达rP2X4受体。
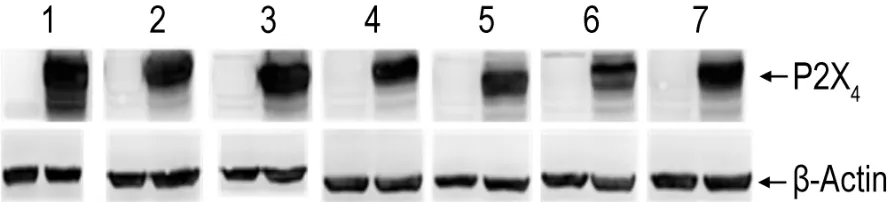
Fig.3 rP2X4receptor protein level in HEK293-pEGFP-N1-rP2X4 cells of different generations by Western blotting.Lane 1-7 were the 1st,3rd,5th,10th,15th,20th and 25th generation,respectively.
Tab.3 Level of rP2X4receptor protein in HEK293-pEGFP-N1-rP2X4cells of different generations
2.5 rP2X4受体电流在HEK293-pEGFP-N1-rP2X4细胞表现

Fig.4 rP2X4receptor current recording in HEK293-pEGFP-N1-rP2X4cells.A1:ATP 3.0 μmol·L -1ejected to cell at first time;A2:ATP 3.0 μmol·L -1ejected to cell at second time;A3:ATP 3.0 μmol·L -1and TNP-ATP 30.0 μmol·L -1ejected to cell at third time;A4:ATP 3.0 μmol·L -1ejected to cell at forth time;ejection time:6ms,ejection distance:1 min.B was the semi quantitative result of A(consequences of generation 6 and 25).A2ATPcurrent amplitude=100%;A3ATPcurrent amplitude=ADcurrent(pA)/A2current×100%.x ± s,n=3.*P < 0.05,** P < 0.01,(pA)compared with eject ATP 3.0 μmol·L -1.
传代第6代及第25代细胞的电流,如图4A,B所示。非选择性P2X4受体拮抗剂TNP-ATP能显著抑制 ATP诱导的细胞电流,其中在第6代HEK293-pEGFP-N1-rP2X4细胞上,TNP-ATP 对ATP激活电流的抑制率为45.18%(P<0.01),在第25代细胞上,其抑制率为70.91%(P<0.05)。上述结果表明,新构建的 HEK293-pEGFP-N1-rP2X4细胞系上不仅稳定表达了P2X4受体,而且该受体在激动剂刺激下表现出完整的电生理学功能。
3 讨论
1977年,Graham等[14]以人腺病毒5型DNA剪接体感染人胚肾细胞使之转化为如今广泛使用的表达工具HEK293细胞系。该细胞系具有易培养、繁殖快、可采用多种方法转染且能高效表达转染蛋白、可靠地进行蛋白翻译与加工、适合于电压钳实验等特点[15]。鉴于此,本研究选择了该细胞系为载体进行rP2X4受体稳定转染,以期能得到可稳定表达rP2X4受体且适合进行该受体机制研究的细胞系。
本研究在基因水平及蛋白水平对细胞系rP2X4受体进行确证时,rP2X4受体RNA及蛋白的变化趋势不一致,可能由于细胞中某种受体或细胞因子表达量增加时,其基因会先于蛋白表达增加。HEK293-pEGFP-N1-rP2X4细胞系在传代3 代后基因水平表达量明显升高,而其蛋白水平在传代5代后可见明显升高;细胞系传代时每皿细胞生长状态可能有所不同,且由于RNA提取及蛋白提取步骤较多,可能会影响后续检测,造成其基因与蛋白变化趋势不一致。但从细胞系mRNA及蛋白水平检测结果可以明显看到该细胞系传代25代各检测时间点rP2X4受体基因水平及蛋白水平表达量与HEK293细胞有明显差异,说明细胞系能够稳定过表达rP2X4受体。
若目的基因与EGFP基因转录后翻译形成融合蛋白,Western蛋白质印迹法对细胞系进行蛋白水平rP2X4受体的确证,检测时应出现两条rP2X4受体蛋白条带,一条是HEK293细胞内源性条带,一条是转染的外源性的EGFP-N1-rP2X4条带。根据载体及目的基因性质,将EGFP基因连接在目的基因C端,即在目的基因之后表达。目的基因带有起始密码子,而EGFP基因前自带起始密码子,重组基因含有两个起始密码子,后者干扰目的基因的起始密码子,使二者不能在转录后翻译形成融合蛋白而各自单独表达。所以本研究得到的Western蛋白质印迹法检测图中只有一条rP2X4受体蛋白条带。
本研究发现,当向稳定表达rP2X4受体的细胞喷射ATP时,P2X4受体通道打开,Ca2+内流,形成细胞膜电流;多次给予ATP后,ATP激活电流达到稳定;TNP-ATP能抑制ATP激活电流。给予TNPATP后,ATP激活电流不能马上恢复,可能是由于P2X4受体与TNP-ATP结合时间较长,未能完全解离;但明显观察到电流有部分恢复趋势,表明细胞膜P2X4受体能够再次结合ATP,证明该稳定转染细胞系功能完整。
综上所述,本研究室建立了能够稳定高表达具有功能活性的 rP2X4受体的 HEK293-pEGFP-N1-rP2X4细胞系,为研究rP2X4受体与NPP的相关性及靶向rP2X4受体的抗NPP药物奠定了基础。
致谢:感谢军事医学科学院毒物药物研究所军事毒理与生化药理研究室张淑卓助理研究员在本研究膜片钳技术方面给予的支持与帮助。
[1]Tsuda M,Masuda T,Tozaki-Saitoh H,Inoue K.P2X4receptors and neuropathic pain[J].Front Cell Neurosci,2013,7:191.
[2]Sakaba T,Neher E.Direct modulation of synaptic vesicle priming by GABABreceptor activation at a glutamatergic synapse[J].Nature,2003,424(6950):775-778.
[3]Ulmann L,Hatcher JP,Hughes JP,Chaumont S,Green PJ,Conquet F,et al.Up-regulation of P2X4receptors in spinal microglia after peripheral nerve injury mediates BDNF release and neuropathic pain[J].J Neurosci,2008,28(44):11263-11268.
[4]Kawate T,Michel JC,Birdsong WT,Gouaux E.Crystal structure of the ATP-gated P2X4ion channel in the closed state[J].Nature,2009,460(7255):592-598.
[5]Young MT, Fisher JA, Fountain SJ, Ford RC,North RA,Khakh BS.Molecular shape,architecture,and size of P2X4receptors determined using fluorescence resonance energy transfer and electron microscopy[J].J Biol Chem,2008,283(38):26241-26251.
[6]Beggs S1,Trang T,Salter MW.P2X4R+microglia drive neuropathic pain[J].Nat Neurosci,2012,15(8):1068-1073.
[7]Bo X,Zhang Y,Nassar M,Burnstock G,Schoepfer R.A P2X purinoceptor cDNA conferring a novel pharmacological profile[J].FEBS Lett,1995,375(1-2):129-133.
[8]Virginio C,Robertson G,Surprenant A,North RA.Trinitrophenyl-substituted nucleotides are potent antagonists selective for P2X1,P2X3,and heteromeric P2X2/3receptors[J].Mol Pharmacol,1998,53(6):969-973.
[9]Yamamoto K,Sokabe T,Matsumoto T,Yoshimura K,Shibata M,Ohura N,et al.Impaired flowdependent control of vascular tone and remodeling in P2X4-deficient mice[J].Nat Med,2006,12(1):133-137.
[10]Chong JH,Zheng GG,Zhu XF,Guo Y,Wang L,Ma CH,et al.Abnormal expression of P2X family receptors in Chinese pediatric acute leukemias[J].Biochem Biophys Res Commun,2010,391(1):498-504.
[11]Di Virgilio F.Purines,purinergic receptors,and cancer[J].Cancer Res,2012,72(21):5441-5447.
[12]Li YL,Yan LD,Li SY,Wen Q,Gong ZH.Stable expression of human opioid receptor-like1 in Chinese hamster ovary cells[J].Bull Acad Mil Med Sci(军事医学科学院院刊),2009,33(5):409-411,485.
[13]Priel A,Silberberg SD.Mechanism of ivermectin facilitation of human P2X4receptor channels[J].J Gen Physiol,2004,123(3):281-293.
[14]Graham FL,Smǐley J.Characteristics of human cell line transformed by DNA from human adenovirus type 5[J].J Gen Virol,1977,36(1977):59-72.
[15]Thomas P,Smart TG.HEK293 cell line:a vehicle for the expression of recombinant proteins[J].J Pharmacol Toxicol Methods,2005,51(3):187-200.

