大鼠耳蜗核团向前庭终末器官的神经投射研究
刘宏建 黄 玮(通讯作者) 孙卫国 王广科 马 崧 方志慧
1)河南省人民医院耳鼻喉科 郑州 450003 2)河南省医学情报研究所 郑州 450003 3)郑州大学解剖学教研室 郑州 450052
临床发现,一些病人在前庭神经切断术后出现耳鸣性质的改变,或耳蜗神经切断后出现眩晕或眼震,这些现象提示前庭神经系统和耳蜗神经系统可能存在着解剖上的连接[1-2]。动物实验证实,在前庭上神经束中有大量的纤维对纯音刺激有静息电位的改变[3]。上述临床现象和动物实验结果提示耳蜗系统和前庭系统可能存在着相互的神经纤维投射。本实验拟研究Wistar大鼠耳蜗核团是否存在向前庭终末器官的传出神经投射。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:健康Wistar大鼠20只,雄性,体质量(290±5)g。分为实验组和对照组,每组10只。10只动物在脑干耳蜗核团注射绿色顺行荧光示踪剂PHA-L,10只动物在脑干耳蜗核团注射生理盐水作为对照。5d后处死动物,获取耳蜗和前庭外周器官,EDTA 脱钙后行迷路连续冰冻切片,在荧光显微镜下观察荧光细胞在前庭外周器官的分布。顺行荧光神经示踪剂Lectin PHA-L Conjugates(PHA-L,Invitrogen L-11270),1mg溶于1mL 无菌去离子水中,内含Alexa Fluor 488,其吸收波长/发射波长为495nm/519nm,4℃避光保存备用。
1.1.2 实验仪器:小动物脑立体定位仪:江湾一型,国产。荧光显微镜:Leica DMR,德国。激光共聚焦显微镜:Leica DMIRZ2,德国。
1.1.3 耳蜗核团的定位方法:由于290克的成年Wistar大鼠脑已经发育成熟,可在图谱中直接读出耳蜗核团的坐标范围[3]。
1.2 耳蜗核团示踪剂PHA-L注射法 大鼠麻醉后,调节动物脑立体定位仪将定位仪两侧的耳杆插入大鼠外耳道骨部并刺破鼓膜,保持大鼠颅顶处于水平面上,将大鼠头部水平的固定于脑立体定位仪上。切开皮肤及皮下组织及颅顶骨膜后,充分止血并显露前后囟,调整高度使前后囟处于同一水平上。以前囟为基准点,确定各结构在颅顶部的垂直投影点,并在相应颅骨处钻直径约4mm 的孔,直至暴露硬脑膜。小心剪开并翻起硬脑膜,根据耳蜗核团的坐标,将一端连接0.5μL微量注射器内充注射药物的玻璃电极缓慢的插入耳蜗核团内。调整微泵注药速度为0.01μL/m,将药物导入大鼠耳蜗核团中。在注射后将电极在原位留置5 min,拔除电极后,缝合创口,动物置于原环境中饲养[4-5]。
1.2.1 迷路器官取材和脱钙:5d后大鼠麻醉,获取耳蜗和前庭迷路器官,生理盐水冲洗后放入10%EDTA 液中脱钙6~10d后连续冰冻切片。
1.2.2 组织切片的观察:晾干的切片在常温下中性树脂封片,光镜、荧光显微镜下观察拍照。
2 结果
在Wistar大鼠脑干耳蜗核团注射绿色顺行荧光示踪剂PHA-L后在注射同侧听神经和前庭终末器官发现绿色示踪剂(见图1-3),提示在Wistar大鼠耳蜗核团存在向前庭终末器官的神经投射。

图1 大鼠脑干耳蜗核团注射绿色荧光示踪剂 (荧光显微镜100×)

图2 大鼠前庭神经和终末器官发现绿色示踪剂 (荧光显微镜40×)
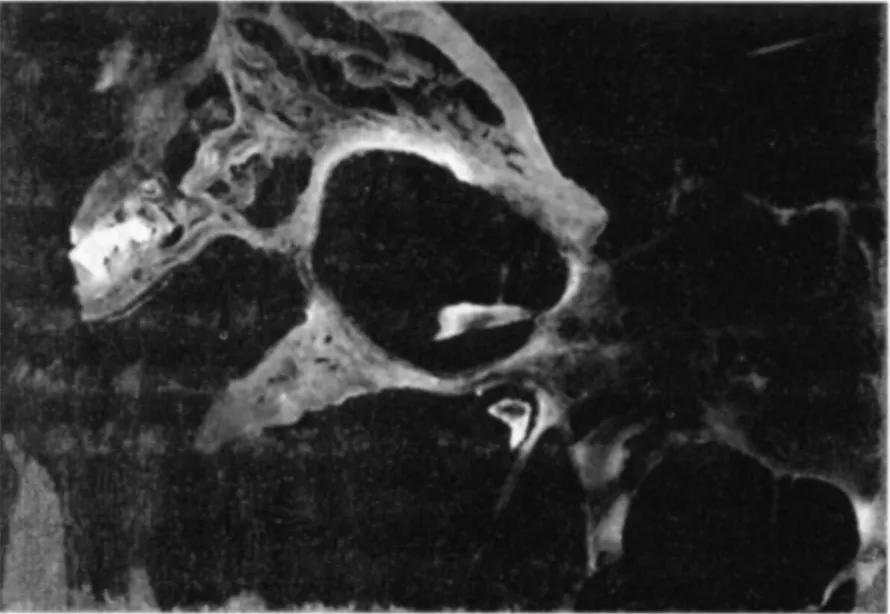
图3 大鼠前庭神经和终末器官发现绿色示踪剂 (荧光显微镜40×)
3 讨论
几个实验证实球囊存在向耳蜗核团的神经纤维投射。有实验利用辣根过氧化物酶在外周前庭注射后,发现同侧耳蜗核团内有明显的标记细胞,这些神经元和神经纤维可能是前庭和耳蜗联系的形态基础[6]。有研究证实在豚鼠球囊的前后两部分分别注射辣根过氧化物酶后,发现球囊的后部分存在向耳蜗核团的神经投射,而前部分则没有,这更加精确说明了球囊可能参与了声音的感知过程[7]。有作者在豚鼠前庭上神经和球囊注射辣根过氧化物酶和麦芽凝集素标记的辣根过氧化物酶后发现一个显著的神经纤维走行如耳蜗的背侧和后腹侧核团[8]
本实验利用顺行荧光示踪剂研究大鼠耳蜗核团向前庭终末器官的神经投射,结果发现在脑干耳蜗核团注射绿色顺行荧光示踪剂PHA-L后在听神经和迷路的前庭部分发现绿色示踪剂。这些实验结果证实Wistar大鼠耳蜗核团和前庭终末器官存在相互的神经联系。
有实验证实,耳蜗同样也存在向前庭内侧核团的相互神经投射[9],将辣根过氧化物酶注射到螺旋神经节后发现除了耳蜗核团有示踪剂外,在同侧的前庭内侧核团也发现了示踪剂,证实前庭核团存在向耳蜗的纤维投射;同时将辣根过氧化物酶注射到前庭内侧核团后发现在螺旋神经节存在示踪剂,证实在螺旋神经节处存在向前庭核团的纤维投射。在兔子的前庭核团的上侧和内侧核团注射麦芽凝集素标记的辣根过氧化物酶逆行示踪剂后,在双侧耳蜗核团的背侧核团发现标记的神经元,说明耳蜗核团存在向前庭核团的神经投射,这种神经联系可能有利于听觉和平衡感觉的相互作
用[10-12]。
[1]Pulec JL.Cochlear nerve section for intractable tinnitus[J].Ear Nose Throat J,1995,74:468-476.
[2]McCue MP,Guinan JJ Jr.Acoustically responsive fibers in the vestibular nerve of the cat[J].J Neurosci,1994 ,14(10):6 058-6 070.
[3]Labrousse M,Leveque M,Ouedraogo T,et al.An anatomical study of the vestibulocochlear anastomosis (anastomosis of Oort)in humans:preliminary results[J].Surg Radiol Anat,2005,27(3):238-242.
[4]焦宇,迟放鲁.大鼠传出前庭神经元与传入前庭神经核的神经联系[J].中华耳鼻咽喉科杂志,2004,39(8):469-471.
[5]迟放鲁,王正敏,吴利雯 .胆碱能传出性前庭神经元的分布[J].临床耳鼻咽喉科杂志,2000,14(5):220-222.
[6]Maison SF,Liberman MC.Predicting vulnerability to acoustic injury with a noninvasive assay of olivocochlear reflex strength[J].J Neurosci,2000,20:4 701-4 707.
[7]Maison S,Micheyl C,Collet L.Influence of focused auditory attention on cochlear activity in humans[J].Psychophysiology,2001,38:35-40.
[8]Baguley D.M.,Axon,P.Winter I.M etal.The effect of vestibular nerve section upon tinnitus[J].Clin Otolaryngol,2002,27:219-226.
[9]Bukowska D.Morphological evidence for secondary vestibular afferent connections to the dorsal cochlear nucleus in the rabbit[J].Cells Tissues Organs,2002,170(1):61-68.
[10]Scharf B,Magnan J,Chays A.On the role of the olivocochlear bundle in hearing:16case studies[J].Hear Res,1997,103:101-122.
[11]Wliams E.A.,Brookes G.B.Prasher D.K Effects of olivocochlear bundle section on otoacoustic emissions in humans:efferent effects in comparison with control subjects[J].Acta Otolaryngologica(Stockh),1994,114:121-129.
[12]Giraud A.L.,Collet L.,Chery-Crozes,et al.Evidence of a medial olivocochlear involvement in contralateral suppression of otoacoustic emissions in humans[J].Brain Res,1995,705(1-2):15-23.

