电刺激大鼠上矢状窦区硬脑膜后血浆与脑组织中降钙素基因相关肽、P物质和前列腺素E2释放差异
陈 健,吕新勇,孙晓萍,陈春苗,周 军,王振中,萧 伟
(江苏康缘药业股份有限公司中药制药过程新技术国家重点实验室江苏省企业院士工作站,江苏连云港 222001)
偏头痛是人类最常见的慢性疾病之一,其作用机制尚不明确。目前,对偏头痛的研究分为3种学说,尤以神经源性炎症学说得到广泛认可[1-4]。脑部血管扩张是引发偏头痛的关键[5],研究表明[6-9],电刺激大鼠硬脑膜可以引起脑部三叉神经血管系统的激活,导致血流量增加,形成电刺激硬脑膜偏头痛动物模型。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)和血管活性物质 P物质,一直被视为偏头痛发作时,神经纤维释放的重要的肽类物质,其中CGRP为偏头痛发作时脑及硬脑膜血管扩张物质,P物质为主要镇痛因子,二者参与发病机制的整个过程[10]。前列腺素E2(prostaglandin E2,PGE2)作为一种炎症因子,具有扩张血管,增加血流量的作用,但对于其参与头痛的发病机制研究,一直鲜有报道。Ebersberger等[11]通过对离体大鼠硬脑膜的顺/逆电刺激及化学刺激发现,PGE2可以促进脑膜伤害感受器激发而产生疼痛。本实验动物模型在国内外均有报道,国内学者对于模型刺激参数的研究表明,刺激频率是影响模型成功与否的关键因素[12]。实验前期,分别采用了20和3 Hz进行预试,结果表明,频率过大,易导致大鼠硬脑膜的击穿,造成大鼠死亡;频率过小,刺激时间相应增加,延长实验周期,同时降低造模的成功率。因此,本研究选择刺激大鼠脑部上矢状窦区硬脑膜,频率6 Hz,刺激时间1 h,并在刺激0,15,30 min和1 h对大鼠进行眼眶采血,1 h后取大鼠脑组织,通过对血浆和脑组织中CGRP、P物质和PGE2检测,确定电刺激过程中,大鼠外周静脉血中CGRP、P物质和PGE2释放的动态变化及全脑中含量差异。
1 材料与方法
1.1 试剂和仪器
0.9%生理盐水100 mL注射液(山东洁晶药业有限公司,批号:101111423),异氟烷(山东新时代药业有限公司,生产批号 20110604),水合氯醛(国药集团化学试剂有限公司,批号:20100304),肝素钠(效价 >170 kU·g-1,上海 SCRC630071国药集团),义齿基托树脂(Ⅱ型自凝型)每瓶100 mL(上海二医张江生物材料有限公司,批号:120409),注射用青霉素钠(山东鲁抗医药股份有限公司,批号L111102)。CGRP、P物质和PGE2放免疫试剂盒(北京华英生物有限公司,生产批号20130610)。
r-911全自动放免计数仪(中国科技大学实业总公司生产),68006双臂脑立体定位仪,台式牙科钻(深圳市瑞沃德科技有限公司生产),Medlab-v/8c生物信号采集处理系统(南京美易科技有限公司),BS224S电子天平(赛多利斯科学仪器有限公司),5804R Eppendorf冷冻离心机,MIDMARL 91805112气体麻醉机。
1.2 动物及分组处理
18只SD健康雄性大鼠,体质量400~450 g,SPF级,辽宁长生生物技术有限公司提供,生产许可证号:SCXK2010-0001。SD大鼠随机分为3组,每组6只,即正常对照组、手术对照组和模型组。
除正常对照组大鼠外,其余大鼠ip给予1 mL青霉素钠(80万单位/5 mL,0.9%生理盐水配制),ip给予10%水合氯醛麻醉。以大鼠脑部十字缝交叉点前4 mm和交叉点后6 mm,分别用台式牙科钻钻开2个直径约1 mm的圆孔,在上下2个圆孔中打入1 mm×3 mm圆头螺钉,颅面干燥后,用齿科粉和义齿基托树脂(Ⅱ型自凝型)将螺钉以及导线固定于大鼠颅骨表面,干凝后,涂撒青霉素,导线于皮外留出8 mm左右备用。术后2 d ip给予青霉素钠。术后大鼠单笼饲养,自由进食进水。
1.3 大鼠脑部电刺激及血样、脑组织采集
术后第3天,模型组大鼠经气体麻醉机麻醉,行电压3 V、频率6 Hz、脉宽0.25 ms、时间1 h电刺激,并于刺激0,15和30 min以及1 h时进行大鼠眼眶采血,用肝素管收集约1 mL全血,并置于冷冻离心机中进行离心(4℃,2862×g离心10 min),取上层血浆;1 h后取模型组大鼠脑组织,与血浆共同置于-20℃冰箱中保存。正常对照组和手术对照组大鼠麻醉后均在相应的时间点取血和脑组织。
1.4 放射免疫法检测CGRP、P物质和PGE2含量
每1 mL血浆加2 mL冷丙酮(4℃),混匀,4℃下2862×g离心20 min)。取上清加4 mL冷石油醚,混匀后再次离心。吸弃上相,下相用氮气吹干后干燥密封,待测。取大小适宜的组织块,立即称重于煮沸的生理盐水(1 mL)中煮沸3 min再加0.5 mL冰醋酸1 mol·L-1于匀浆器中匀浆提取,再用0.5 mL NaOH 1 mol·L-1中和,2862 × g 离心15 min。取上清液储存于-20℃待测。使用r-911全自动放免计数仪以及放射免疫试剂盒,对血浆及脑组织样本进行CGRP、P物质和PGE2检测。
1.5 实验数据结果用±s表示,采用 SPSS10.7软件进行单因素方差分析。
2 结果
2.1 电刺激上矢状窦区硬脑膜对大鼠血浆及脑组织CGRP含量的影响
表1结果显示,正常对照组、手术对照组和模型组大鼠眼眶血浆中CGRP在各时间点含量无显著性差异。正常对照组和手术对照组大鼠脑组织CGRP含量相近,相比模型组大鼠脑组织CGRP含量显著上升(P<0.05)。
2.2 电刺激上矢状窦区硬脑膜对大鼠血浆及脑组织P物质含量的影响
与手术对照组比较,正常对照组和模型组大鼠眼眶血浆中P物质含量无显著性差异;而在脑组织中,与手术对照组相比,模型组大鼠P物质含量最低(P <0.05)(表2)。
2.3 电刺激上矢状窦区硬脑膜对大鼠血浆及脑组织PGE2含量的影响
与手术对照组相比,正常对照组和模型组大鼠各时间点血浆中PGE2含量均无显著性差异;模型组大鼠脑组织中PGE2含量高于正常对照组和手术对照组大鼠,且与手术对照组相比,有显著性差异(P <0.05)(表3)。
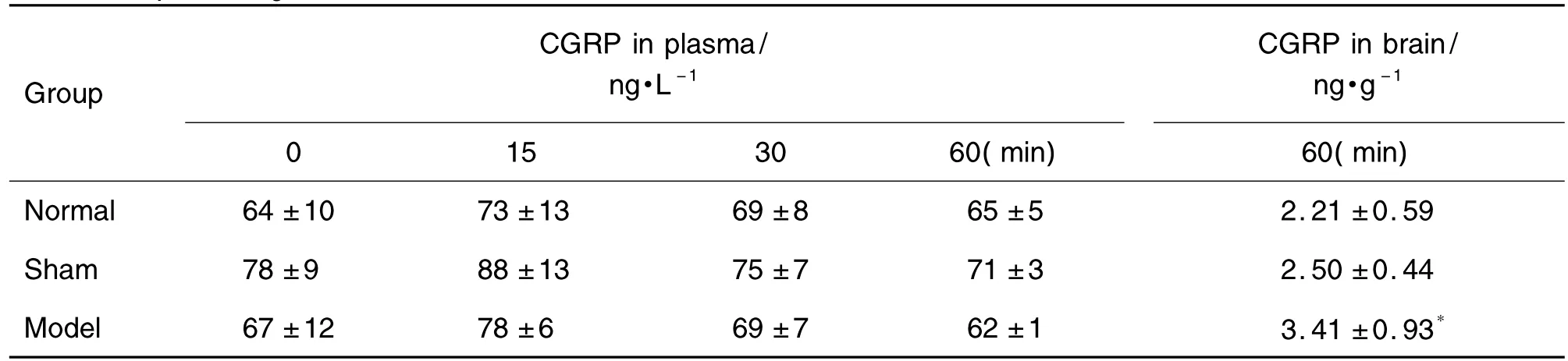
Tab.1 Content of calcitonin gene-related peptide(CGRP)in plasma and brain of rats with electrical stimulation of dura mater of superior sagittal sinus
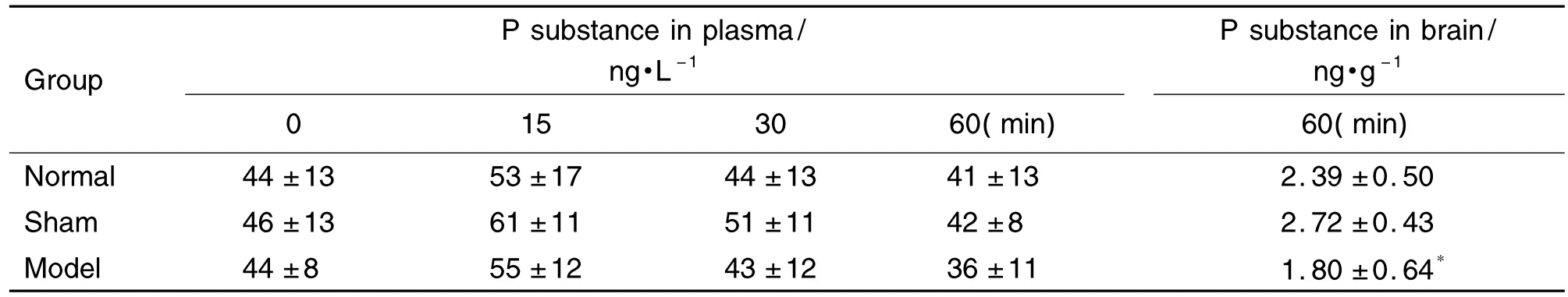
Tab.2 Content of P substance in plasma and brain of rats with electrical stimulation of dura mater of superior sagittal sinus

Tab.3 Content of prostaglandin E2(PGE2)in plasma and brain of rats with electrical stimulation of dura mater of superior sagittal sinus
3 讨论
本研究数据显示,模型组大鼠静脉血浆中CGRP、P物质以及PGE2含量随时间变化先上升后下降,脑组织中CGRP和 PGE2的含量最高,P物质的含量最低,表明脑部电极植入术未对实验产生影响。
软脑膜与硬脑膜血管收缩舒张为痛觉信号传输的来源,三叉神经为偏头痛发作时疼痛传入神经。尽管引发疼痛的机制尚不完全清楚,但是已知很多化学物质参与其中[13],它们共同激活三叉神经血管系统引发疼痛,导致血管中神经肽类和炎症因子等的释放,其中主要的神经肽即为CGRP和P物质。
外周血浆中P物质产生的变化,根据Goadsby等[14]和 Zagami等[15]研究分别显示,在电刺激猫的三叉神经节时,P物质可以增加释放量,而刺激上矢状窦区硬脑膜时,P物质含量却基本没有改变。Edvinsson等[16]通过脑膜以及血管中P物质释放研究发现对软脑膜的电刺激和化学刺激可以引起P物质释放。因此,结合本实验数据结果综合分析,在仅刺激硬脑膜时,外周血浆中P物质释放可能无法显著性增加。
CGRP在外周血浆整个释放过程中可能亦是如此。CGRP一直被认为是偏头痛病理生理学研究的基础,是一种强有力的舒张血管的肽类物质。根据对离体大鼠硬脑膜电刺激实验结果表明[14],随着脑部电刺激进行,CGRP的释放持续增加;对大鼠进行三叉神经节电刺激[17],大鼠外周血中CGRP的含量也显著增加。但董钊等[18]通过对大鼠上矢状窦旁硬脑膜行电刺激后,进行心脏取血,并对血浆中CGRP和P物质采用放射免疫法检测,结果电刺激降低大鼠血浆CGRP浓度,初步推测采血样的时机可以影响测定结果。Vessei等[19]也通过对CGRP作用的研究分析发现,血样的采集时间是影响检测结果的关键。本研究采用对大鼠脑部电刺激过程中,按不同时间点对大鼠眼眶进行连续采血,对血浆中CGRP、P物质和PGE2的含量随着刺激时间的不同,进行含量变化检测,避免了采血时机对物质含量测定的影响。
Brain等[20]通过P物质对CGRP血管舒张活性的调节研究发现,P物质释放变化可能影响CGRP的含量,升高的P物质可以激活肥大细胞产生蛋白酶从而水解释放的CGRP,达到降低脑部血管扩张作用。本研究结果显示,模型组大鼠脑组织中,CGRP的含量显著升高,P物质的含量显著降低,间接对这一推断进行了佐证。
Ebersberger等[11]通过电刺激离体大鼠硬脑膜首次发现,脑膜组织中PGE2的释放,并根据其随刺激时间的变化推断PGE2需要在CGRP等神经肽类物质先释放后,在组织中不断积累达到一定浓度时才会分泌。Kress等[21]采用体外大鼠皮肤组织逆向神经电刺激发现,PGE2的释放依赖CGRP含量变化。因此,本研究在电刺激大鼠硬脑膜时,PGE2在血浆与脑组织中释放可能受到CGRP含量影响。另外,史兆春[22]等采用电刺激大鼠三叉神经节对PGE2的释放进行检测,结果在大鼠硬脑膜中发现PGE2的含量显著增加。
临床偏头痛患者主要有脑部血管收缩舒张,痛觉过敏等症状。刺激动物的硬脑膜可以出现类似的变化,因此常采用电或化学刺激脑膜组织建立偏头痛模型[23]。偏头痛发病机制研究表明,除了神经肽类,炎症因子以外,组胺、5-HT以及内皮素等也共同参与头痛的发生[24]。Akerman 等[25]对组胺在硬脑膜血管扩张作用的研究中发现,大鼠硬脑膜电刺激时,组胺可引发脑部中动脉分支血管产生显著性扩张。另外,5-HT、内皮素等也对大鼠硬脑膜血管的扩张起到作用[26-27]。本研究结果表明,电刺激大鼠上矢状窦区硬脑膜时,血浆中除了神经肽类以及炎症因子释放外,组胺、5-HT和内皮素等其他参与头痛发生物质可能占主导作用。
[1]Wu M,Chen MJ.Progress in the pathogenesis of migraine[J].Sichuan J Physiol Sci(四川生理科学杂志),2007,29(4):173-176.
[2]Ren X,Niu ZP.Research progress in calcitonin gene-related peptide in migrains pathogenesis[J].Chin J Integ Med Cardio-/Cerebrovasc Dis(中西医结合心脑血管病杂志),2004,2(4):229-231.
[3]Williamson DJ, Hargreaves RJ. Neurogenic inflammation in the context of migraine[J].Microsc Res Tech,2001,53(3):167-178.
[4]Du YF,Wang JZ.Research progress in pathogenesis in migraine[J].Chin J Clin Neurosci(中国临床神经科学),2002,10(3):314-317.
[5]Wolff HG,ed.Headache and Other Head Pain[M],3rd ed.New York:Oxford University Press,1963:551-560.
[6]Jiang L.The pain mechanisms of migraine:gene expression microarray analysis of trigeminal nucleus caudalis after electrical stimulation of dura matter adjacent to SSS in the conscious rats(偏头痛痛觉机制:电刺激清醒大鼠上矢状窦区硬脑膜后三叉神经核尾侧复合体基因表达谱的实验研究)[D].Beijing:Chinese PLA General Hospital& Postgraduate Medical School(中国人民解放军军医进修学院),2009.
[7]Williamson DJ,Hargreaves RJ,Hill RG,Shepheard SL.Intravital microscope studies on the effects of neurokinin agonists and calcitonin gene-related peptide on dural vessel diameter in the anaesthetized rat[J].Cephalalgia,1997,17(4):518-524.
[8]Malick A,Jakubowski M,Elmquist JK,Saper CB,Burstein R.A neurohistochemical blueprint for pain-induced loss of appetite[J].Proc Natl Acad Sci USA,2001,98(17):9930-9935.
[9]Oshinsky ML,Gomonchareonsiri S.Episodic dural stimulation in awake rats:a model for recurrent headache[J].Headache,2007,47(7):1026-1036.
[10]Edvinsson L, Goadsby PJ. Neuropeptides in migraine and cluster headache[J].Cephalalgia,1994,14(5):320-327.
[11]Ebersberger A,Averbeck B,Messlinger K,Reeh PW.Release of substance P,calcitonin gene-related peptide and prostaglandin E2 from rat dura mater encephali following electrical and chemical stimulation in vitro[J].Neuroscience,1999,89(3):901-907.
[12]Dong Z,Yu SY,Zhao XM,Jiang L,Li FP,Qiu EC,et al.Effect of different electric stimulation parameters on superior sagittal sinus dura blood flow in rats[J].Chin J Microcirc(微循环学杂志),2008,18(1):13-14,19.
[13]Goadsby PJ,Edvinsson L,Ekman R.Vasoactive peptide release in the extracerebral circulation of humans during migraine headache[J].Ann Neurol,1990,28(2):183-187.
[14]Goadsby PJ,Edvinsson L,Ekman R.Release of vasoactive peptides in the extracerebral circulation of humans and the cat during activation of the trigeminovascular system[J].Ann Neurol,1988,23(2):193-196.
[15]Zagami AS,Goadsby PJ,Edvinsson L.Extracranial peptide release following stimulation of the superior sagittal sinus in the cat[J].Cephalalgia,1989,9(10 Suppl):294-295.
[16]Edvinsson L,Rosendal-Helgesen S,Uddman R.Substance P:localization,concentration and release in cerebral arteries,choroid plexus and dura mater[J].Cell Tissue Res,1983,234(1):1-7.
[17]Liu T,Shen FF,Wei JC,Wan Q.Toungning capsule's impact on the dura artery blood flow and CGRP level in the rats with electrical stimulated trigeminal ganglion[J].Chin J Pain Med(中国疼痛医学杂志),2010,16(4):220-223.
[18]Dong Z,Jiang L,Yu SY.Changes of plasma concentration of calcitonin gene-related peptide and substance P after electrical stimulation on dura mater adjacent to sinus sagittalis superior in rats[J].Chin J Rehabil Theory Pract(中国康复理论与实践),2011,17(4):334-336.
[19]Vessei L. Neuropeptideandmigraine:The role of CGRP[J].Cephalalgia,1995,15(suppl 16):3.
[20]Brain SD,Williams TJ.Substance P regulates the vasodilator activity of calcitonin gene-related peptide[J].Nature,1988,335(6185):73-75.
[21]Kress M,Guthmann C,Averbeck B,Reeh PW.Calcitonin gene-related peptide and prostaglandin E2 but not substance P release induced by antidromic nerve stimulation from rat skin in vitro[J].Neuroscience,1999,89(1):303-310.
[22]Shi ZC.Study on the mechanism that extract from chuanxiong and baizhi down regulates COX-2 and PGE2which are the inflammatory mediators on the neurogenic inflammation in the dura mater(川芎白芷萃取物下调硬脑膜神经源性炎性介质COX-2及PGE2表达的研究)[D].Nanjing:Nanjing Medical University(南京医科大学),2010.
[23]Kassuya CA,Ferreira J,Claudino RF,Calixto JB.Intraplantar PGE2causes nociceptive behaviour and mechanical allodynia:the role of prostanoid E receptors and protein kinases[J].Br J Pharmacol,2007,150(6):727-737.
[24]Guo L, Wang S, Shi XM.Neurogenic inflammation and migraine[J].Chin J Integ Med Cardio-/Cerebrovasc Dis(中西医结合心脑血管病杂志),2006,4(3):243-245.
[25]Akerman S,Williamson DJ,Kaube H,Goadsby PJ.The role of histamine in dural vessel dilation[J].Brain Res,2002,956(1):96-102.
[26]Brändli P, Löffler BM, Breu V, Osterwalder R,Maire JP,Clozel M.Role of endothelin in mediating neurogenic plasma extravasation in rat dura mater[J].Pain,1996,64(2):315-322.
[27]Goadsby PJ.The pharmacology of headache[J].Prog Neurobiol,2000,62(5):509-525.

