雷公藤多苷对糖尿病肾病大鼠的抗氧化应激作用
张玉霞,刘国玲,王家勤,李宜川,胡灵卫,芦 琨
(1.新乡医学院,河南新乡 453003;2.商丘医学高等专科学校,河南商丘 476100;3.新乡医学院第三附属医院,河南新乡 453003)
糖尿病性肾病(diabetic nephropathy,DN)的发病机制十分复杂,但近年来研究发现,氧化应激在DN的发生和发展中发挥非常重要的作用。雷公藤多苷(Tripterygium wilfordii polyglycoside,TWP)是从雷公藤植物中提取的总苷,其主要成分为环氧二萜内酯类化合物。研究报道,TWP具有抑制细胞和体液免疫功能的作用,从多个环节抑制免疫应答过程[1]。本研究通过观察TWP对DN大鼠血清过氧化氢酶(catalase,CAT)活性和超氧阴离子()含量及肾组织谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和丙二醛(malondialdehyde,MDA)含量的影响,探讨TWP对DN大鼠肾的保护作用及其可能的作用机制。
1 材料与方法
1.1 动物、药物、试剂和主要仪器
Sprague-Dawley(SD)大鼠85只,雄性,体质量160~180 g,购自华中科技大学同济医学院实验动物中心,许可证号:SCXK(鄂)2011-0007。TWP购于上海融合有限公司,纯度98.7%;链脲佐菌素(streptozocin,STZ)由美国Sigma公司提供,临用前用枸橼酸缓冲液 0.1 mol·L-1溶解(pH 4.2);血糖、肌酐清除率(creatinine clearance rate,Clcr)、尿素氮(blood urea nitrogen,BUN)、24 h尿蛋白排泄率(urinary albumin excretion rate,UAER)试剂盒均购于中生北控生物科技股份有限公司;GSHPx,MDA,和CAT试剂盒均购于南京建成生物工程研究所。Accu-Chek型血糖仪及血糖试纸(德国罗氏公司),7600型全自动生化分析仪(日本日立公司),500型酶标仪(美国Bio-Rad公司)。
1.2 糖尿病性肾病模型的制备和给药
85只大鼠按体质量随机分为正常对照组(13只)和DN模型组(72只)。模型组单次ip给予STZ 52 mg·kg-1,正常对照组 ip给予等体积0.1 mol·L-1枸橼酸缓冲液。注射 STZ 72 h 后,尾静脉采血测空腹血糖并同时测尿糖,空腹血糖≥16.7 mmol·L-1、尿糖(++)以上为糖尿病模型制备成功。参照文献[2],DM造模成功后继续喂养3周,以 3 周后空腹血糖≥16.7 mmol·L-1,尿糖+++以上、尿量大于造模前50%且24 h尿白蛋白大于造模前的50%为DN模型制备成功。将56只DN造模成功的大鼠随机分为DN模型对照组及 TWP 4.5,9.0 和18.0 mg·kg-1组,每组14 只。TWP组ip给予TWP混悬液,正常对照组和DN模型对照组ip给予等体积饮用水,每天上午给药1次,连续8周。实验期间大鼠自由饮水,正常饮食,不给予胰岛素及其他降糖药物。
1.3 生化指标测定
用药8周末称大鼠体质量,ip给予10%水合氯醛300 mg·kg-1麻醉,打开腹腔,心脏取血,离心留取血清,-20℃保存。采用血糖仪测定血糖;全自动生化分析仪检测血BUN,Scr和Ucr水平,应用公式计算,Clcr=(Ucr×每分钟尿量)/Scr。实验结束前2 d将大鼠置代谢笼,收集24 h尿液,离心,取上清,用ELISA试剂盒检测24 h UAER。
1.4 肾组织GSH-Px活性和 MDA含量及血清CAT活性和含量的测定
用药8周末,取左肾冻存。测定前取冻存的肾组织,用冷生理盐水制成10%的匀浆,硫代巴比妥酸缩合法检测MDA含量,比色法测定GSH-Px活性。取保存的血清,可见光方法检测过CAT活性,比色法测定水平。以上各指标都按照试剂盒说明书进行操作。
1.5 肾组织病理变化观察
用药8周末,取右肾,肾组织切成8 mm3小块,甲醛固定,切片,HE染色观察组织病理改变。
1.6 统计学分析
2 结果
2.1 TWP对 DN大鼠血糖、Clcr、BUN和 24 h UAER的影响
由表1可见,与正常对照组相比,模型对照组空腹血糖、BUN和 UAER均显著增高(P<0.01),Clcr明显降低(P<0.01);与模型对照组相比,TWP 3个剂量组血糖无明显改变,BUN和UAER均显著降低(P <0.01),Clcr明显升高(P <0.01)。

Tab.1 Effect of Tripterygium wilfordii polyglycoside(TWP)on glucose,creatinine clearance rate(Clcr),blood urea nitrogen(BUN)and 24 h urine albumin excretion rate(24 h UAER)of diabetic nephropathy(DN)model rats
Tab.2Effect of TWP on catalase(CAT)activity and superoxide anion()content in serum and glutathione peroxidase(GSH-Px)activity and malondialdehyde(MDA)content in renal tissue of DN rats

Tab.2Effect of TWP on catalase(CAT)activity and superoxide anion()content in serum and glutathione peroxidase(GSH-Px)activity and malondialdehyde(MDA)content in renal tissue of DN rats
See Tab.1 for the rat treatment.±s,n=13 -14.**P <0.01,compared with normal control group;##P <0.01,compared with model control group.
GroupCAT/U·L-1O÷2/kU·L-1MDA/mmol·g-1GSH-Px/kU·g -1 Normal control 602 ±153 71 ±15 2.51 ±0.15 59 ±6 Model 232 ±100** 125 ±12** 3.64 ±0.18** 40 ±4**Model+TWP 4.5 301 ±82 108 ±18 3.32 ±0.21 44 ±3 9.0 399 ±79## 94 ±20## 3.15 ±0.05## 50 ±6##18 487 ±127## 86 ±18## 3.01 ±0.09## 52 ±5##
2.2 TWP对DN大鼠血清CAT活性和含量及肾组织GSH-Px活性和MDA含量的影响
由表2可见,与正常对照组相比,模型对照组血清CAT活性和肾组织中GSH-Px活性明显降低(P<0.01),血清水平和肾组织MDA含量明显升高(P<0.01);与模型对照组相比,TWP 9.0和18 mg·kg-1组血清 CAT活性和肾组织中GSH-Px活性明显升高(P<0.01),血清水平和肾组织MDA含量明显降低(P<0.01)。
2.3 TWP对DN大鼠肾组织病理变化的影响
由图1可见,正常对照组肾小球毛细血管腔均匀一致,无狭窄,肾小管间质无炎性细胞浸润(图1A);模型对照组肾小球肥大、系膜细胞增生、肾小球变形(图1B);TWP 9 和18 mg·kg-1与模型对照组相比上述病变明显减轻(图1D和 E),18 mg·kg-1组更加明显。
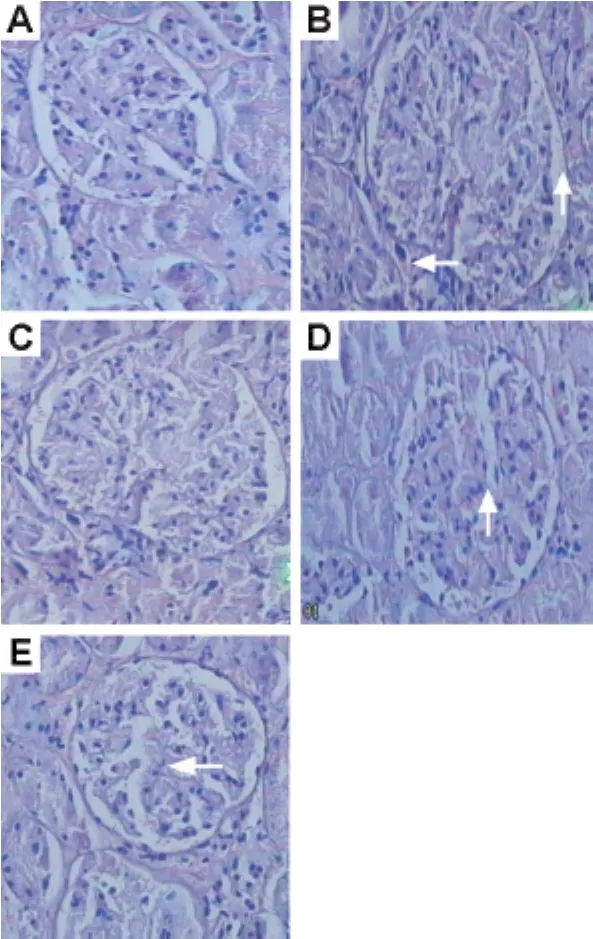
Fig.1 Effect of TWP on pathological changes of kidneys of DN rats(HE ×400).See Tab.1 for the rat treatments.A:normal group;B:model group,the arrows show glomerular hypertrophy,mesangial cell proliferation and glomerular deformation.C,D and E:TWP 4.5,9 and 18 mg·kg-1group,respectively,the arrows show significant improvement in renal pathological changes.
3 讨论
本研究结果表明,用TWP 8周后大鼠毛色明显转好,体质量增加,自发活动亦明显改善,精神、进食量和饮水量明显改善,BUN和24 h UAER显著降低,Clcr明显升高,表明TWP对DN大鼠肾有保护作用。
研究认为,2型糖尿病的发生、发展及其病程程度与自由基引发和介导的机体氧化损伤及机体抗氧化防御系统清除自由基能力平衡失调密切相关[3-4]。正常状态下,肾有完整的抗氧化酶保护系统,机体内自由基、过氧化脂质和抗氧化酶之间保持着动态平衡。糖尿病时以肾组织中糖代谢紊乱为主的多种因素造成肾组织中包括过氧化氢、和羟自由基(OH-)在内的反应性氧化产物过多[5]。MDA是机体内活性氧攻击生物膜中的多不饱和脂肪酸,引起脂质过氧化作用,进而形成的过氧化物,其含量的多少可反映机体内脂质过氧化程度,从而间接反映细胞损伤的程度[6]。本研究表明,TWP可降低损伤脂质过氧化物MDA水平和血清中含量。GSH-Px缺乏或耗竭GSH-Px会使许多化学物质或环境因素毒性作用加重,这与氧化损伤具有很大的相关性[7]。CAT也是体内重要的自由基清除剂,可分解H2O2。本研究证实,TWP可降低损伤脂质过氧化物MDA水平,增加肾组织中GSH-Px与CAT的活性。DN大鼠肾组织病理变化表现为肾小球毛细血管呈不规则增厚,肾小球毛细血管腔变狭窄,肾小球肥大、系膜细胞增生、基底膜增厚及突出融合等。本研究结果表明,TWP可减轻DN大鼠肾组织病理变化,剂量较高时,组织病理变化的改善越明显。
综上所述,TWP对DN大鼠肾具有一定的保护作用,其机制可能与其降低MDA和含量、升高GSH-Px和CAT活性、抑制氧化应激并增强机体抗氧化能力有关。
[1]Feng JM,Yu YM,An ZM,Zhao JY,Chen QY.Effect of Glucosidorum Tripterygii Totorum on glutamic acid decarboxylase antibody and islet B-cell function in patients with latent autoimmune diabetes of adult[J].China Med(中国医药),2006,1(8):468-470.
[2]Zhang Z,Huang SM,Feng M,Fu P,Yang YB,Su KL,et al.The relationship between the expression of megalin and microalbuminuria in diabetic nephropathy[J].Chin J Integrated Tradit West Nephrol(中国中西医结合肾病杂志),2006,7(4):197-200.
[3]Dewanjee S,Das AK,Sahu R,Gangopadhyay M.Antidiabetic activity of Diospyros peregrina fruit:effect on hyperglycemia,hyperlipidemia and augmented oxidative stress in experimental type 2 diabetes[J].Food Chem Toxicol,2009,47(10):2679-2685.
[4]Liu Z,Li J,Zeng Z,Liu M,Wang M.The antidiabetic effects of cysteinyl metformin,a newly synthesized agent,in alloxan-and streptozocin-induced diabetic rats[J].Chem Biol Interact,2008,173(1):68-75.
[5]Zhou ZQ,Luo J,Li Q.Protective effect of Danhong injection on renal function and its mechanism in diabetic nephropathy rats[J].Chin Gen Pract(中国全科医学),2008,11(5B):865-867.
[6]McCord JM, Edeas MA. SOD, oxidative stress and human pathologies:a brief history and a future vision[J].Biomed Pharmacother.2005,59(4):139-142.
[7]Li YF, Guo SC, Zhu CF, Peng HB,Zhang F,Liang JQ,et al.Effects of soybean isoflavone on serum SOD,MDA,GSH and NO in rats with type two dlabetes[J].Chin Remed Clin(中国药物与临床),2007,7(10):766-768.

