盐胁迫下二色补血草叶片色素的光保护作用
刘永慧,杨海莹
(山东商业职业技术学院,山东济南 250103)
在盐渍条件下,当植物吸收的光能超过其利用能力时,会出现光能过剩,从而引起光抑制,甚至光氧化、光破坏。在长期的进化过程中,植物形成了多种光保护机制来耗散过剩光能,如热耗散、活性氧清除系统及环式电子传递等。这些机制反映了植物在生理和生化以及形态结构等方面对盐渍环境的适应性。因此,盐胁迫下植物光保护机制的研究,就成为植物抗盐生理研究的一个重要课题。
叶黄素循环被认为在植物的抗光抑制中起到十分重要的作用(Niyogi 1999;Müller等2001)。叶黄素循环是指光合膜上三种色素组分-紫黄质(voilaxanthin,V)、花药黄质(antheraxanthin,A)和玉米黄质(zeaxanthin,Z)之间依据吸收的激发能过剩程度进行的相互转化(董高峰等1999)。当激发能过剩时,含双氧的紫黄质会在脱环氧化酶(VDE)的作用下,经过中间产物含单环氧的花药黄质(又名环氧玉米黄质),转化成去环氧的玉米黄质。不再含有过剩激发能时,玉米黄质和花药黄质又会在环氧化酶(ZE)的作用下形成紫黄质。其中,主要是玉米黄质行使耗散过剩激发能的功能(Niyogi 1999)。
为了避免活性氧(ROS)可能造成的伤害,植物在进化过程中形成了一套完整的抗氧化系统,包括酶促反应系统和非酶促反应系统。类胡萝卜素属于非酶促反应系统,包括叶黄素类,是膜结合的抗氧化物质,能够猝灭3Chl和1O2,抑制膜脂过氧化。花青素是一种多元酚类化合物,具有重要的生理作用;花青素能清除自由基从而减轻逆境造成的伤害,有利于逆境下植物的生长发育(Wei Kang等2007)。叶片中花青素具有光保护作用,是基于它能接受光能减少叶绿体的光能负担。
二色补血草是一种典型泌盐植物,具有较强的抗盐能力。本文通过研究不同NaCl处理对二色补血草叶片色素组分的影响,阐明了盐胁迫下二色补血草叶黄素循环的热耗散机制,并探讨了类胡萝卜素和花青素积极的光保护作用。
1 材料与方法
1.1 材料及处理
二色补血草(Limonium bicolor Bge.Kuntz)种子经0.1%HgCl2消毒10 min,用自来水充分冲洗后播种于装有细砂的塑料盆中,出苗后用1/2 Hoagland营养液浇灌,长至4~5片真叶时,移苗,每盆3棵。30多天后进行NaCl处理,预定浓度分别为0(对照)、100、200、400 mmol·L-1(NaCl溶液用完全Hoagland营养液配置),每个处理至少6个重复。为避免盐冲击效应,NaCl处理的浓度每12 h递增50 mmol·L-1,直至预定浓度。每天定时定量浇灌一次,浇灌量为细砂持水量的3倍,约2/3的溶液流出(交换以前的积余盐),以保持NaCl浓度恒定为预定浓度。处理15 d后,测定各相关指标。
1.2 光谱测量
采用 Unispec-SC光谱分析仪(PP Systems,USA)进行测定。光谱仪的光纤前端结合一个叶片夹。叶片夹使光纤与叶片表面成垂直方向60°(水平方向30°)。先将植物叶片暴露在强光下30 min,使叶黄素组分完全氧化,取受光一致的叶片进行测定。测定条件为光强为 1200 μmol·m-2·s-1,温度为26℃。由光谱仪内置光源供光。用反射率99%的白色标准板(Spectration,Labsphere,North Dutton,NH,USA)的反射除叶片的反射,得叶片的反射率。叶片的叶绿素含量是用参数mSR705来估计的(Sims和Gamon2002),也可以利用相关公式估计类胡萝卜素含量和花青素含量。

1.3 叶黄素脱环化程度(DPS)的测定
参考赵世杰等(1995)的方法。用内径为1 cm打孔器取叶圆片15个,放入研钵中,加入3.5 ml无水丙酮、少许石英砂和CaCO3,弱光和低温下研磨,匀浆后0~4℃下10275×g离心10 min,上清液供高效液相色谱测定,分析叶黄素循环组分。
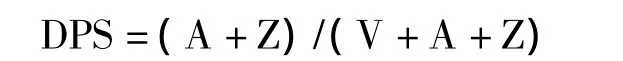
2 结果与分析
2.1 NaCl对二色补血草叶片叶绿素相对含量(Chl%)的影响
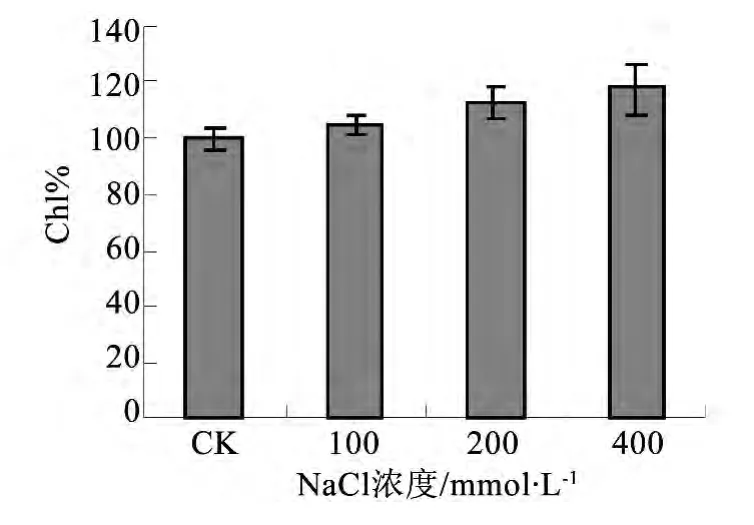
图1 不同处理对叶片叶绿素相对含量的影响
如图1,随着盐浓度的升高,叶绿素相对含量逐渐升高,且在 200、400 mmol·L-1 NaCl处理下Chl%较对照有显著的上升(P<0.05)。
2.2 NaCl对二色补血草叶片叶黄素脱环化程度(DPS)的影响
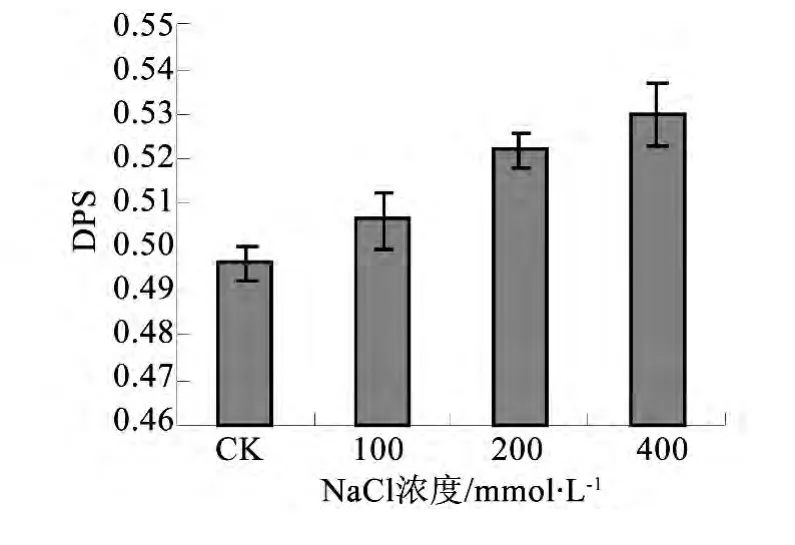
图2 不同处理对叶片叶黄素脱环化程度的影响
由图2可见,随着处理盐浓度的升高,DPS逐渐升高。在 200、400 mmol·L-1NaCl处理下 DPS较对照显著上升(P<0.05),在 400 mmol·L-1 NaCl处理下比对照增加了8.2%。
2.3 NaCl对二色补血草叶片类胡萝卜素相对含量(Car%)的影响
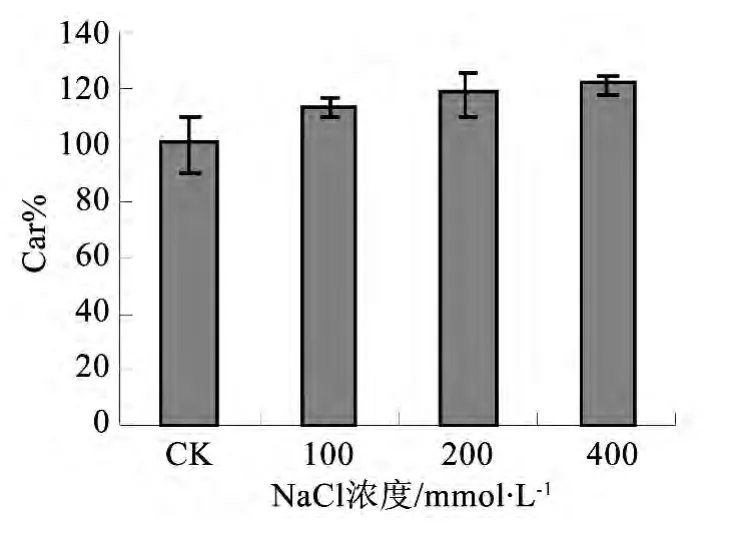
图3 不同处理对叶片类胡萝卜素相对含量的影响
如图3,类胡萝卜素相对含量随着盐度的增加而增加。在 100、200 mmol·L-1 NaCl处理下Car%与对照差异显著(P<0.05);在400 mmol·L-1 NaCl处理下Car%比对照增加了21%,且差异极显著(P<0.01)。
2.4 NaCl对二色补血草叶片花青素相对含量(Anth%)的影响
随着盐浓度的增加,花青素相对含量升高尤其显著。如图4所示,在200和400 mmol·L-1NaCl处理下,Anth%较对照分别上升了52%和66%,且差异极显著(P<0.01)。
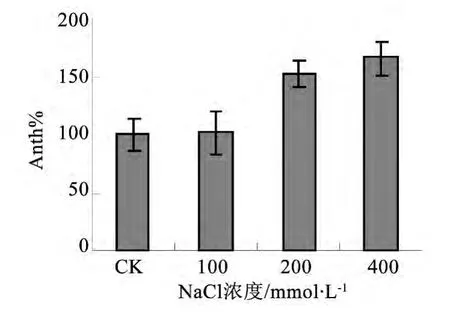
图4 不同盐处理对叶片花青素相对含量的影响
3 讨论
叶黄素是结合于LCHⅡ中的一类色素(Ruban等1994),能够与其他色素协同作用将光能传递给叶绿素。此外,叶黄素能够通过非辐射能量耗散过量的激发能从而猝灭3Chl,还可以直接清除1O2(Foyer和Harbinson 1999)。而非辐射能量耗散(NPQ)主要与依赖于叶黄素循环的能量耗散有关(Horton等1996)。
实验中,随着处理盐浓度的升高,DPS逐渐升高,其变化趋势与NPQ、qE(依赖类囊体膜内外的质子浓度差△pH的热耗散)相一致(刘永慧等2008),而且在较高盐分条件下均明显上升。表明二色补血草中依赖于叶黄素循环的能量耗散在增加,原因可能有:其一DPS的升高表明Z和A生成量的增加。毫无疑问,Z的增加,能大幅度提高依赖于叶黄素循环的能量耗散。其二可能与盐胁迫引起的pH梯度有关。依赖于叶黄素循环的能量耗散除需要Z和A之外,还需要 pH梯度(Horton等1996;Thiele和Krause 1994)。较高盐度下,qE的显著升高表明△pH也在升高。所以,在二色补血草中,不断升高的△pH是依赖于叶黄素循环的热耗散增加的前提,而后者对前者的热耗散起到“放大器”的作用。DPS与qE的变化一致,可能qE的形成与玉米黄质的合成相关。其三可能与盐胁迫引起的类胡萝卜素含量增加有关。Car相对含量随盐度升高一直在显著上升,到400 mmol·L-1NaCl处理时较对照升高极显著(P<0.01)。类胡萝卜素中包括一部分叶黄素循环的色素(Demming-Adams和Adams 1994),所以Car含量的增加可能意味着部分用于叶黄素循环的色素含量也增加了。
实验中我们还发现:盐胁迫下二色补血草叶片中类胡萝卜素和花青素的相对含量均有显著提高,这意味着二者对于二色补血草在盐胁迫下的光保护具有积极的意义。对于类胡萝卜素来说,它包括胡萝卜素、叶黄素类,是膜结合的抗氧化物质;提高其含量不仅能耗散掉天线上的过剩光能,还能够猝灭3Chl和1O2,抑制膜脂过氧化,从而稳定膜结构。对于花青素来说,其含量增多一方面可以吸收光能(主要是兰紫光和紫外线),这样就减少了叶绿体色素对光能的吸收,对植物起到保护作用,另一方面,还可以清除自由基从而减轻逆境造成的伤害,有利于逆境下植物的生长发育。不过对于这一点,我们还需要进一步的研究。
[1]董高峰,陈贻竹,蒋跃明(1999).植物叶黄素循环与非辐射能量耗散[J].植物生理学通讯,35(2):141~144.
[2]刘永慧,高静,李亭亭,王琼,范海(2008).NaCl对二色补血草气体交换及非辐射能量耗散的影响[J].山东师范大学学报(自然科学版),23(2):119~121.
[3]赵世杰,孟庆伟,许长城,韩红岩,邹琦(1995).植物组织中叶黄素循环组分的高效液相色谱分析[J].植物生理学通讯,31(6):438~442.
[4]Demming-Adams B,Adams WWIII(1994).Capacity for energy dissipation in the pigment bed in leaves with different xanthophylls cycle pools[J].Aust JPlant Physiol,21:575~588.
[5]Foyer C H,Harbinson J.Relationships between antioxidant metabolism and carotenoids in the regulation of photosynthesis(1999)[J].In Frank H A,Young A J,Britton G,Cogdell R J,eds,The Photochemistry of Carotenoids.The Netherlands:Kluwer Academic Publishers,Dordrecht,305~325.
[6]Horton P.,Ruban A V,Walters R G(1996).Regulation of light harvesting in green plants[J].Annu Rev Plant Phys,47:655 ~684.
[7]Müller P,Li X P,Niyogi K K(2001).Non-photochemical quenching:a response to excess light energy[J].Plant Physiol,125:1558 ~1566.
[8]Niyogi K K(1999).Photoprotection revisited:genetic and molecular approaches[J].Annu Rev Plant Phys,50:333~359.
[9]Ruban A V,Young A J,Pascal A A,Horton P(1994).The effects of illumination on the xanthophyll composition of the photosystem IIlight harvesting complexes of spinach thylakoid membranes[J].Plant Physiol,104:227 ~ 234.
[10]Sims DA and Gamon JA(2002).Relationships between leaf pigment content and spectral reflectance across a wide range of species,leaf structures and developmental stages[J].Remote Sensing of Environment,81:337 ~354.
[11]Thiele A,Krause GH(1994).Xanthophyll cycle and thermal energy dissipation in photosystem II:Relationship between zeaxathin formation,energy-dependent fluorescence quenching and photoinhibition[J].J Plant Physiol,144:324~332.
[12]Wei Kang,Shamsi Imran Haider,Zhang Guo - ping(2007).Synergistic interaction of NaCl and Cd on growth and photosynthetic parameters in soybean genotypes differing in salinity tolerance[J].Journal of Zhejiang University -Science B,8:266~271.

