溃疡性结肠炎患者血清IL-6、RANKL/OPG水平与骨质疏松的关系
闫小燕,李 纬,丁 辉,张立达,杨玉秀,王春荣,张延瑞,韩双印*
(1. 新乡医学院,河南 新乡453003;2. 郑州大学人民医院 影像科,河南 郑州 450003;3. 郑州大学人民医院 消化内科,河南 郑州 450003)
溃疡性结肠炎(ulcerative colitis, UC)是一种病因不明的慢性非特异性肠道疾病,遗传、免疫等因素可能在本病的发生发展中发挥重要作用,肠道黏膜对腔内抗原的异常免疫反应、致炎细胞因子分泌增多可能是主要的发病机制。UC可出现一系列的肠外表现,骨质疏松是UC患者严重却易被忽视的并发症之一。一项亚洲炎症性肠病研究[1]表明,UC患者约22% 存在骨量减少,11% 存在骨质疏松。我国UC患者的调查显示约23% 存在骨量减少,4% 被诊断为骨质疏松[2]。UC相关骨质疏松的发病机制尚未完全阐明,近年来发现促炎性细胞因子如IL-6和核因子 -κB受体活化因子配体/骨保护素(receptor activator of nuclear factor-κB ligand/osteoprotegerin, RANKL/OPG) 直接或间接地在UC患者骨质变化中产生作用。我们的研究对30例UC患者检测血清IL-6、RANKL、OPG和骨密度测量,探讨UC患者骨质疏松的发病机制。
1 资料和方法
1.1 材料
收集2012年1月至2013年8月在郑州大学人民医院住院治疗的30例UC患者及20例健康志愿者的清晨空腹外周血。患者男性16例和女性14例,年龄18 ~ 48岁,平均34 岁;志愿者男性11例和女性9例,年龄20 ~ 46 岁,平均32岁。UC诊断标准符合我国炎症性肠病诊断与治疗的共识意见( 2012,广州)[3]。研究对象均排除绝经期女性、慢性消耗性疾病、内分泌代谢性疾病,无服用糖皮质激素及其他影响骨代谢的药物史。病例取材征得患者知情同意。IL-6、RANKL及OPG检测ELISA试剂盒均购自美国R&D公司。
1.2 方法
1.2.1 IL-6、RANKL及OPG检测 采集清晨空腹肘静脉血4 mL,室温下静置20 min后,离心10 min,3 000 r/min,血清等分为0.5 mL后储存于-80 ℃,按照ELISA试剂盒说明书分别测定血清IL-6、RANKL和OPG水平。
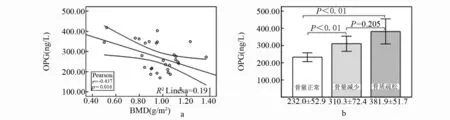
1.2.2 骨密度测定 采用数字化双能X 线骨密度仪(美国,GE公司)测定患者L1~L4的骨密度(bone mineral density,BMD),以g/m2表示。通过与数据库内储存的对照组骨量峰值数据比较,计算T值,T值是以同性别、同种族正常人的骨量峰值为基础得出的标准差值。根据世界卫生组织(WHO)定义:T 值≥-1.0 SD 为正常,-2.5 SD UC患者和健康志愿者2组受试者在性别、年龄分布无统计学差异(P>0.05)。 双能X线骨密度检查结果显示,UC患者中46.7%出现骨密度降低,其中骨量减少占36.7%(11/30),骨质疏松占6.7%(2/30),与对照组相比差异有统计学意义(P<0.01)。见表1。 表1 UC组与对照组骨密度结果比较 注:与对照组比较,*P<0.01。 UC患者血清IL-6、RANKL、OPG水平均高于对照组,2组间比较均有显著差异(P<0.01),见表2。 表2 UC组与对照组IL-6、RANKL、OPG的差异 注:与对照比较,*P<0.01。 基于骨密度变化,UC患者分为骨量正常组、骨量减少组和骨质疏松组。方差分析表明,各亚组IL-6、RANKL、OPG与对照组相比均有差异,F值分别为22.631、12.277、6.096,P值均<0.01;进一步分析显示骨量正常组IL-6、RANKL水平高于对照组(P<0.01),而OPG水平与对照组无差异;骨量减少组和骨质疏松组IL-6、RANKL、OPG水平均显著高于对照组(P<0.01)。见表3。 表3 UC不同骨密度亚组与对照组IL-6、RANKL、OPG比较 注:与对照比较,*P<0.01。 UC患者骨密度与血清IL-6、RANKL、OPG的关联分析发现,患者骨密度与IL-6及OPG水平呈负相关,与RANKL水平无相关性。UC患者随着骨密度的降低,IL-6、RANKL、OPG水平均逐渐升高,其中IL-6水平在骨量正常、骨量减少、骨质疏松3组间比较均有显著差异(P<0.01);OPG水平在骨量减少组及骨质疏松组均高于骨量正常组(P<0.01),在骨量减少组与骨质疏松组之间无统计学差异;RANKL水平随着骨丢失程度的增加虽有升高但无统计学差异。见图1、图2、图3。 图1 UC患者血清IL-6骨密度的关系 图2 UC患者血清RANKL与骨密度的关系 图3 UC患者血清OPG与骨密度的关系 近年来,UC相关骨代谢紊乱的不断增多引起人们的关注,其发病目前认为与炎症因子的激活、维生素D缺乏、低体重指数、遗传因素及糖皮质激素治疗等有关。UC患者肠道的异常免疫反应,一方面表达了多种促炎细胞因子如IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)-α、IL-1、IL-8 等导致肠道黏膜免疫损伤和炎症反应,另一方面,活化的T淋巴细胞通过RANKL影响骨代谢。我们的研究对UC患者血清IL-6、RANKL及OPG 进行检测,分析其与UC患者骨密度的相关性,探讨其在UC相关骨代谢紊乱发病机制中的意义。 IL-6 是一种多功能的细胞因子,在炎症反应、免疫调节和骨代谢过程中起重要作用。临床研究[4-6]显示,UC患者血清 IL-6 水平明显升高,且与病变严重程度和局部炎症严重程度一致。IL- 6 也是主要的破骨细胞调节因子之一,可刺激破骨细胞的增殖和功能的表达,并抑制成骨细胞的功能[7]。在我们的研究中,UC患者血清 IL-6 水平明显高于对照组,而且 IL-6 水平在UC 3 组间有显著差异,骨量正常组<骨量较少组<骨质疏松组;相关性分析也表明 IL-6 与腰椎骨密度呈显著负相关,说明 IL-6 在参与UC病理过程的同时对骨代谢产生重要影响。 RANKL是TNF家族成员,在骨代谢及免疫反应中发挥至关重要的作用[8-11]。RANKL与其特异性受体RANK结合,会触发破骨细胞的产生进而导致骨丢失;而OPG可竞争性与RANKL结合,抑制破骨细胞的活化,促使破骨细胞凋亡。RANKL/OPG的平衡是维持正常骨代谢所必需的。来源于活化的T淋巴细胞的RANKL,可引起破骨细胞的活化、促进骨质丢失[11]。Moschen等[12]对180名IBD患者的研究表明,RANKL能够促进IBD的发展且可导致IBD相关的骨质破坏。一项动物实验[13]显示,对IL-2基因缺陷小鼠补充外源性OPG可改善肠道炎症和逆转骨丢失,说明免疫反应和T淋巴细胞在骨丢失中的作用。在我们的研究中,血清RANKL和OPG水平在UC患者显著高于对照组,且UC组中随骨密度的降低其水平逐渐升高;OPG水平与骨密度呈显著负相关,提示OPG水平的增加可能代表骨代谢稳态的反应,旨在扭转骨质疏松维持正常的骨量,但其增高的程度并不足以扭转T淋巴细胞产生的RANKL所致的骨丢失。这与Turk等[14]的研究结果基本一致。 我们的研究表明,IL-6、RANKL/OPG不仅参与UC相关骨质破坏的发生,且与其严重程度密切相关,测定UC患者血清IL-6、RANKL/OPG水平可反映其骨质疏松情况。通过对促炎细胞因子及RANKL/OPG的深入研究,可更好地了解UC相关骨质疏松的病理机制,对其预防和临床诊断具有临床指导意义。 参考文献: [1] Ezzat Y, Hamdy K. The frequency of low bone mineral density and its associated risk factors in patients with inflammatory bowel diseases [J]. Int J Rheum Dis, 2010, 13(3): 259-265. [2] 谭蓓,李攀,钱家鸣,等. 骨代谢指标可用于评估炎症性肠病患者骨密度状况吗? [J].中华骨质疏松和骨矿盐疾病杂志,2012,5(3):173-178. [3] 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012 年·广州) [J].胃肠病学,2012,17(12):769-781. [4] 宋爱玲. TNF-α、IL-6、IL-8水平与溃疡性结肠炎严重程度相关研究 [J].中国实用医药,2008,3(36):3-4. [5] 厉洁,曲海霞,卫红军,等. 溃疡性结肠炎患者炎症黏膜中IL-6、IL-23 的表达及其临床意义[J].胃肠病学,2011,16(3):164-166. [6] Bernardo D, Vallejo-Díez S, Mann E R, et al. IL-6 promotes immune responses in human ulcerative colitis and induces a skin-homing phenotype in the dendritic cells and Tcells they stimulate [J]. Eur J Immunol, 2012, 42(5):1 337-1 353. [7] Veerappan S G, O’Morain C A, Daly J S, et al. Review article: the effects of antitumour necrosis factor-αon bone metabolism in inflammatory bowel disease [J]. Alimentary pharmacology & therapeutics, 2011,33(12):1 261-1 272. [8] Weitzmann M N. The Role of Inflammatory Cytokines, the RANKL/OPG Axis, and the Immunoskeletal Interface in Physiological Bone Turnover and Osteoporosis [J]. Scientifica, 2 013(2 013):125 705. [9] Xiong J H, O'Brien C A. Osteocyte RANKL: new insights into the control of bone remodeling[J]. J Bone Miner Res, 2012, 27(3): 499-505. [10] Baud’huin M, Duplomb L, Teletchea S, et al. Osteoprotegerin: Multiple partners for multiple functions [J]. Cytokine Growth Factor Rev, 2013, 24(5): 401-409. [11] Takayanagi H.Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems [J]. Nat Rev Immunol, 2007, 7(4): 292-304. [12] Moschen A R, Kaser A, Enrich B, et al. The RANKL/OPG system is activated in inflammatory bowel disease and relates to the state of bone loss [J]. Gut, 2005, 54(4): 479-487. [13] Ashcroft A J, Cruickshank S M, Croucher P I, et al. Colonic dendritic cells, intestinal inflammation, and T cell-mediated bone destruction are modulated by recombinant osteoprotegerin [J]. Immunity, 2003, 19(6): 849-861. [14] Turk N, Cukovic-Cavka S, Korsic M, et al . Proinflammatory cytokines and receptor activator of nuclear factor kappa B-ligand/ osteoprotegerin associated with bone deterioration in patients with Crohn’s disease [J]. Eur J Gastroenterol Hepatol, 2009, 21(2): 159-166.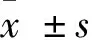
2 结果
2.1 一般资料
2.2 UC组与对照组骨密度的差异

2.3 UC组与对照组血清IL-6、RANKL、OPG水平的差异

2.4 UC患者不同骨密度亚组与对照组IL-6、RANKL、OPG的比较
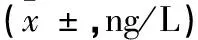
2.5 UC患者IL-6、RANKL、OPG与腰椎骨密度的关系
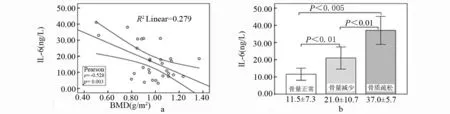
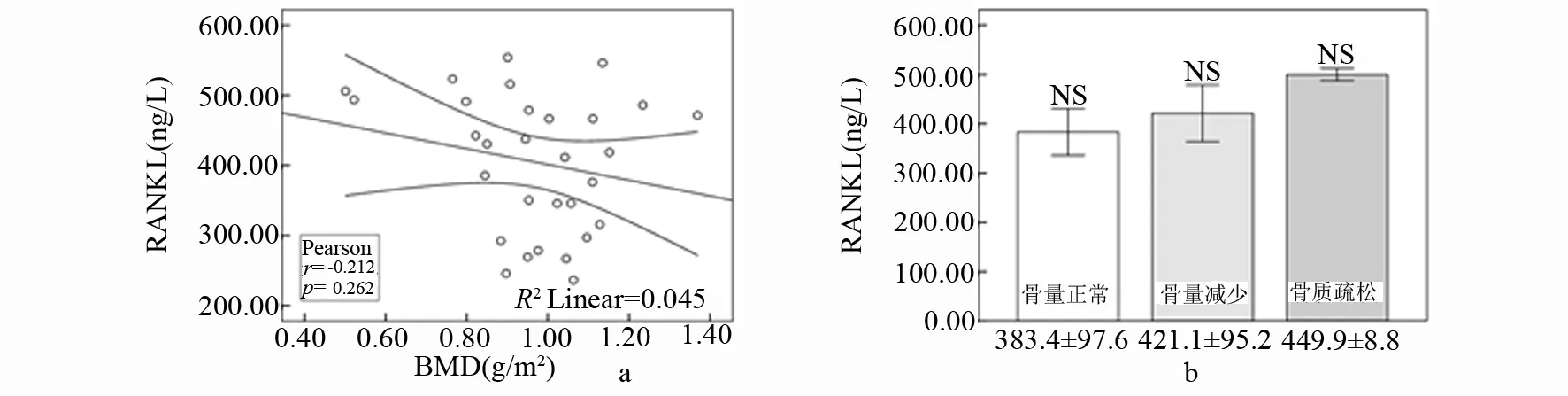
3 讨论

