等离子体-紫外复合诱变选育四羟基环孢菌素衍生物高产菌株
章 丽,戴 梦,郑桂珍,赵 颖,刘 静,张 佳,王富强
(华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心,河北石家庄 050015)
P450酶是一类血红素结合蛋白,能区域选择性的羟基化环孢菌素。经人体肝脏内的P450酶作用,环孢菌素 A(CyA)在代谢中可产生[γ-HyMeLeu4]CyA,其4位甲基亮氨酸被羟基化后的环孢菌素衍生物较之CyA极性更强,失去了免疫抑制活性,抗菌谱窄,保持了抗真菌和促毛发生长作用[1],[γ-HyMeLeu4]CyA化学结构见图1。稀有放线菌Nonomuraea dietziae可编码表达P450酶,在该菌发酵过程中添加前体CyA可以一步合成[γ-HyMeLeu4]CyA[2],较之化学合成法,生物体内转化合成产物单一,便于生产上的分离提取[3],对环境污染小更加环保。生产上,利用本实验室保存的菌株Nonomuraea dietziae转化合成[γ-HyMeLeu4]CyA,但是该出发菌株转化能力低,不适应大规模生产需要。为获得高转化能力的菌株,本研究采用常温常压等离子体射流诱变(ARTP)和紫外照射(UV)对该菌进行复合物理诱变,最终获得了高效且具有稳定遗传性能的菌株。
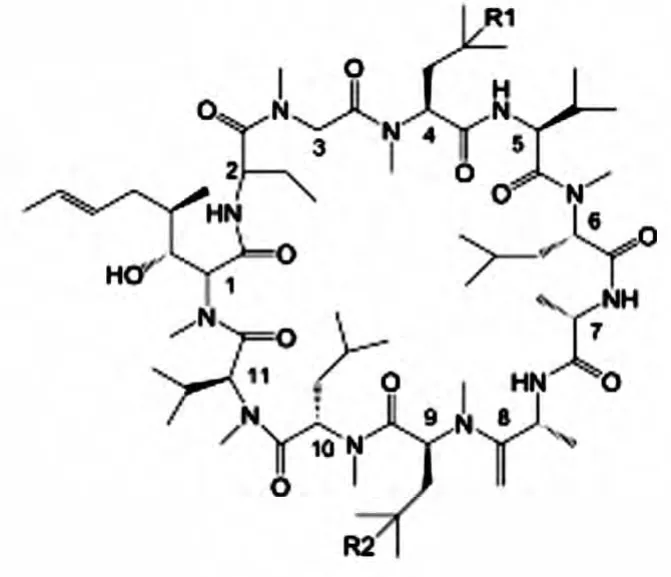
图1 CyA化学结构式(R1-H,R2-H),[γ-HyMeLeu4]CyA化学结构式(R1-OH,R2-H)Fig.1 Chemical structures of cyclosprin A(R1-H,R2-H),Chemical structures of[γ-HyMeLeu4]CyA(R1-OH,R2-H)
1 材料与方法
1.1 材料
1.1.1 菌株 出发菌株Nonomuraea dietziae由本实验室保存;菌株ZL-11由本研究经等离子诱变获得;菌株ZL-21由本研究经紫外诱变获得。
1.1.2 培养基(%) ①分离及斜面培养基:酵母粉0.4,麦芽粉1.0,葡萄糖0.4,琼脂2,pH 7.0;②种子培养基:淀粉1.0,葡萄糖0.7,麦芽粉0.5,酵母粉0.5,蛋白胨0.5,碳酸钙0.7,pH 7.0;③发酵培养基:糊精1.2,葡萄糖3.0,酵母粉0.9,蛋白胨0.5,黄豆饼粉1.5,pH 7.2。
1.1.3 主要仪器 常温常压等离子体射流诱变机由清华大学电气与电子工程学院脉冲功率中心提供。
1.2 方法
1.2.1 等离子体诱变 取出发菌株单孢子悬液10 μL涂布于直径0.5 cm的不锈钢片上,处理时间从2 min开始,依次增加到8 min。等离子器照射条件:距离2 mm;注入气体为氦气;气流量10 L/min;照射功率100 W。用1 mL蒸馏水将照射后不锈钢片上的孢子洗下,再以10倍梯度稀释至10-4,涂布于分离培养基上。
1.2.2 紫外诱变 取菌株单孢子悬液25 mL用带有数十颗玻璃珠的三角瓶打散,过滤后补水至25 mL,每玻璃平皿取4 mL,紫外照射时间从10 s开始,依次增加到60 s。紫外照射条件:功率15 W,照射距离35 cm。
1.2.3 斜面培养 用竹签挑选单个菌落转接于斜面培养基,28℃下培养15 d。
1.2.4 摇瓶培养 斜面上的孢子接种于种子培养基中,28℃,220 r/min下培养44~48 h,然后以10%的接种量接种于发酵培养基中,28℃,220 r/min摇床培养48 h后添加前体CyA,补料96 h后放瓶测定单位。
1.2.5 样品检测 将4 mL发酵液倒入刻度离心管中,加入1 mL无水乙醇,3 000 r/min离心10 min后取上清液,HPLC法测发酵单位(μg/mL)。
2 结果与分析
2.1 等离子体诱变选育
2.1.1 等离子体诱变条件确定 等离子体诱变是直接在生物分子上沉积能量,破坏单核苷酸的磷酸二酯键,依据核苷酸序列不同将寡核苷酸降解成不同的小片段[4],从而达到诱变育种的目的。出发菌株孢子悬液经不同时间照射处理后,稀释至10-4后涂布分离培养平板上,培养12 d后统计个数,通过与对照组比较,计算致死率。根据公式:致死率(%)=100%×(对照组活菌数(mL)-诱变组活菌数(mL))/对照组活菌数(mL),得到每个诱变时间下的致死率,如图2所示。由等离子体诱变结果可以看出,采用该法对出发菌株进行不同时间的照射,随着诱变时间的延长,致死率逐渐增加。

图2 等离子体诱变剂量与致死率、正突变率关系Fig.2 The relationship between death rate and positive mutation rate by ARTP
2.1.2 等离子体诱变菌株选育 从分离培养基上共挑选976株单个菌落传斜面和摇瓶筛选,HPLC测单位,计算菌株正突变率。根据公式:正突变率(%)=(每组处理计量发酵单位高于对照菌株的个数/每组处理计量挑选的菌落个数)×100%,得到不同处理计量下的正突变率。由图2可以看出,当处理时间为6 min时,菌株的正突变率最大。随着处理时间的延长,正突变率呈下降趋势,并不利于工业生产中筛选高产菌株。因此,选择6 min作为等离子体诱变该菌种的最佳时间。经摇瓶筛选,最终得到的突变菌株ZL-11产量为247 μg/mL,比出发菌株提高约21%。
2.2 紫外诱变选育
2.2.1 紫外诱变条件确定 对等离子体诱变处理后的菌株ZL-11选取不同时间进行紫外诱变。紫外线的主要作用是使DNA双链之间或同一链上形成胸腺嘧啶二聚体以改变DNA生物活性,造成微生物变异甚至死亡[5]。由图3可知,在40 s时,该菌的致死率已达到96.5%;在60 s时,该菌的致死率高达99.8%。
2.2.2 紫外诱变菌株选育 紫外线有较强的杀菌能力,相对于其他菌株,该稀有放线菌对紫外照射更为敏感,较高的致死率有利于筛选优良菌株,但是如果处理时间太长,一些高活性菌株也可能致死,不利于筛选。由图3可知,在40 s时,该菌的正突变率最高,为15.3%,因此选取40 s作为诱变处理时间。紫外照射处理后的孢子稀释涂平板,从分离培养基上共挑取1 373个形态良好产孢丰富的单菌落。经摇瓶筛选,得到突变菌株ZL-21产量达到269 μg/mL。

图3 紫外诱变剂量与致死率、正突变率关系Fig.3 The relationship between death rate and positive mutation rate by UV
2.3 诱变菌株遗传稳定性分析
通过诱变方法筛选出的高产菌株经过连续传代后往往会产生回复突变,出现生产性状“衰退”[6]。因此,为检测经等离子体-紫外复合诱变得到的高产菌株ZL-21的遗传稳定性,对其进行传代复试,连续传代6次,以考察其遗传稳定性,结果见表1。由表1可看出,随着传代次数增加,单位呈下降趋势,但幅度不大,表明该菌株遗传性状比较稳定。

表1 菌株ZL-21传代实验Table1 The experiments of ZL-21 strain passage
3 讨论
诱变育种是指用物理、化学等因素诱导物种的遗传特性发生变异,从而培育新品种的育种方法。常用的物理法如X光线照射和化学法如NTG处理本身对人体也有伤害,操作起来比较困难。本研究采用的等离子体诱变具有射流温度低、产生的等离子体均匀、无需真空装置、操作简易、成本低下等优点,可以快速有效地突变细菌、微藻、真菌、酵母等微生物。该方法运用于Streptomyces avermitilis的选育中,在该菌的诱变中其正突变率达到21%,组分B1a所占比例从38%提高到61%[7],取得了显著的效果。本研究首次在Nonomuraea dietziae上运用了等离子体诱变这种技术,试验结果证明等离子体诱变技术在该菌育种中切实可行。
关于[γ-HyMeLeu4]CyA转化菌,特别是具有工业应用前景的高产菌株还未见报道,本研究采用等离子体-紫外复合诱变筛选具有高转化率的菌株,有效避免了使用单一诱变剂产生的诱变饱和效应,选育出的高产菌株摇瓶单位比出发菌株提高了32%左右,并且从获得诱变菌株的传代试验得出,诱变菌株具有良好的遗传稳定性。当然,菌种的选育只是提高转化率的途径之一,若要全面提高菌株的转化能力,还可以从培养基配方和发酵工艺的优化方面着手,使之适应工业化大规模生产。
[1]Kim S N,Ahn H J,Kim M K.,et al.Nonimmunosuppressive[gamma-hydroxy-methyl Leucine4]cyclosporin A,hair growthstimulator and external composition for skin using the same USP 6521595[P].2003.
[2]Kuhnt M,Bitsch F,France J,et al.Microbial biotransformation products of cyclosporin A[J].J Antibiot(Tokyo),1996,49(8):781-787.
[3]Eberle M K,Francois N.Synthesis of the main metabolite(OL-17)of cyclosporin A[J].J Org Chem,1992,57:2689-2691.
[4]Li G,Li HP,Wang LY,et al.Genetic effects of radio-frequency,atmospheric-pressure glow discharges with helium[J].Appl Physics Lett,2008,92(22):221-504.
[5]Egan R S,DeVault R L,Mueller S L,et al.A new antibiotic XK-62-2 III The structure of XK-62-2,a new gentamicinC copmlex antibiotic[J].J Antibiot,1975,28(1):29-33.
[6]周德庆.微生物学教程(第2版)[M].北京:高等教育出版社,2002:213-216.
[7]Wang LY,Huang ZL,Li G,et al.Novel mutation breeding method forStreptomyces avermitilisusing an atmospheric pressure glow discharge plasma[J].J Appl Microbiol,2010,108(3):851-858.