养殖中华绒螯蟹肠道内优势细菌群组成分析
狄盼盼,陈小兵,孙国伟,肖劲洲,潘迎捷
(上海海洋大学农业部水产品贮藏保鲜风险评估重点实验室,上海 201306)
中华绒螯蟹(Eriocheir sinensis)属节肢动物门(Arthropoda)、甲壳纲(Crustacca)、十足目(Decapoda)、方蟹科(Grapsidae)、绒螯蟹属(Eriocheir)[1],又称河蟹、毛蟹、清水蟹、大闸蟹或螃蟹,主要分布在亚洲北部、朝鲜西部和中国[2]。因其肉味鲜美,营养丰富,成为我国名贵的淡水养殖品种之一。我国中华绒螯蟹的养殖始于20世纪80年代,进入21世纪后其产业得到了迅猛发展,成为我国水产养殖的支柱产业之一。江苏、安徽、湖北、辽宁、天津等11个省市是我国的主要产区,产量超过49万 t,年产值超过250亿元[3]。近年来随着养殖规模的迅猛增长,蟹病害频发,致使环境污染严重,养殖风险增大,严重影响了该产业健康持续发展。尤其是病害高发问题已成为目前蟹养殖业健康发展的主要瓶颈[4-5]。同时,水生动物的一些肠道内的和经肠道感染的重要疾病都往往与肠道细菌密切相关[6],研究肠道细菌对这些疾病发生和病原菌入侵过程中的变化,有助于了解这些疾病的发生机理和探索疾病的防治途径。同时,将水生动物肠道内正常细菌和其他有益菌制成的益生菌剂投喂水生动物,可以维持健康、预防疾病、增强抗病免疫力,有利于水生动物的生长和繁殖[7]。目前,对肠道细菌群落的研究主要集中在人体和陆生大型哺乳动物[6,8-10],水生动物的研究也多集中于鱼类和虾类[11-13],而针对中华绒螯蟹肠道微生物的研究至今仅有1篇文章发表于2007年[12]。通过DGGE、16S rRNA克隆文库以及Real-time PCR方法对池养和野生养中华绒螯蟹肠道内微生物多样性进行研究,发现拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)在肠道内占有绝对优势。同时池养中华绒螯蟹肠道内更多的是拟杆菌门,野生养中更多的是变形菌门。中华绒螯蟹肠道内菌群数量为n×106~n×107/μL。基于分子生物学的方法虽然简捷又高效,但培养获得的微生物往往是环境生物群落中最能反映生态环境特征的类群。因此本研究采用分离培养技术和分子生态学手段相结合的方法,研究检测养殖中华绒螯蟹肠道内可培养细菌的菌群结构,这不仅丰富了已有的中华绒螯蟹肠道微生物的研究,也促进了其更全面更深入的发展,对养殖中华绒螯蟹的益生菌开发和病害防治有重要的意义。
1 材料与方法
1.1 材料
1.1.1 实验材料 中华绒螯蟹(2011年9月采自太湖3只健康雌性成蟹,平均体重150 g)。
1.1.2 实验试剂 75%乙醇、0.01 mol/L PBS、甲醛、SYBR GreenI(索莱宝)、p-phenylenediamine、封片剂(或者无色指甲油)、细菌基因组提取试剂盒、PCR产物回收试剂盒(天根)。
1.1.3 培养基 EMB和厌氧琼脂(上海创赛科学仪器有限公司);TSA、TCBS、脑心浸液(北京陆桥技术有限责任公司)。
1.2 方法
1.2.1 样品处理 样品先后用自来水、无菌水冲洗,75%乙醇体表消毒,于超净台内无菌条件下解剖取出肠道,混于4 mL 0.01 mol/L PBS用无菌石英研磨棒研磨至匀浆,3 220×g离心2 min。小心吸取上清,梯度稀释(1 mL菌液+9 mL PBS),获得原液及10-1、10-2、10-3和10-4梯度稀释液,每个梯度3个平行,之后分别用于荧光染色计数和培养分离。
1.2.2 荧光染色计数 各梯度混匀后取1 mL过滤至0.22 μm滤膜。参考Patel等[14]方法,首先用甲醛对肠道细菌进行固定,而后用SYBR GreenI进行染色,用封片剂封片后即可在荧光显微镜下进行观察。记录结果后根据文献内提供的方法进行肠道菌群计数。
1.2.3 菌株分离培养 采用5种培养基TSA、TCBS、脑心浸液、EMB[15-16]和厌氧琼脂,分别吸取100 μL涂布到相应的平板培养基上TCBS涂布-1、-2梯度稀释液,其余4种涂布-3、-4梯度稀释液),29℃培养24 h。培养出的菌落用相机记录其形态,并通过菌落形态进行初筛,选择代表菌株用已灭菌的枪头挑取适量菌落,依据细菌基因组提取试剂盒进行总基因组DNA的提取。
1.2.4 16S rRNA基因的PCR扩增 以制备的细菌基因组DNA为模板,27F(5'-GAGAGTTTGATCCTGGCTCAG-3')和1492R(5'-CTACGGCTACCTTGTTACGA-3')为引物,进行细菌16SrRNA的扩增。25 μL的PCR反应体系中包含2.5 mmol/L的dNTP混合物2 μL,10×PCR反应缓冲液2.5 μL,10 μmol/L引物各1 μL,1 μL模板,1.5 U的TaqDNA聚合酶(TaKaRa)。PCR扩增程序:95℃变性4 min,然后进入30个循环:94℃变性45 s,55℃退火45 s,72℃延伸1 min。最后72℃延伸10 min。遵循PCR产物回收试剂盒,对扩增产物进行纯化,纯化产物测序(上海迈浦生物科技有限公司)。
1.2.5 数据统计 首先运用Lasergene软件的SeqMan子软件,去除测序结果中的pGMT载体序列,检查并完成拼接,拼接后的序列长度约1 500 bp。所得序列用RDP(Ribosomal Database Project)中的Classifer进行序列相似性比对并分类,阈值为95%;染色计数的数据用Excel进行统计学分析;分离培养菌株所测序列上传至NCBI,获得的登录号为:KF953986-KF954029。
2 结果与分析
2.1 荧光染色计数
显微镜下观察肠道细菌染色结果,如图1。
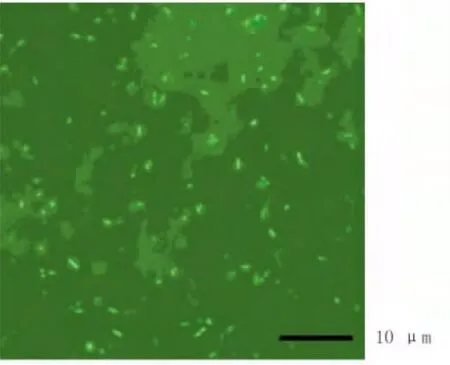
图1 中华绒螯蟹肠道细菌SYBR Green I荧光染色(1 000×)Fig.1 Epifluorescence-microscopy image of crab gut homogenate sample filtered onto a isoporeTM0.2 μm membrane filter stained with SYBR Green I(1 000×)
使用荧光显微镜的目镜测微尺,参考Patel[14]的方法计数中华绒螯蟹肠道内的菌群数量(n=3),通过Excel分析,肠道内细菌的数量为(2.5±0.9)×106/μL。
2.2 菌株分离培养
中华绒螯蟹肠道内可培养菌的菌落形态如图2所示,不同培养基所分离的细菌形态各异,直径0.1~2 mm大小不等,颜色深浅不一,形状有的规则,有的边缘凹陷,表面有的干燥,有的有光泽,边缘有的光滑,有的向四周凸起,有些中心厚四周薄,有些则是一侧厚,从中挑选代表菌落测序。

图2 中华绒螯蟹肠道内可培养细菌的形态Fig.2 Morphology of the cultured bacteria of crab gut
2.3 克隆测序
根据菌落形态,共筛选了49株菌落送去测序,结果如表1所示,分为7个种系型(phylotype)。所有的类群都属于γ-变形菌纲(Gammaproteobacteria),其中假单胞菌属(Pseudomonas)、气单胞菌属(Aeromonas)和肠杆菌科(Enterobacteriales)为优势菌群。
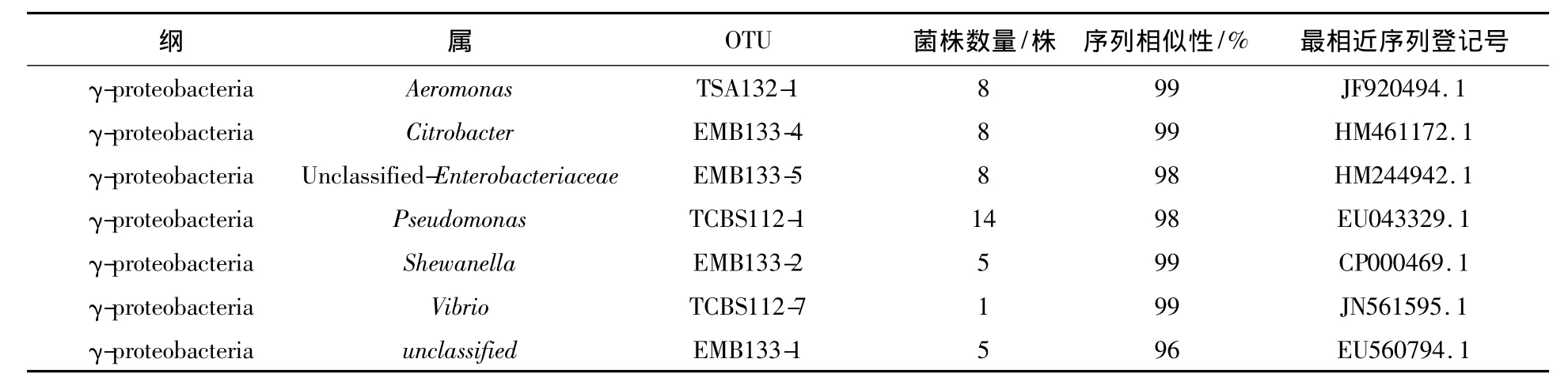
表1 中华绒螯蟹肠道内可培养细菌多样性Table1 Phylotypes of bacterial community in Chinese mitten crab intestines
3 讨论
研究发现,荧光染色计数比较Li等人[12]的荧光定量PCR的结果略有偏低。结合样品处理方法分析,此结果是合理的。每种方法都会或多或少受其自身的影响,荧光染色计数也不例外。样品在过膜前必须通过离心将组织碎屑等除去,减少背景干扰,但同时附着在组织碎屑上的细菌也会被除去,因此过滤到膜上的细菌是少于中华绒螯蟹肠道的总菌量的。
池养中华绒螯蟹[12]肠道内优势菌群为拟杆菌门。而在本研究中,γ-变形菌纲成为中华绒螯蟹肠道内可培养细菌的绝对优势种群。比较同样采用分离培养法分析肠道微生物的研究结果,希瓦氏菌属(Shewanella)、肠杆菌科、气单胞菌属、柠檬酸杆菌属等同样曾在虾类、鱼类肠道中发现过[13,17-18],特别是,假单胞菌属和气单胞菌属为甲壳纲动物肠道内常见菌属。宛立等[17]从健康养殖的南美白对虾肠道内分离出111株细菌,这些分离菌株分别属于13个属(科),其中就有假单胞菌属、气单胞菌属,且气单胞菌属为优势菌属。王祥红等[19]从野生健康中国对虾成虾肠道中分离出47株菌,其中包含假单胞菌属、气单胞菌属,且假单胞菌属为次优势菌属。Moriarty等[20]的研究也表明甲壳类动物消化道中最常见的菌属之一就是假单胞菌属。
分离培养克隆测序法与直接克隆测序法所获得的肠道菌群多样性存在显著差异,分析原因有以下几个方面:①方法学本身的差异,这在以往虾类肠道菌群的研究中也有发现。Eilers等[21]认为,只有改进培养方法和技术,才能缩小培养和分子方法在分析细菌群落上的差异,并认为这种差异很可能是因为只有那些具有快速生长潜力并能快速适应含高浓度营养新环境的细菌才能在较短的时间在普通的培养基上形成菌落;②采样的季节差异,不同季节,河蟹处于不同的生长阶段,肠道内发育状况不同适合不同的菌群附着增殖,导致不同的优势菌群;③生长环境的差异、食物和营养的差异、养殖模式的不同使得蟹体肠道组织中菌群的结构表现出差异性。
由此可见,每种方法都有其优势和弊端,不同条件下的中华绒螯蟹其肠道微生物组成也可能存在明显差异。采用光学显微镜、电子显微镜、荧光原位杂交、DGGE等多种方法针对不同养殖环境、不同生长阶段和不同饲喂饵料下的中华绒螯蟹肠道菌群进行更全面更科学的研究。
[1]李晓晖,许志强,葛家春,等.长江水系中华绒螯蟹种质资源研究进展[J].水产养殖,2009,(10):42-46.
[2]http://baike.baidu.com/view/62514.htm.
[3]农业部渔业局.中国渔业年鉴:2008[M].北京:中国农业出版社,2008.
[4]杨先乐,黄志华,陈力.中华绒螯蟹病害的流行态势及其对产业持续发展的思考[J].淡水渔业,2010,40(1):74-79.
[5]Wagley S,Koofhethile K,Rangdale R.Prevalence and potential pathogenicity of Vibrio parahaemolyticus in Chinese mitten crabs(Eriocheir sinensis)harvested from the River Thames estuary,England[J].Journal of food protection,2009,72(1):60-66.
[6]尹永志,郭春华,黄艳玲,等.DGGE技术在动物胃肠道微生物研究中的应用[J].生物技术通报,2010,(6):90-94.
[7]郝向举,李义.蟹源地衣芽孢杆菌ESB3对中华绒螯蟹生长及部分免疫指标的影响研究[J].饲料工业,2011,32(2):23-27.
[8]Eckburg PB,Bik EM,Bernstein CN,et al.Diversity of the human intestinal microbial flora[J].Science,2005,308(5728):1635-1638.
[9]Mai V,Draganov PV.Recent advances and remaining gaps in our knowledge of associations between gut microbiota and human health[J].World J Gastroenterol,2009,15(1):81-85.
[10]张华,蔡辉益,刘国华,等.T-RFLP分析技术在肉鸡肠道微生物研究中的应用[J].动物营养学报,2011,23(3):364-369.
[11]Kim DH,Brunt J,Austin B.Microbial diversity of intestinal contents and mucus in rainbow trout(Oncorhynchus mykiss)[J].J Appl Microbiol,2007,102(6):1654-1664.
[12]Li K,Guan W,Wei G,et al.Phylogenetic analysis of intestinal bacteria in the Chinese mitten crab(Eriocheir sinensis)[J].J Appl Microbiol,2007,103(3):675-682.
[13]Liu H,Wang L,Liu M,et al.The intestinal microbial diversity in Chinese shrimp(Fenneropenaeus chinensis)as determined by PCR-DGGE and clone library analyses[J].Aquaculture,2011,317:32-36.
[14]Patel A,Noble RT,Steele JA,et al.Virus and prokaryote enumeration from planktonic aquatic environments by epifluorescence microscopy with SYBR Green I[J].Nat Protoc,2007,2(2):69-276.
[15]Hong SW,Kim IS,Lee JS,et al.Culture-based and Denaturing Gradient Gel Electrophoresis Analysis of the Bacterial Community Structure from the Intestinal Tracts of Earthworms(Eisenia fetida)[J].J Microbiol Biotechnol,2011,21(9):885-892.
[16]Li W,Jiqiao W,Feng G,et al.Bacterial Flora in Intestines of White leg Shrimp(Penaeus vannamei Booen)[J].Fisheries Sci,2006,25(1):13-15.
[17]宛立,王吉桥,高峰.南美白对虾肠道细菌菌群分析[J].水产科学,2006,25(1):13-15.
[18]Durand L,Zbinden M,Cueff-Gauchard V,et al.Microbial diversity associated with the hydrothermal shrimp Rimicaris exoculata gut and occurrence of a resident microbial community[J].FEMS Microbiol Ecol,2010,71(2):291-303.
[19]Xianghong W,Huirong L,Xiaohua Z,et al.Microbial Flora in the Digestive Tract of Adult Penaeid Shrimp(Penaeus chinensis)[J].Journal of Ocean University of Qingdao,2000,30(3):493-498.
[20]DJW M.Interactions of microorganisms and aquatic animals,particularly the nutritional role of the gut flora[J].Microbiol in Poecilotherms,1990:217-223.
[21]Eilers H,Pernthaler J,Glockner FO,et al.Culturability and In situ abundance of pelagic bacteria from the North Sea[J].Appl Environ Microbiol,2000,66(7):3044-3051.