改良K-B法用于副溶血性弧菌耐药性检测
张昭寰,郭丹凤,王敬敬,林 婷,潘迎捷,赵 勇
(上海海洋大学食品学院农业部水产品贮藏保鲜质量安全风险评估实验室(上海)上海水产品加工及贮藏工程技术研究中心,上海 201306)
抗菌类药物在全球范围内广泛使用,有效地降低了传染性疾病的发病率和致死率[1]。但是在抗菌类药物治疗病原菌感染的同时,由于细菌的选择性压力,必然导致细菌耐药性的产生[2-3],耐药性细菌以及多重耐药性细菌的不断增加,给人类疾病的治疗带来了极大的困难。现阶段,细菌耐药问题已经引起世界范围的关注,被WHO认定为21世纪最大的安全卫生问题之一[4-6],各国及国际组织都积极地采取相应的管理措施,来抑制和降低细菌耐药性的增加和蔓延[7-10]。因此,如何对细菌耐药性进行快速精准的测定,成为当今微生物科研的难点及热点问题。常用的细菌耐药性检测方法主要有Kirby-Bauer法、稀释法、E-test法以及全自动微生物分析仪测试方法。其中由Bauer和Kirby所建立的纸片琼脂扩散法,即KB纸片扩散法,广泛应用于各国微生物学实验室,进行细菌耐药性的测定[11-12]。根据美国临床实验室标准化协会(CLSI)规定[12],K-B纸片扩散法对细菌耐药性进行测定的传统方法为:将菌液划线进行培养,挑取单菌落于生理盐水中,稀释到浓度为0.5 McFarland浊度(相当于所接种的菌量为1.5×108cfu/mL)。CLSI推荐使用无菌棉拭子蘸取菌液,在管壁上挤压去掉多余菌液后在整个Mueller Hinton培养基表面进行涂布,待培养基表面的菌液完全晾干后,贴上抗生素纸片,置于合适温度下过夜培养,然后测量抑菌圈的直径。根据CLSI标准判定为耐药(resistant)、中介(intermediate)以及敏感(sensitive)。副溶血性弧菌(Vibrio parahaemolyticus)是一种常见的食源性致病菌,感染该菌易引起急性胃肠炎和原发性败血症等疾病[13-14]。根据我国食源性疾病监测网的数据,以及其他各方面资料显示,在微生物引起的食源性疾病爆发事件中,副溶血性弧菌污染为首要因素[14-15]。本文针对K-B纸片扩散法以及重要的食源性致病菌副溶血性弧菌,运用6种常见的抗菌类药物,对K-B纸片扩散法进行系统的改良和优化,并利用8株野生副溶血性弧菌(本实验室分离于水产食品)对改良后的K-B法准确性进行验证,旨在提出一种更高效、更便捷、更经济的副溶血性弧菌耐药性测定方法。
1 材料与方法
1.1 材料
1.1.1 菌株 副溶血性弧菌标准菌株Vibrio parahaemolyticusATCC33847;药敏性测定标准置控菌株Escherichia coliATCC25922;实验室从上海市水产品中分离的8株野生副溶血性弧菌:VPWTD08、VPWTD12、VPWTD14、VPWTD15、VPWTD16、VPWTD17、VPWTD23、VPWTD25。
1.1.2 培养基 Luria-Bertani营养肉汤(LB,北京陆桥技术有限责任公司)、Luria-Bertani营养琼脂(LB,北京陆桥技术有限责任公司)、胰蛋白胨大豆肉汤培养基(TSB,北京陆桥技术有限责任公司)、硫代硫酸盐-柠檬酸盐-胆盐蔗糖琼脂(TCBS琼脂,上海市疾病预防控制中心)、Mueller Hinton肉汤(MH,上海汉尼生物技术有限公司)、纯化琼脂(Agar D,上海汉尼生物技术有限公司)。
1.1.3 抗生素 阿莫西林-克拉维酸(Amoxicillin-clavulanic acid)、头孢噻肟(Cefotaxime)、阿米卡星(Amikacin)、四环素(Tetracycline)、环丙沙星(Ciprofloxacin)、氯霉素(Chloramphenicol),均购自上海汉尼生物技术有限公司。
1.1.4 主要仪器 Bio-Tek酶标仪(美国伯腾仪器有限公司)、Eppendorf离心机(5810R,美国Eppendorf公司)、Milli-Q制水系统(美国Millipore公司)。
1.2 方法
1.2.1 菌液的制备 将副溶血性弧菌划线接种于TCBS平板,挑取单菌落于5 mL TSB的试管中,37℃、180 r/min摇床培养12 h,连续活化2次,作为种子液,备用。
1.2.2 利用标准菌株构建OD-菌数对应公式取培养12 h的副溶血性弧菌(ATCC33847)种子液,用酶标仪测定其在600 nm下的吸光值,对菌液进行倍比稀释,测每个梯度下菌液的吸光值,同时将不同吸光值的菌液涂布于TCBS平板,37℃培养12 h后进行菌落计数。以副溶血性弧菌的对数值为纵坐标,菌悬液的吸光值OD600为横坐标做图,得到OD-菌数对应公式:

根据公式以及CLSI标准所规定的1.5×108cfu/mL接种量确定OD值为0.352,将8株野生副溶血性弧菌的浊度稀释至0.352左右,涂布于TCBS平板,37℃培养12 h后进行菌落计数,观察结果是否符合规定菌量。
1.2.3 培养皿的选择 选定菌液浓度控制方法后,针对标准菌株(ATCC33847)选择实验室通常使用的玻璃培养皿以及一次性塑料培养皿(9 cm×9 cm),进行纸片扩散法药敏试验。用无菌棉拭子蘸取菌液,在管壁上挤压去除多余菌液,在玻璃培养皿以及一次性塑料培养皿的MH琼脂表面涂抹均匀,待琼脂上的菌液晾干后,贴上6种抗生素纸片,每组4个平行试验,置于37℃培养16~18 h,观察并记录试验结果。
1.2.4 药敏试验涂布方法的优化 通过预实验,对比涂抹菌液 100、200、300 μL的培养皿,确定了300 μL的定量接种方法,这与余修中[16]在其研究中提出定量接种0.35 mL菌液量基本一致。对传统药敏试验涂布方法进行改良,分为组1、组2、组3,组1,传统药敏试验方法:棉拭子蘸取菌液进行涂布;组2,向MH琼脂中加入300 μL菌液,用涂布棒进行涂布;组3,向MH琼脂中加入300 μL菌液,用棉拭子进行涂布。待菌液晾干,贴上6种抗生素纸片,每组4个平行试验,置于37℃培养16~18 h,观察并记录试验结果。
1.2.5 传统试验与改良试验的对比 用传统药敏试验法及改良后的药敏试验法对实验室分离的8株野生副溶血性弧菌进行耐药性检测,对比试验结果,并绘制总流程图,评价2种方法的优劣。
1.2.6 统计方法 用SPSS statistics 17.0进行数据的分析和处理。
2 结果与分析
2.1 菌液浓度确定方法的改良
OD600为0.352左右时,8株野生菌株的菌落计数结果如表1所示,结果表明调OD方法所得接种量与CLSI标准规定的菌液浓度(1.5×108cfu/mL)相差不大,且相较于传统药敏试验中麦氏比浊法(0.5 McFarland),节省了16~18 h的单菌落培养时间。
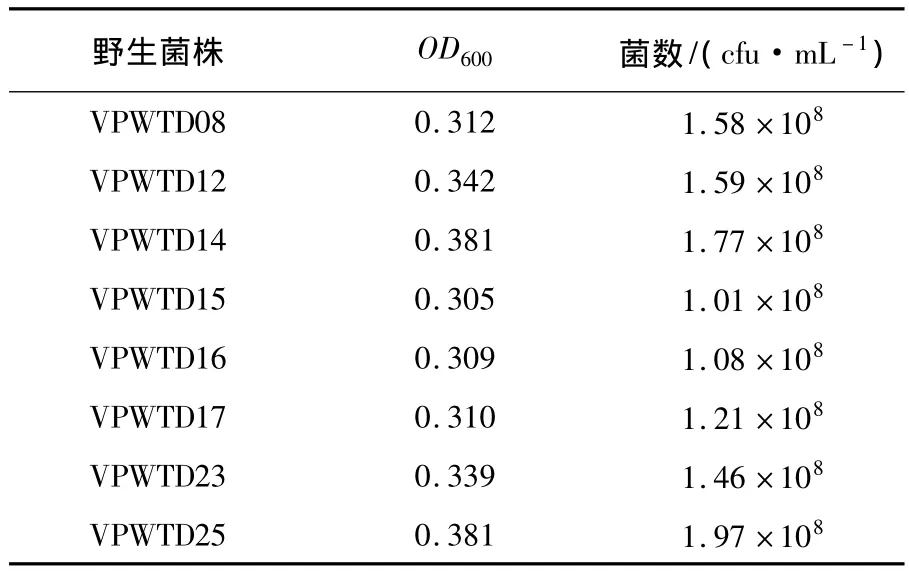
表1 8株野生菌株OD600对应的实际菌量Table1 Bacteria concentrations correspond to the OD600of eight wild types
2.2 培养皿的选择
经过SPSS分析,由表2可知,分别对比玻璃平板和塑料平板,阿莫西林-克拉维酸(AMC)和阿米卡星(AK)2组试验结果不存在显著性差异(P>0.05),而其余4种抗生素均存在显著性差异(P<0.05),图1为玻璃平皿和一次性平皿测量抑菌圈的对比图。

图1 玻璃平皿(a)和一次性平皿(b)抑菌圈对比Fig.1 Comparison of inhibition zones of vitreous plate(a)and plastic plate(b)

表2 玻璃平皿与一次性平皿对于6种抗生素抑菌圈结果的对比(n=4)Table2 Comparison of inhibition zones of vitreous plate and plastic plate(n=4)
由上述分析可知,标准一次性平皿(9 cm×9 cm)与玻璃平皿测量抑菌圈的结果存在差异,这可能与玻璃平皿的大小、厚薄不一致有关,所以在药敏试验中使用标准一次性平皿比玻璃平皿有更好的准确性。
2.3 药敏试验涂布方法的优化
比较3种涂布方法对于每种抗生素的变异系数(表3),以及3种方法变异系数均值,可得组3的变异系数最小,说明组3重复性更好。而组2变异系数最高,可能是由于涂布棒的棒头较大,造成涂布菌液浪费,导致重复性不好。
对比组1和组3,棉拭子直接涂布和定量300 μL涂布,效果相差并不大,但由于棉拭子大小不一、蓬松程度差异较大,造成蘸取的菌量不同,不能保证每次的重复性均较好,所以在药敏试验中,对菌液进行定量控制,以保证药敏试验较好的重复性。图2为3种涂布方法测量抑菌圈的对比图。

图2 3种涂布方法测量抑菌圈对比Fig.2 Comparison of inhibition zones of three spreading methods
2.4 传统试验与改良试验的对比
用传统试验与改良后试验对实验室分离的8株野生副溶血性弧菌进行耐药性检测,试验结果如表4所示,改良前后的测定结果基本一致,只有7组结果存在差异,其余41组结果相同,证明改良后的药敏试验具有较好的准确性。传统药敏试验的流程图与改良的药敏试验的流程如图3所示。
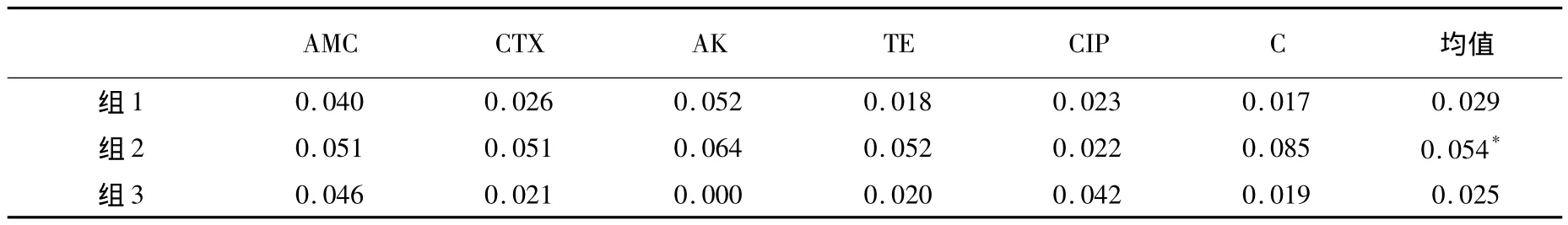
表3 3种涂布方法对于6种抗生素抑菌圈结果的变异系数(CV)的对比(n=4)Table3 Coefficient of variation(CV)of inhibition zones of three spreading methods(n=4)

表4 传统药敏试验与改良药敏试验对8株副溶血性弧菌耐药性判别结果的对比Table4 Comparison of traditional antimicrobial sensitivity test and improved antimicrobial sensitivity test
对比传统药敏试验方法,改良后的药敏试验方法具有以下优点:第一,在时间上节约了16~18 h培养获得单菌落的时间;第二,选用标准大小的平板可进一步提升实验结果的准确度;第三,定量300 μL棉拭子涂布方法,既具有较高的重复性,又能节省涂布棒因反复灼烧而需要的时间;第四,在经济成本上,改良的药敏试验因省去了划线培养环节,从而节约了培养基使用量。
3 讨论
抗生素的大量使用导致细菌耐药问题,已成为世界性难题,特别是由于多重耐药菌株感染而导致死亡的报道逐年增加[4-9]。细菌耐药性的形成有多种原因,包括细菌自身的原因[17],滥用抗生素的原因以及现代医学飞速发展的不良恶果,其中最主要原因在于抗生素药物的过度使用[1-2]。多重耐药性细菌的出现,极大地危害了人类的健康,甚至引起社会的恐慌。所以,有效的细菌耐药性检测方法的提出,对人类健康和安全都有重要的意义。

图3 传统药敏试验和改良药敏试验的流程图Fig.3 Flow chart:The traditional antimicrobial sensitivity test and improved antimicrobial sensitivity test
对于K-B纸片扩散法,国内外学者已经进行了多方面的研究。池云生[18]指出菌液浓度、培养基、纸片质量等因素会影响细菌药敏试验的结果;王云霞[19]的研究也有类似的观点。张彩芳[20]文章中对不同的琼脂厚度、种类、浓度以及接种量等试验条件进行了探究,提出为了减少各种因素的影响,应实行方法的标准化。McGill等[21]对比了K-B纸片扩散法和E-test方法测量结果的区别,Karaca等[22]对K-B纸片扩散法与微量肉汤稀释法测量细菌耐药性的结果进行比较。Lestari等[23]对人工和仪器测定抑菌圈的结果进行比较。尽管目前已有许多研究针对于K-B纸片法,但有对于其系统性的改良以应用于食源性致病菌的研究报道仍然较少。
本研究针对细菌耐药性试验的K-B纸片扩散法进行了改良和优化,建立了一种基于传统方法的改良药敏试验方法。传统药敏试验中麦氏比浊法对应的是大肠埃希菌的浓度[12],对于其他细菌浓度的判定可能会造成误差,本研究用OD-菌数的对应公式代替了传统的麦氏比浊法,使获得的副溶血性弧菌数更为准确有效,且节省了16~18 h的单菌落培养时间。在培养皿的选择上,本研究对玻璃平皿和一次性平皿的试验结果进行了显著性分析,结果表明两者之间存在显著差异(P<0.05)。对于CLSI建议的棉拭子涂布方法提出了质疑,由于不同厂家、不同工艺生产出的棉拭子大小、蓬松程度不同,并不能保证菌液用量的恒定,因此设计了3种涂布方法的对比,从而确定了定量300 μL的棉拭子涂布方法,此方法既存在较高的重复性又能节省涂布棒因反复灼烧而需要的时间。最后,对8株野生菌株的耐药性进行检测,结果表明改良后的方法与传统方法在测定结果上基本保持一致。
对比传统的药敏试验,改良后的药敏试验具有省时、省力、重复性好等特点,但本研究的不足之处在于只针对K-B纸片法的改良,希望后续研究将其应用于药敏试验的稀释法和E-test法之中,从而对细菌药敏试验进行更加完善的优化。
[1]孙延忠,曾洪梅,李国庆.抗生素对微生物作用的研究[J].微生物学杂志,2003,23(3):44-47.
[2]Teuber M,Meile L,Schwarz F.Acquired antibiotic resistance in lactic acid bacteria from food[J].Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,1999,76(1~4):115-137.
[3]Levy S.B.Active efflux mechanisms for antimicrobial resistance[J].Antimicrob Agents Chemother,1992,36(4):695-703.
[4]周宁,张建新,樊明涛,等.细菌药物敏感性实验方法研究进展[J].食品工业科技,2012,33(9):459-464.
[5]Neu H.C.The crisis in antibiotic resistance[J].Science,1992,257(5073):1064-1073.
[6]Levy S.B.Antibacterial household products:cause for concern[J].Emerging Infectious Diseases,2001,7(S3):512-515.
[7]FAO/OIE/WHO.2003.First Joint FAO/OIE/WHO Expert Workshop on Non-human Antimicrobial Usage and Antimicrobial Resistance:Scientific assessment,Geneva,Switzerland,1-5 December 2003.http://www.who.int/foodsafety/micro/meetings/nov2003/en/.
[8]FAO/OIE/WHO.2004.Second Joint FAO/OIE/WHO Expert Workshop on Non-Human Antimicrobial Usage and Antimicrobial Resistance:Management options,Oslo,Norway,15-18 March 2004.http://www.who.int/foodsafety/publications/micro/mar04/en/index.html.
[9]FAO/OIE/WHO.2006.Joint FAO/OIE/WHO Expert Meeting on Antimicrobial Use in Aquaculture and Antimicrobial Resistance,Seoul,Republic of Korea,13-16 June 2006 ftp://ftp.fao.org/ag/agn/food/aquaculture_rep_13_16june2006.pdf.
[10]FAO/OIE/WHO.2008.Joint FAO/WHO/OIE Expert Meeting on Critically Important Antimicrobials Report of the FAO/WHO/OIE Expert meeting,FAO,Rome,Italy,26-30 November 2007. ftp://ftp. fao. org/docrep/fao/010/i0204e/i0204e00.pdf.
[11]Andrews JM.For the BSAC working party on susceptibility testing,BSAC standardized disc susceptibility testing method[J].J Antimicrob Chemother,2001,48(Suppl 1):43-57.
[12]Clinical and Laboratory Standards Institute.M100-S20 Performance standards for antimicrobial susceptibility testing:nineteenth informational supplement[S].Wayne,PA:CISI,2010.
[13]黄韵仪,胡连花,孙力军,等.副溶血性弧菌免疫磁珠偶联条件优化及捕获性能评价[J].微生物学杂志,2012,32(6):7-11.
[14]Su Y.-C.,Liu C.Vibrio parahaemolyticus:A concern of seafood safety[J].Food Microbiology,24(2007):549-558.
[15]赵勇,王敬敬,唐晓阳,等.水产品中食源性致病微生物风险评估研究现状[J].上海海洋大学学报,2012,21(5):899-905.
[16]余修中.K-B法药敏试验中菌液量的规范[J].四川省卫生管理干部学院学报,2002,9(21):177-178.
[17]Greenwood D.Resistance to antimicrobial agents:a personal view[J].J Med Microbiol,1998,47(2):751-755.
[18]池云生,李丽.对影响细菌药敏试验因素的体会[J].全科医生技能发展,2004,7(21):1612.
[19]王亚霞,苏振杰.K-B纸片琼脂扩散法检测细菌药物敏感试验的影响因素分析[J].中国医药指南,2009,7(5):41-42.
[20]张彩芳,张爱君.纸片扩散法药敏试验条件的选择[J].宁夏医学杂志,2006,28(12):946-947.
[21]McGill K.,Kelly L.,Madden R.H.,et al.Comparison of disc diffusion and epsilometer(E-test)testing techniques to determine antimicrobial susceptibiliy of Campylobacter isolates of food and human clinical origin[J].Journal of Microbiological Methods,2009,79(2):238-241
[22]Karaca N.,KoçA.N..In vitro susceptibility testing of dermatophytes:comparison of disk diffusion and reference broth dilution methods[J].Diagnostic Microbiology and Infectious Disease,2004,48(4):259-264.
[23]Lestari E.S.,Severin J.A.,Filius P.M.,et al.Comparison of the accuracy of disk diffusion zone diameters obtained by manual zone measurements to that by automated zone measurements to determine antimicrobial susceptibility[J].Journal of Microbiological Methods,2009,75(1):177-181