一株沙雷氏菌的分离及其群体感应现象
张彩丽 朱素琴 汪映 孙秀娇 曾名湧
(中国海洋大学食品科学与工程学院,青岛 266003)
群体感应(Quorum sensing,QS)[1]是细菌之间相互交流的一种方式,细菌通过产生一种自诱导物(Autoinduced,AI)而相互感知,自诱导物随着细菌密度增加而增加,当达到一定阈值时,会诱导细菌某些特定基因的表达。自1970年首次发现费氏弧菌(V. fischei)的发光[2]与细菌密度有关以来,许多研究证明群体感应可调控细菌的生理特性,如铜绿假单胞菌(P.aeruginosa)生物膜的形成[3],副溶血弧菌(V. parahaemolyticus)胞外酶的分泌[4]及霍乱弧菌(V. cholerae)毒力因子[5]的表达等。革兰氏阴性菌主要存在LuxI/LuxR系统并以N-酰基高丝氨酸内酯类(N-acyl-homoserine lactones,AHLs)[6]物质作为信号分子,其中LuxI蛋白负责信号分子的合成,LuxR蛋白作为信号分子受体,通过形成受体-自诱导物复合体,启动目的基因的转录表达。革兰氏阳性菌[7]通过双组分的群体感应系统分泌寡肽类(Autoinducing peptides,AIPs)信号分子。Bassler[8]在哈维氏弧菌(V. harveyi)中发现了一种依赖于LuxS蛋白的细菌间交流的信号分子(Autoinducer-2,AI-2),并证明AI-2是一种呋喃酮硼酸二酯(Furanosyl borate diester)。
沙雷氏菌(Serratia marcescens)是肠杆菌科的一种条件致病菌[9],存在于土壤、水、植物、动物以及人类的肠道和呼吸道中,在机体免疫力降低或环境污染时,可引起原发性和不同程度的继发性感染。该菌属能够产生核酸酶、蛋白酶、脂肪酶等次级代谢产物对人类存在潜在危害。目前已有研究证明沙雷氏菌的生物膜形成、群集运动等性状受群体感应调控[10]。因此,研究水产品中沙雷氏菌的群体感应,将为沙雷氏菌的防治和水产品的保鲜提供理论指导。
本试验从腐败凡纳滨对虾中分离出一株具有群体感应现象的沙雷氏菌S.marcescensAK1,并对其群体感应信号分子进行检测,旨为沙雷氏菌群体感应调控的致病性研究提供一定科学依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株 菌株S. marcescensAK1分离于腐败的凡纳滨对虾中,保存于本实验室。群体感应报告菌株紫色杆菌(Chromobacterium violaceum)CV026和根癌农杆菌(Agrobacterium tumefaciens)A136(pCF218)(pCF372)均由美国德克萨斯州立大学McLean RJC教授惠赠。CV026可检测碳链长度从C4到C8[11]的信号分子,而A136可检测较宽范围的信号分子[12],从C4到C14,3-oxo-C4到3-oxo-C12均可检测。CV026和A136本身均不产生AHLs,当存在外源AHLs时,紫色杆菌CV026将产生紫色杆菌素;根癌农杆菌A136表达lacZ基因,分解X-gal产生蓝色。
1.1.2 培养基和培养条件 菌株S. marcescensAK1、CV026、A136在30℃下培养于LB肉汤或LB琼脂培养基中[13]。CV026需添加50 μg/mL的卡那霉素,A136添加4.5 μg/mL四环素和50 μg/mL壮观霉素。
1.1.3 主要试剂和仪器 X-gal(5-溴-4-氯-3-吲哚-β-D-吡喃半乳糖苷)、壮观霉素、四环素、卡那霉素、N-酰基高丝氨酸内酯(C6-HSL、C8-HSL、3-oxo-C6-HSL)购自Sigma公司;RP-C18 F254反相薄层层析板购自德国Merck公司。
1.2 方法
1.2.1 分离纯化菌株 从腐败的虾中利用平板稀释法进行细菌的分离、纯化。根据细菌菌落特征、革兰氏染色、镜检、生理生化试验对菌株AK1进行鉴定。
1.2.2 提取菌株16S rRNA 菌株AK1液体条件下培养至生长对数期(OD≈1.0),取2 mL新鲜菌液10 000 r/min离心2 min后弃去上清,利用EZ-10柱式细菌基因组DNA抽提试剂盒(上海生工生物工程股份有限公司)提取基因组DNA,所得DNA于-20℃保存。以提取DNA为模板扩增16S rRNA,PCR体系为50 μL:模板3 μL,dNTPs(2.5 mmol/L)5 μL,引物(1 mmol/L)各1 μL,10×Taq缓冲5 μL,MgCl23 μL,Taq酶1 μL,灭菌超纯水31 μL。PCR引物序列为27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-ACGGCTACCTTGTTACGACTT-3'。PCR反应条件:95℃ 5 min,95℃ 30 s,56℃ 30 s,72℃1 min,共30个循环后,72℃10 min。将PCR产物利用0.6%琼脂糖凝胶电泳。PCR产物送往上海生工生物工程股份有限公司测序。
1.2.3 检测菌株群体感应现象
1.2.3.1 报告菌株平板划线法 根据文献[14] 的方法,将被检测菌株与报告菌株CV026在LB平板上平行划线;用报告菌株A136时,需先在LB平板上涂布20 μL X-gal(20 mg/mL),无菌风吹干后,28℃培养18-24 h观察。分别以报告菌株自身作为阴性对照,以C6-HSL作为阳性对照。
1.2.3.2 制备粗提液 菌株AK1在LB肉汤中过夜培养至一定密度(OD≈1.0),10 000 r/min离心5 min,取上清,用等量乙酸乙酯提取3次,混合有机相,30℃水浴旋蒸至干,溶解于1 mL甲醇,-20℃保存备用。
1.2.3.3 TLC-Biosensor检测 分别将信号分子标准品与乙酸乙酯提取物2-5 μL点样于C18反相薄层层析板,利用甲醇/水(6040,V/V)充分展开,取出后在常温下挥干溶剂,按制备报告平板方法制备含A136菌、抗生素、X-gal的琼脂,倾到于薄层层析板上,凝固后,28℃培养18-24 h观察。以不含A136菌的琼脂覆盖作对照。
1.2.4 测定不同时间信号分子含量 过夜活化的菌株AK1接种于液体LB培养基,每隔4 h取50 mL菌液,按照1.3.2方法提取信号分子。参照文献[15] 略作修改,β-半乳糖苷酶法检测信号分子活性,96孔板中依次加入100 μL生理盐水、100 μL过夜培养A136(OD≈1.0),2.5 μL X-gal,2.5 μL提取物,以LB液体培养基提取物做对照,28℃摇床(150 r/min)培养8-12 h,测定A635。按照1.2.3.1方法制备含A136菌、抗生素、X-gal的报告平板,点样2 μL提取物于灭菌圆纸片,无菌风吹干,放置报告平板上,28℃培养18-24 h观察。
2 结果
2.1 菌株生化试验
将分离纯化的细菌进行生理生化试验,结果显示,AK1革兰氏染色阴性、氧化酶试验阴性和葡萄糖酸盐试验阳性、苯丙氨酸脱氨酶试验阴性;不能产H2S;能利用葡萄糖、乳糖、果糖、海藻糖、山梨醇发酵产酸;不能利用阿拉伯糖;赖氨酸脱羧酶阳性、DNA酶试验阳性,β-半乳糖苷酶阳性。根据伯杰士手册和肠杆菌科检索系统[16]鉴定其为黏质沙雷氏菌。
2.2 16S rRNA
将菌株AK1的16S rRNA(图1)序列提交NCBI数据库进行Blast比对,结果显示该菌株与沙雷氏菌序列相似度超过99%。利用ClustalX1.8 软件排序,MEGA4.1软件按照Neighbour-Joining聚类,构建系统发育树如图2所示。
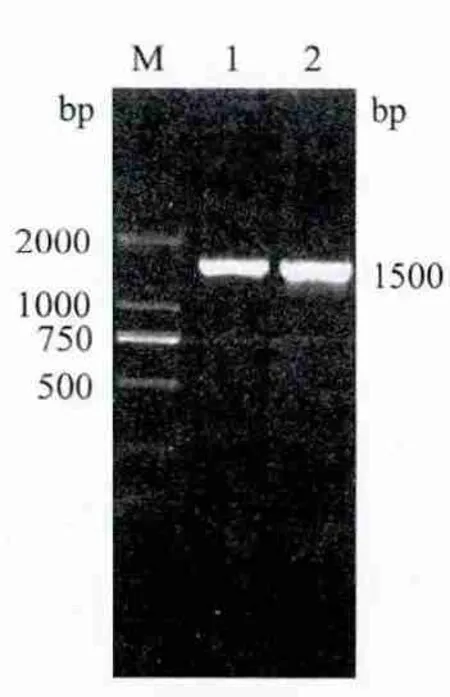
图1 菌株AK1的16S rRNA PCR扩增产物电泳图

图2 沙雷氏菌AK1与其他沙雷氏菌之间的系统发育关系
2.3 平板划线法检测群体感应
报告菌株CV026和A136与待测菌株AK1平行划线结果如图3所示,菌株AK1可以诱导紫色杆菌CV026产生紫色色素,诱导A136水解X-gal产生蓝色。阴性对照无颜色变化,阳性对照分别产生紫色和蓝色。因菌株AK1具有β-半乳糖苷酶活性,所以在A136平板上可看到菌株AK1也变为蓝色。
2.4 TLC-Biosensor
反相薄层层析法分析结果显示,对照不产生蓝色,表明粗提物不是能水解X-gal的β-半乳糖苷酶。含A136的TLC板显示烷酰基类型信号分子迁移良好,形成规整圆形,而氧代信号分子则具有拖尾现象。根据迁移值及形状与标准品比对,菌株AK1可以产生两种信号分子C6-HSL和3-oxo-C6-HSL。报告菌株A136对氧代信号分子较敏感,图4显示3-oxo-C6-HSL显色范围较大。该菌产生的信号分子类型可能还有其他种类,其含量可能因太低而无法利用TLCBiosensor方法检测到,信号分子的进一步确定需依赖于HPLC/MS或GC/MS。
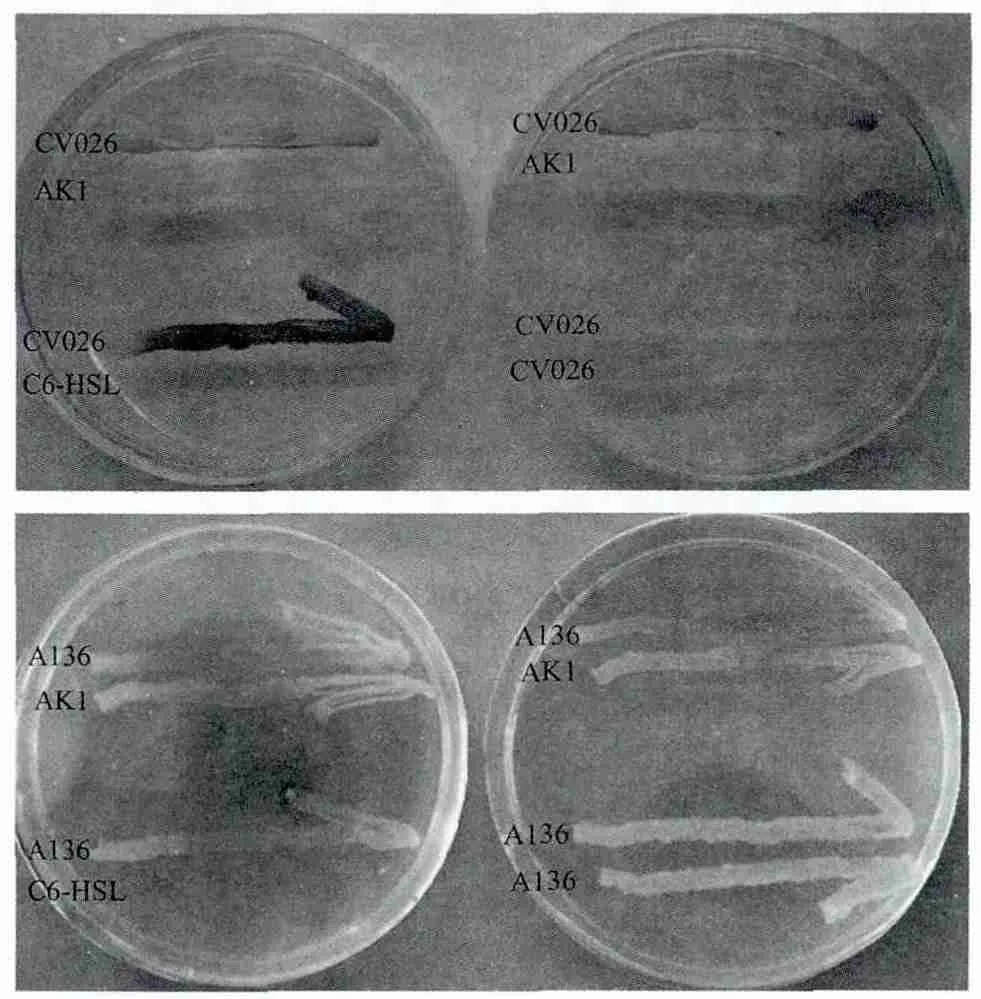
图3 利用报告菌株CV026和A136分别平行划线检测菌株AK1信号分子

图4 TLC检测AHLs
2.5 不同时间信号分子含量
菌株AK1不同时间的信号分子分泌规律(图5)显示,菌株AK1在对数前期便开始产生信号分子且具有密度依赖性,对数后期(约16 h)达到最大值(约为对数前期的3.2倍),随着细菌进入衰亡期,信号分子的含量也减少。报告平板法结果(图6)与此一致。测定培养基的pH值,到达稳定期后,由于次级代谢产物的积累,培养基pH值从开始的pH6.97(0 h)增加到pH7.40(16 h),并在稳定期达到pH8.10(24 h)。N-酰基高丝氨酸在碱性条件下不稳定,信号分子的减少可能由于培养基pH值的改变。
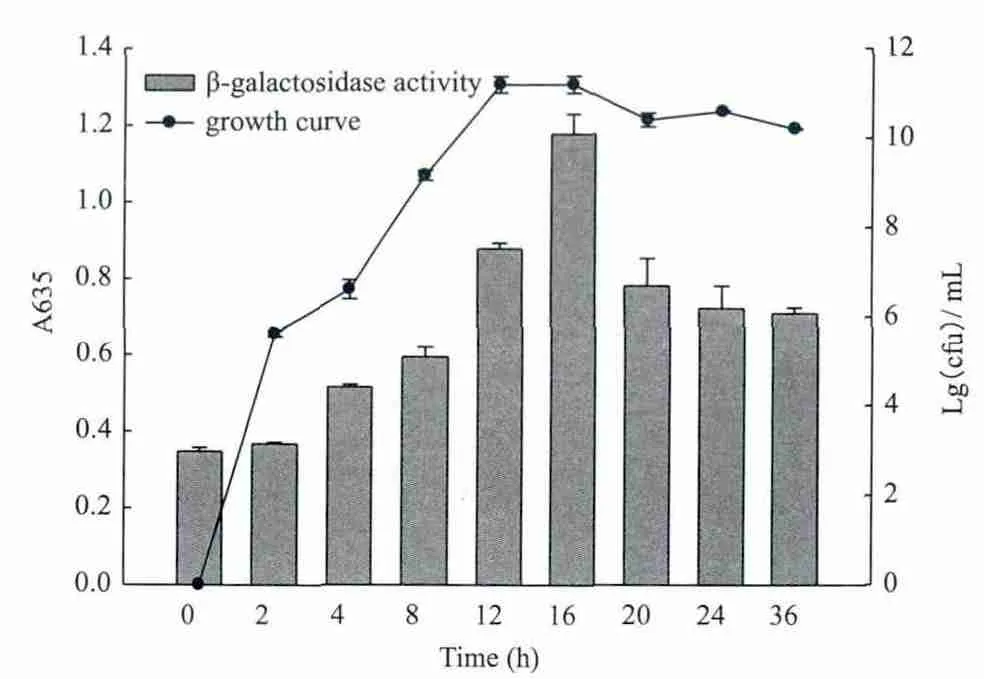
图5 β-半乳糖苷酶法检测菌株AK1上清中AHLs变化

图6 利用报告菌株A136检测菌株AK1上清中AHLs变化
3 讨论
革兰氏阴性菌利用N-酰基高丝氨酸内酯类化合物作为相互交流的信号分子[17]早有报道,国内外基于AHLs生物表达报告基因(如lacZ,gfp,luxCDABEG)已构建多种不同特异性的基因工程菌株。本研究利用群体感应报告菌株CV026和A136对腐败凡纳滨对虾中分离的粘质沙雷氏菌AK1的群体感应进行检测,均呈现阳性结果。利用TLCBiosensor法检测信号分子类型,结果显示菌株AK1能产生3-oxo-C6-HSL和C6-HSL信号分子,与Yu TzeHorng 报道的S. marcescensSS-1[18]产生的信号分子类型一致,S. marcescensSS-1可产生至少4种群体感应信号分子3-oxo-C6-HSL、C6-HSL、C7-HSL和C8-HSL。S. marcescensMG1,S. plymuthicaRVH1和S. proteamaculansB5a均可产生C6-HSL。可见,C6-HSL信号分子在沙雷氏菌属中较为普遍。菌株AK1可能还产生其他类型信号分子,需借助更灵敏方法进行鉴定。AK1产生的两种信号分子中,3-oxo-C6-HSL含量较为丰富,而C6-HSL相对较低。同时,利用β-半乳糖苷酶法和报告菌株法对菌株AK1产信号分子能力进行评价,结果显示AK1具有较强的信号分子产生能力,进入对数初期(约4 h)便可产生信号分子,对数末期(约16 h)达到最大值,约为对数初期的3.2倍。由于碱性次级代谢产物的产生或自身的利用,信号分子在稳定期减少但仍能维持较长时间。
沙雷氏菌易于存活,生物膜形成能力强,使其对环境和抗生素有较强的抵抗力,由于它具有鞭毛调节的群集运动分化行为,因而加大了其对自然界的侵袭能力。群体感应作为一种细菌相互交流的“语言”,当细菌释放的信号分子达到一个临界阈值时,会相互感知,协调它们之间的生理行为。群体感应调控沙雷氏菌的多种生理行为[19],包括S.plymuthicaRVH1 核酸酶、蛋白酶、几丁质酶的产生;Serratia spATCC 39006抗生素的产生;S. marcescensMG1生物膜的形成等。生物膜和群集运动增强了沙雷氏菌对环境和抗生素的抵抗力,对人类造成潜在危害,然而受群体感应调控的沙雷氏菌产生的某些抗生素和灵红素[20],具有抗菌、抗疟原微生物活性。因此,探究沙雷氏菌的群体感应现象,可以为沙雷氏菌的防治和利用提供依据。
本试验从腐败的凡纳滨对虾中分离的沙雷氏菌AK1与大部分沙雷氏菌一样能产生群体感应信号分子,但较于其他黏质沙雷氏菌,AK1显示出的易于生存和极强的群体感应信号分子分泌能力,可能因为其分离环境不同,从水生环境分离后,通过迅速产生群体感应信号分子应对外界条件的改变。这些信号分子对水产品食源性疾病的爆发存在怎样的威胁,沙雷氏菌与食品体系中的腐败菌间存在怎样的关系都有待进一步研究。通过对水产品中沙雷氏菌群体感应的研究,可以为条件致病菌沙雷氏菌的防治和水产品的保鲜提供一定的理论依据,为食品保鲜剂和杀菌剂的研究指出新方向。
4 结论
腐败凡纳滨对虾中分离的黏质沙雷氏菌AK1具有极强的环境适应能力,能产生两种类型信号分子,C6-HSL和3-oxo-C6-HSL,且氧代类型较为丰富。信号分子在对数初期即可产生,对数末期达到最大值,并能在稳定期维持较长时间。
[1] Fuqua WC, Winans SC, Greenberg EP. Quorum sensing in bacteria:the LuxR-LuxI family of cell density-responsive transcriptional regulators[J] . Journal of Bacteriology, 1994, 176(2):269-275.
[2] Nealson KH, Platt T, Hastings JW. Cellular control of the synthesis and activity of the bacterial luminescent system[J] . Journal of Bacteriology, 1970, 104(1):313-322.
[3] Davies DG, Parsek MR, Pearson JP, et al. The involvement of cell-tocell signals in the development of a bacterial biofilm[J] .Science,1998, 280(5361):295-298.
[4] Lee CY, Su SC, Liaw RB. Molecular analysis of an extracellular protease gene fromVibrio parahaemolyticus[J] . Microbiology,1995, 141(10):2569-2576.
[5] Miller MB, Skorupski K, Lenz DH, et al. Parallel quorum sensing systems converges to regulate virulence inVibrio cholera[J] . Cell,2002, 110(3):303-314.
[6] Pongsilp N, Triplett EW, Sadowsky MJ. Detection of homoserine lactone-like quorum sensing molecules inBradyrhizobiumstrains[J] . Current Microbiology, 2005, 51(4):250-254.
[7] Miller MB, Bassler BL. Quorum sensing in bacteria[J] . Annual Reviews in Microbiology, 2001, 55(1):165-199.
[8] Schauder S, Shokat K, Surette MG, et al. The LuxS family of bacterial autoinducers:biosynthesis of a novel quorum-sensing signal molecule[J] . Molecular Microbiology, 2001, 41(2):463-476.
[9] Grimont PAD, Grimont F, Richard C, et al. Deoxyribonucleic acid relatedness betweenSerratia plymuthicaand otherSerratiaspecies,with a description ofSerratia odoriferasp. nov.(type strain:ICPB 3995)[J] . International Journal of Systematic Bacteriology, 1978,28(4):453-463.
[10] Rutherford ST, Bassler BL. Bacterial quorum sensing:its role in virulence and possibilities for its control[J] . Cold Spring Harbor Perspectives in Medicine, 2012, 2(11):1-25
[11] Mclean KH, Winston MK, Fish L, et al. Quorum sensing andChromobacterium violaceum:exploitation of violacein production and inhibition for the detection of N-acyl-homoserine lactones[J] . Microbiology, 1997, 143(12):3703-3711.
[12] Zhu J, Beaber JW, Moré MI, et al. Analogs of the autoinducer 3-oxooctanoyl-homoserine lactone strongly inhibits activity of the TraR protein ofAgrobacterium tumefaciens[J] . Journal of Bacteriology, 1998, 180(20):5398-5405.
[13] Rice SA, Koh KS, Queck SY, et al. Biofilm formation and sloughing inSerratia marcescensare controlled by quorum sensing and nutrient cues[J] . Journal of Bacteriology, 2005, 187(10):3477-3485.
[14] Chu W, Vattem DA, Maitin V, et al. Bioassays of quorum sensing compounds using agro bacterium tumefaciensandChromobacterium violaceum[M] .Quorum Sensing. Humana Press, 2011:3-19.
[15] Tang K, Zhang Y, Yu M, et al. Evaluation of a new high-throughput method for identifying quorum quenching bacteria[J] . Scientific Reports, 2013, 3:1-9.
[16] 蔡妙英, 东秀珠. 肠杆菌科检索系统[J] . 微生物学通报,1989, 5(19):314-319.
[17] Bassler BL, Miller MB. Quorum Sensing[M] .The Prokaryotes.Springer Berlin Heidelberg, 2013:495-509.
[18] Horng YT, Deng SC, Daykin M, et al. The LuxR family protein SpnR functions as regulator of N-acyl-homoserine lactone dependent quorum sensing inSerratia marcescens[J] .Molecular Microbiology, 2002, 45(6):1655-1671.
[19] Van Houdt R, Givskov M, Michiels CW. Quorum sensing inSerratia[J] . FEMS Microbiology Reviews, 2007, 31(4):407-424.
[20] Holly S, Matthew C, Lee E, et al. Phosphate availability regulates biosynthesis of two antibiotics, prodigiosin and carbapenem, inSerratiavia both quorum-sensing-dependent and -independent pathways[J] . Molecular Microbiology, 2003, 47(2):303-320.

