EB病毒融合蛋白Zta-P54在大肠杆菌中的表达、纯化及鉴定
王云龙 张春艳 李玉林 程蕾 王继创 邓黎黎 米海 白晓静
(1.郑州大学生物工程系,郑州 450001;2.郑州职业技术学院,郑州450046;3.河南省生物工程技术研究中心,郑州 450001)
EB 病毒(Epstein-Barr virus,EBV)属于人类疱疹病毒 γ 亚科,具有较强传染性和潜伏感染的特点。该病毒在裂解期主要表达立早蛋白、早期蛋白和晚期蛋白3种蛋白[1]。有研究报道[2],鼻咽癌的发生发展和EB病毒感染密切相关,在鼻咽癌病人血清中可以检测到EB病毒相关抗体。由于不同感染状态下 EBV 表达的抗原各不相同,因此研究者常通过基因工程或人工合成多肽等方法获得EB病毒抗原,作为临床辅助诊断的依据[3]。
BZLF1编码的Zta立早蛋白可促使EB病毒从潜伏状态进入增殖状态,且Zta有较好的抗原性[4],可用于鼻咽癌的诊断及预测。另外,有研究报道[5],BMRF1编码的P54蛋白是EB病毒的早期蛋白,以EB病毒早期抗原(包括P54蛋白)作为抗原基质建立ELISA法,检测血清中相应抗体,对鼻咽癌诊断有好的特异性和敏感性。Dardari等[6]和Chan等[7]的报道及Chan等[8]在世界卫生组织肿瘤组织学分类一书中的观点,均认为血清学方法诊断鼻咽癌,采用几种抗原联合检测能显著提高特异性和敏感度。
为探讨可溶性多抗原联合检测在血清学诊断鼻咽癌中的价值,本研究尝试用pET32a作为表达载体,纯化Zta-P54融合蛋白作为诊断抗原,以期为后期该蛋白的临床应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒和宿主菌 pGEX5T-BZLF1-BMRF1质粒、表达菌BL21(DE3)由河南省生物工程技术研究中心提供,表达载体pET32a购自Novagen公司。
1.1.2 引物设计 根据pGEX5T-BZLF1-BMRF1测序结果,应用Primer 5.0软件设计引物,引物由上海生工生物工程技术服务有限公司合成。
1.1.3 主要试剂 异丙基硫代-β-D-半乳糖苷(IPTG)购自Sigma公司;蛋白Marker、Taq酶、dNTPs、DNA Marker、T4 DNA连接酶购自天根生化科技(北京)有限公司;鼻咽癌患者的血清取自郑州大学第一附属医院;限制性内切酶NdeⅠ、XhoⅠ购自New England Biolabs公司;DNA胶回收试剂盒购自宝生物公司,Ecl化学发光试剂盒购自PIERCE公司,PVDF转印膜购自PALL公司,其他试剂均为国产分析纯产品。
1.2 方法
1.2.1 目的基因扩增及原核表达载体的构建 根据所设计引物,建立30 μL PCR反应体系:(5 ×buffer,6 μL;MgCl2,1 μL;dNTP,0.3 μL;上游引物,0.2 μL;下游引物,0.2 μL;Taq酶,0.5 μL;模板,0.5 μL;ddH2O,21.3 μL),反应条件:95℃5 min;95℃ 1 min;60℃ 35 s;72℃ 1.5 min;40个循环,72℃ 5 min。将扩增产物与pET32a载体分别经NdeⅠ、XhoⅠ双酶切后,1.0 %琼脂糖凝胶电泳,切取目的基因条带,用DNA胶回收试剂盒分别回收目的片段和载体片段。由T4 DNA 连接酶16℃过夜连接双酶切产物,构建重组质粒;将重组质粒转入宿主细胞BL21(DE3)中,涂布于固体LB培养基中(含Amp),37℃过夜培养。挑取阳性克隆菌落培养至OD值0.6左右,提取质粒,将提取质粒经NdeⅠ、XhoⅠ双酶切鉴定,酶切正确的产物送至上海生工测序,将测序正确地质粒命名为pET32a/BZLF1-BMRF1。
1.2.2 重组蛋白诱导表达条件优化 挑取阳性菌落,接种于3.5 mL LB液体培养基(含Amp)中,37℃条件下过夜培养,次日取菌液100 μL转接到含有氨苄抗生素的3.5 mL LB培养基中。当培养至OD600约为0.5-0.6时,加入IPTG诱导,以空载体pET32a作为对照。根据实验室的经验,同时对菌体进行温度、诱导剂浓度、诱导时间等条件的优化,对不同表达条件的菌体进行SDS-PAGE鉴定,选取最优表达条件。
1.2.3 表达菌体的纯化前期处理 取稳定表达的菌种1 mL接种到1 L的LB液体培养基(含Amp)中,在最佳条件下诱导表达,离心收集菌体。用pH7.8 6 mol/L尿素重悬菌体,冰浴条件下超声破碎。离心,取上清进行饱和硫酸铵沉淀,离心,取沉淀透析出去硫酸铵,用pH 7.8 6 mol/L尿素溶解沉淀。将处理过的菌液进行DEAE-Sepharose CL-6B和Ni-NTA亲和层析纯化。采用紫外分光光度计测定纯化蛋白的含量,按以下公式计算蛋白浓度:
蛋白浓度(mg/mL)= A280×1. 45-2 A260×0. 74。1.2.4 融合蛋白Zta-P54的DEAE-Sepharose CL-6B纯化 柱床体积40 mL(3.5 × 4 cm)pH8.8 50 mmol/L的Tris-HCl,4 mol/L的尿素平衡柱子,用5倍柱体积的0.1、0.5、1.0、2.0 mol/L NaCl,pH8.8 50 mmol/L的Tris-HCl,4 mol/L的尿素进行线性梯度洗脱,流速1.5 mL/min,收集样品进行SDS-PAGE检测。并通过Photoshop分析蛋白灰度并计算蛋白纯度。
1.2.5 融合蛋白Zta-P54的Ni-NTA亲和柱纯化 将DEAE-Sepharose CL-6B柱纯化的最佳洗脱蛋白经AKTAPrime plus纯化仪泵入Ni-NTA亲和柱纯化,柱床体积25 mL(2.5×5 cm)pH8.8 50 mmol/L的Tris-HCl,4 mol/L的尿素平衡柱子,用5倍柱体积的20、50、100、200 mmol/L 咪唑,pH8.8 50 mmol/L的Tris-HCl,4 mol/L的尿素进行线性梯度洗脱,流速1.5 mL/min,收集样品进行SDS-PAGE检测。分析蛋白灰度并计算蛋白纯度。
1.2.6 Western blot检测蛋白特性 相同上样量的前期试验纯化的包涵体融合蛋白Zta-P54和本试验纯化后融合蛋白Zta-P54,经SDS-PAGE,切胶转膜处理,用10 mg/L的BSA封闭2 h。PBST洗涤4次。加入鼻咽癌患者阳性血清为一抗阳性对照,空质粒为阴性对照,37℃温浴1.5 h,PBST洗膜4次。加入HRP标记的鼠抗人-IgG作为二抗,37℃温浴2 h,PBST清洗后,再用蒸馏水清洗,然后加入Ecl化学发光显色液显色5 min,暗室曝光1 min,显影1 min定影6 min,最后结果分析并拍照记录。
2 结果
2.1 重组基因的核酸电泳鉴定
将扩增产物BZLF1-BMRF1和重组质粒pET32a/BZLF1-BMRF1酶切产物进行1 %琼脂糖电泳分析,结果见图1,图2。
由图1可以发现约在1 600 bp处的目的条带,其大小与预期结果相符合;图2显示NdeⅠ、XhoⅠ双酶切前有一较亮的质粒条带,质粒双酶切后可以看出约1 600 bp处目的条带,与预期结果相符。
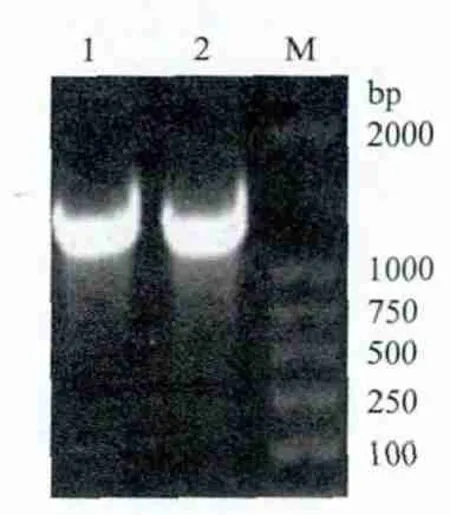
图1 BZLF1-BMRF1 PCR扩增

图2 重组质粒酶切鉴定
2.2 融合蛋白Zta-P54诱导表达条件优化
对菌体进行温度、诱导剂浓度、诱导时间等表达条件的优化,并进行SDS-PAGE鉴定。
重组的质粒经不同IPTG浓度诱导,电泳检测诱导表达结果,通过灰度分析,显示在IPTG浓度为0.2 mmol/L时蛋白表达量最高,见图3,图4。
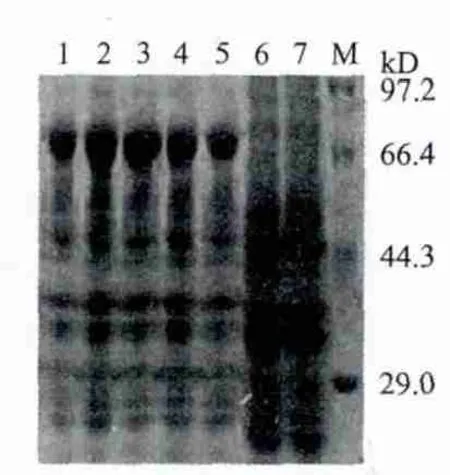
图3 IPTG优化电泳检测

图4 IPTG灰度分析图
重组的质粒在37℃条件下,IPTG浓度为0.2 mmol/L时,改变诱导时间,经电泳检测并对电泳结果进行灰度分析,结果发现诱导6 h时蛋白表达量最高见,图5,图6。
IPTG浓度为0.2 mmol/L时,通过改变诱导温度发现37℃条件下诱导6 h时蛋白表达量最高见图7,图8。
综上所述,条件优化后,最终得到最佳诱导表达条件为37℃,0.2 mmol/L IPTG诱导6 h蛋白表达量最高,蛋白分子量约为60 kD,与预期结果一致。
2.3 融合蛋白的可溶性分析及蛋白纯化
将重组质粒在最佳条件下诱导表达、收集菌液、离心菌体、破菌、分上清和沉淀电泳分析蛋白可溶性,发现该蛋白在大肠杆菌中可溶性表达(图9)通过DEAE-Sepharose CL-6B和Ni-NTA亲和层析纯化,经SDS-PAGE和Photoshop进行灰度分析(图10)。

图5 诱导时间优化电泳检测
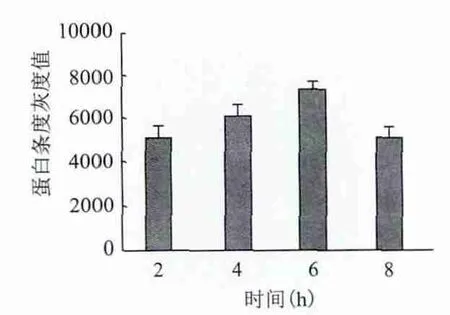
图6 时间灰度分析

图7 诱导温度梯度优化电泳检测

图9 重组蛋白Zta-P54可溶性表达电泳

图10 重组蛋白Zta-P54的纯化
由图9显示目的蛋白Zta-P54主要以可溶性的形式存在;经SDS-PAGE和Photoshop软件灰度分析发现(图10)通过DEAE柱纯化后Zta-P54蛋白的总灰度为9 730,总条带灰度为12 139,计算得出蛋白纯度80 %;经Ni-NTA亲和柱纯化后蛋白的总灰度为27 435,总条带灰度为28 441,计算得出蛋白纯度96.5 %,采用紫外分光光度计法测定纯化后蛋白总量为18 mg,即1 L菌液可以纯化得到18 mg Zta-P54融合蛋白。
2.4 Western blot结果分析
通过Western blot检测融合蛋白 Zta-P54免疫原性及反应特异性,表达产物Zta-P54为阳性对照,空质粒为阴性对照,加入鼻咽癌患者阳性血清反应,结果见图11,图12。由图11,图12可知,融合蛋白Zta-P54与鼻咽癌患者阳性血清混合反应后,在60 kD出现特异性反应带;而空载质粒pET32a相应位置没有条带出现,且可溶性Zta-P54融合蛋白较包涵体Zta-P54融合蛋白有更好的反应特异性。
3 讨论

图11 Western blot检测
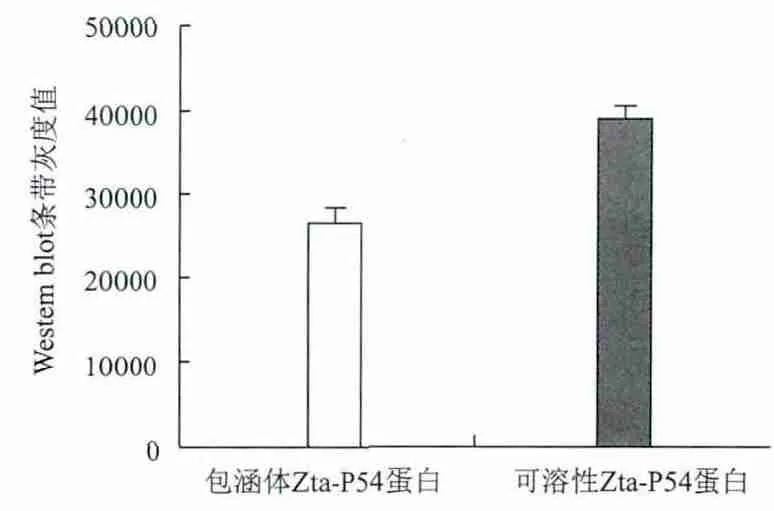
图12 Western blot灰度分析
EB病毒作为一种嗜B淋巴细胞的人类疱疹病毒,它与鼻咽癌、Burkitt淋巴瘤、单核细胞增多症等疾病的发生密切相关。目前广东地区鼻咽癌的发病率较高,且已经成为一种较典型的地方性恶性肿瘤疾病,所以鼻咽癌的早期诊断尤为必要,其中用EB病毒抗原检测病人血清中的抗EB病毒的抗体用来筛查鼻咽癌这一疾病的研究备受关注[9]。目前,随着分子生物学与免疫学技术的发展,已经有多种EB病毒抗原通过基因工程表达和人工合成的方式被纯化出来,并且用作诊断抗原进行了ELISA法、化学发光免疫分析法等方法的研究[10,11],这些单个诊断抗原虽然提高了特异性,但敏感度还不够。因此,可以应用多种EB病毒抗原联合检测,不但可拓宽了抗体反应谱,还可以提高ELISA法的敏感度[12]。
目前,张毅等[13]报道所表达的EB病毒融合抗原多以包涵体形式表达。为提高蛋白活性,本研究选择抗原性较好的立即早期蛋白Zta和早期蛋白P54融合表达。由于前期研究发现pGEX5T-BZLF1-BMRF1载体所表达的Zta-P54蛋白为包涵体[14],所以更换pET32a作为表达载体,该载体带有的Trx标签是高度可溶性多肽,增强了目的蛋白的可溶性。同时,本研究所选序列引入有一段24 bp的连接肽,它编码的氨基酸为GGGGSGGG,其中甘氨酸没有手性碳原子,柔性较好,在融合蛋白之间不会影响两边蛋白各自的构象和功能;而丝氨酸是亲水性最强的氨基酸,可以提高融合蛋白的亲水性。将两种氨基酸串联起来作为连接肽可以保持两蛋白原有的生物活性。通过优化诱导温度、时间、诱导剂浓度等条件,实现了Zta-P54的可溶性表达。Western blot检测发现可溶性蛋白较包涵体蛋白反应特异性性强,克服了包涵体蛋白活性低的缺点。试验发现在温度为37℃、诱导时间6 h、IPTG浓度0.2 mmol/L 的条件下目的蛋白表达量最高。试验过程发现该蛋白较易降解,所以纯化前用6 mol/L尿素处理菌体及饱和硫酸铵沉淀目的蛋白。这一过程既除去了部分杂蛋白又有效的减缓了融合蛋白Zta-P54的降解。最后,通过DEAE-Sepharose CL-6B和Ni-NTA亲和层析纯化,得到纯度高达96.5%的Zta-P54融合蛋白,收率可达到18 mg/L。Western blot检测表明该蛋白可与鼻咽癌患者血清中相应抗体发生特异性结合,有良好的免疫原性及反应特异性。Zta-P54蛋白是我们表达的一种全新的两抗原融合蛋白,将该蛋白应用到鼻咽癌早期诊断和筛查中将会有更好的敏感度和特异性,可降低鼻咽癌的漏诊率,且可利用原核表达方法快速、大量生产该蛋白。
4 结论
本试验成功纯化得到可溶性、高纯度的融合蛋白Zta-P54,且该蛋白有较好的免疫原性,Zta-P54融合蛋白在EB病毒相关疾病的诊断上将具有良好的临床应用前景。
[1] Feederle R, Kost M, Baumann M, et al. The Epstein-Barr virus lytic program is controlled by the co-operative functions of two transactivators[J] . EMBO J, 2000, 19(12):3080-3089.
[2] 顾耀亮, 张昌卿, 吴子柏, 等.抗重组EB病毒双重抗体鼻咽癌血清学研究[J] .癌症, 2003, 22(9):903-906.
[3] Islam MS, Anoop P, Gordon-Smith EC, et al. Epstein-Barr virus infections after allogeneic stem cell transplantation A comparison between nonmalignant and malignant hematological disorder[J] .Hematology, 2010, 15(5):344-350.
[4] Chan KH, Gu YL, Ng F, et al. EBV specific antibody-based and DNA-based assays in serologic diagnosis of nasopharyngeal carcinoma[J] . Cancer, 2003, 105(5):706-709.
[5] Paramita DK, Fachiroh J, Artama WT, et al. Native early antigen of Epstein-Barr virus a promissing antigen for diagnosis of nasopharyngeal carcinoma[J] . J Med Virol, 2007, 79(11):1710-1721.
[6] Dardari R, Hinderer W, Lang D, et al. Antibody responses to recombinant Epstein-Barr virus antigens in nasopharyngeal carcinoma patients:Complementary test of ZEBRA protein and early antigens p54 and p138[J] . J Clin Micro, 2001, 39(9):3164-3169.
[7] Chan KH, Gu YL, Ng F, et al. EBV specific antibody-based and DNA-based assays in serologic diagnosis of nasopharyngeal carcinoma[J] . Int J Cancer, 2003, 105(4):706-709.
[8] Chan JKC, Pilch BZ, Bray F, et al. Nasopharyngeal carcinoma[M] //Barnes L, Eveson JW, Reichart P, Sidransky D. World Health Organization Classification of Tumours. Pathology&Genetics. Head and Neck Tumours. Lyon France:IARC-Press, 2005:85-97.
[9] Allen MD, Young LS, Dawson CW. The Epstein-virus encoded LMP2A and LMP2B proteins promote epithelial cell spreading and motility[J] . Virol, 2005, 79(6):1789-1802.
[10] 伊强, 王文华, 陈丹, 等.以合成肽为抗原建立ELISA试验检测鼻咽癌患者EB病毒抗体的研究[J] .中华肿瘤防治杂志,2008, 15(8):610-611.
[11] Hoebe EK, hutajulu SH, VanBeek J, et al. Purified hexameric Epstein-virus encoded BARF1 protein for measuring anti-BARF1 antibody responses in nasopharyngeal carcinoma patients[J] .Clin Vaccine Immunol, 2011, 18(2):298-304.
[12] Fachiroh J, Stevens SJ, Haryana SM, et al. Combination of Epstein-virus scaffold(BDRF1/VCA-p40)and small capsid protein(BFRF3/VCA-p18)into a single molecule for imprived serodiagnosis of acute and malignant EBV-driven disease[J] . J Virol Methods, 2010, 169(1), 79-86.
[13] 张毅, 周淑艳, 孙业红, 等.EB病毒融合蛋白 ztaN-p23 在大肠杆菌中的表达、纯化及活性鉴定[J] .细胞与分子免疫学杂志, 2012, 28(2):120-123.
[14] 伊强.以原核表达的EB病毒融合蛋白p54-ztaN为抗原建立ELISA方法及其在鼻咽癌诊断中的应用[D] .福建:福建医科大学, 2008.

