嗜水气单胞菌转录调控蛋白基因的克隆与序列分析
李雪 胡秀彩 兰云 沈晓静 吕爱军 朱爱华
(江苏师范大学生命科学学院,徐州 221 116)
嗜水气单胞菌(A. hydrophila)是一种典型的鱼、畜、人共患病病原菌[1,2],主要致病因子包括外毒素、胞外蛋白酶等,并与转录调控蛋白AhyR基因有关[3]。研究表明,嗜水气单胞菌AhyR基因调控溶血素、胞外蛋白酶等产生[4,5]。毕志香等[4,6]构建嗜水气单胞菌J-1菌株AhyR基因突变株J-1△AhyR,发现AhyR基因与蛋白酶、溶血素、DNA酶等主要致病因子表达有关。嗜水气单胞菌AhyR基因突变阻止产生N-酰基高丝氨酸内酯,从而进一步抑制蛋白酶的产生[5]。Swift等[7]报道嗜水气单胞菌AhyR蛋白能够促使胞外蛋白酶较早表达,有效防御病原菌侵入抵制感染。此外,AhyR蛋白与细菌群体感应信号调控蛋白LuxR功能类似,参与调控生物膜形成以及胞外蛋白酶产生[8,9]。关于鱼源嗜水气单胞菌AhyR基因的序列分析及其结构预测,目前尚未见文献报道。本 研究从嗜水气单胞菌Zf1菌株中克隆获得AhyR基因,并对其编码蛋白进行生物信息学分析,有助于理解嗜水气单胞菌的分子致病机理。
1 材料与方法
1.1 材料
嗜水气单胞菌Zf1菌株由本实验室保藏。细菌基因组DNA提取试剂盒购自上海生工生物工程有限公司,pMD18-T Vector购自TaKaRa公司,UNIQ-10柱式DNA胶回收试剂盒、PCR扩增试剂均购自上海捷瑞生物工程公司。
1.2 方法
1.2.1 引物设计与合成 参考嗜水气单胞菌AhyR基因序列(登录号:YP_855090),设计特异性上下游引物(AhyR-F:CGATTGCGAAAGCGATAA;AhyR-R:CTGCTGAGCCATTGGTTTT)用于PCR扩增Zf1菌株AhyR基因,引物由上海生工生物工程有限公司合成。
1.2.2 Zf1菌株AhyR基因克隆 参考李雪等[10]方法,将Zf1菌株接种于LB液体培养基中,28℃培养12 h。取1 mL菌液用于提取基因组DNA,具体操作参照细菌基因组DNA提取试剂盒说明书。将提取到的基因组DNA用1%琼脂糖凝胶电泳检测,-20℃保存备用。PCR扩增采用10 μL体系:提取的Zf1菌株基因组DNA模板1.0 μL,上下游引物各0.5 μL,Master Mix 5.0 μL,ddH2O 3 μL。PCR循环条件为:94℃预变性2 min,94℃变性45 s,50℃退火45 s,72℃延伸2 min,经30个循环后72℃再延伸10 min。得到目的条带后,按照UNIQ-10柱式DNA胶回收试剂盒说明书回收目的基因。将胶回收得到的DNA片段用1%琼脂糖凝胶电泳检测,-20℃保存备用。将AhyR基因胶回收产物与pMD18-T载体连接,转化到DH5α感受态细胞,阳性克隆菌样送上海生工测序。
1.2.3 基因序列及其结构分析 用Edit seq推测氨基酸序列,利用Motif Scan、blastp程序预测结构域,NetPhos 2.0 Server预测磷酸化位点[11]。通过邻接法(Neighbor-Joining),应用MEGA 5.1软件构建系统发育进化树分析。将蛋白氨基酸序列提交SWISSMODEL预测三级结构,用RasMolVersion 2.7.5.2查看蛋白三级结构,并用拉马钱德兰图(Ramachandran plot)检测蛋白模型的合理性。
2 结果
2.1 Zf1菌株AhyR基因克隆及序列分析
PCR扩增得到一条特异性条带(图1),测序获得AhyR基因大小为1 063 bp,引物序列见图2,推测ORF编码260 aa;查找结构域发现AhyR蛋白18-168 aa区域为自体诱导物结合域(PF03472),176-241 aa区域为LuxR型螺旋-转角-螺旋DNA结合结构域(PS50043),183-227 aa区域为DNA结合域(PF04967)(图3);预测AhyR蛋白含有13个磷酸化位点,其中有8个丝氨酸(15S、62S、144S、145S、156S、173S、200S、227S)、3个苏氨酸(30T、184T、188T、)和2个酪氨酸(161Y、231Y),进一步预测酪蛋白激酶Ⅱ磷酸化位点(15S、173S、184T、199T)和蛋白激酶C磷酸化位点(173S、184T、210T、222T)(图4)。

图1 AhyR基因的PCR电泳
2.2 AhyR基因蛋白序列比对及系统进化树分析
对AhyR蛋白进行多重序列比对表明气单胞属不同菌种AhyR氨基酸序列高度保守,与杀鲑气单胞菌(A. salmonicida)、维隆气单胞菌(A. veronii)、豚鼠气单胞菌(A. caviae)、中间气单胞菌(A. media)、简达气单胞菌(A. jandaei)序列同源性分别为100%、99.62%、99.23%、98.85%、94.23%。构建系统发育进化树分析显示AhyR为LuxR同源蛋白之一,AhyR蛋白与嗜水气单胞菌(登录号YP_855090)的AhyR蛋白亲缘性最近,自然聚为一支(图5)。
2.3 AhyR基因编码蛋白三级结构预测

图2 Zf1菌株AhyR基因的上下游引物测序图谱

图3 AhyR蛋白blastp保守结构域图

图4 AhyR蛋白磷酸化位点预测
进一步分析AhyR蛋白三级结构,确定以群体感应控制阻遏物的A链(PDB:3SZT_A)为模板,该蛋白与模板相似性达28.40%,通过SWISSMODEL在线比较建模结果,如图6-A所示,AhyR蛋白主要由15个α螺旋、5个β折叠和19个转角构成,该三级结构与二级结构序列特征分析结果基本一致;图6-B显示LuxR型螺旋-转角-螺旋结构域主要以α螺旋分布在三级结构C端外侧。拉马钱德兰图检测结果(图7)表明有93.9%氨基酸序列位于最适宜区,5.9%氨基酸序列位于允许区,证实AhyR基因推导蛋白的三级结构模型合理。
3 讨论

图5 邻接法构建AhyR蛋白的系统进化树
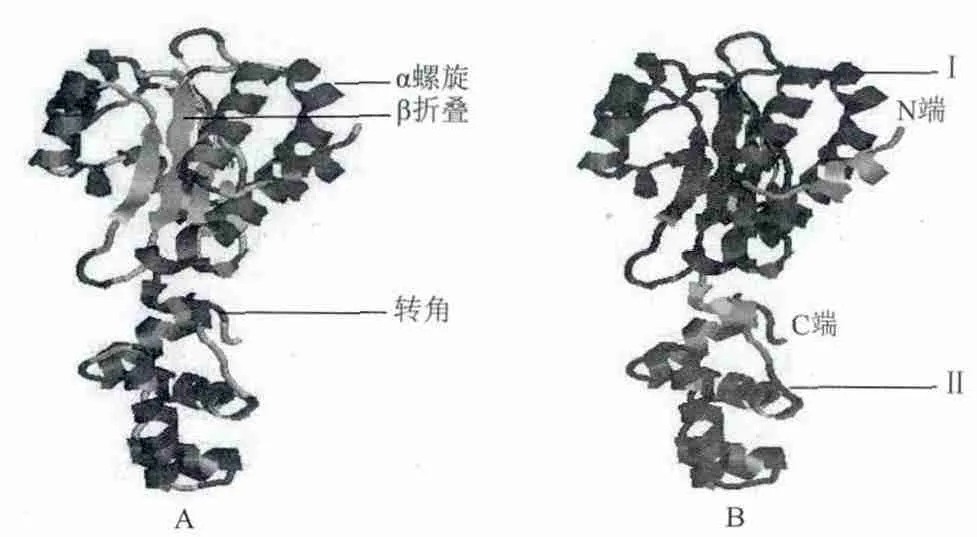
图6 AhyR蛋白的3D结构预测图
嗜水气单胞菌致病因子主要包括外毒素、胞外蛋白酶等,还与转录调控蛋白AhyR基因有关[3]。AhyR蛋白在嗜水气单胞菌蛋白酶活性调节中起重要作用,促使胞外蛋白酶较早表达,有效防御病原菌侵入抵制感染[7]。Bi等[4]利用自杀性重组质粒pJP-AhyR插入诱变嗜水气单胞菌J-1菌株AhyR基因,构建该基因突变株J-1△AhyR,证实AhyR基因与嗜水气单胞菌致病因子表达有关。Kirke等[8]报道嗜水气单胞菌AhyR蛋白属于LuxR型家族调控蛋白之一,AhyR基因能够调节N-酰基高丝氨酸内酯合成酶生成,与生物膜形成和细胞外蛋白酶产生有关。LuxR调控蛋白在革兰氏阴性菌群体感应系统中与自体诱导物(Autoinducers,AI)信号传递分子结合[12],进一步调控细菌多种生理活动[4-9]。此外,细菌转录调控蛋白PhoB、TraR与LuxR蛋白DNA结合域高度保守[13,14]。Shindoh等[13]认为大肠杆菌PhoB转录调控蛋白DNA结合域与磷酸盐饥饿诱导激活基因调控有关。Vannini等[14]研究发现根癌土壤杆菌(Agrobacterium tumefaciens)TraR蛋白基因结合区位于DNA结合域和GAF/PAS结构域之间。AhyR蛋白N端自体诱导物结合域为信号分子结合区域,C端DNA结合域能与目的基因特异性结合,以调控转录活性[14,15]。本研究采用PCR方法扩增得到嗜水气单胞菌Zf1菌株AhyR基因序列,预测含有自体诱导物结合域和LuxR型螺旋-转角-螺旋DNA结合结构域,这与国外文献报道[13,14]一致。此外还发现,以上两个功能域为LuxR型家族调控蛋白独有结构域,有待于进行AhyR基因功能的生物学验证。
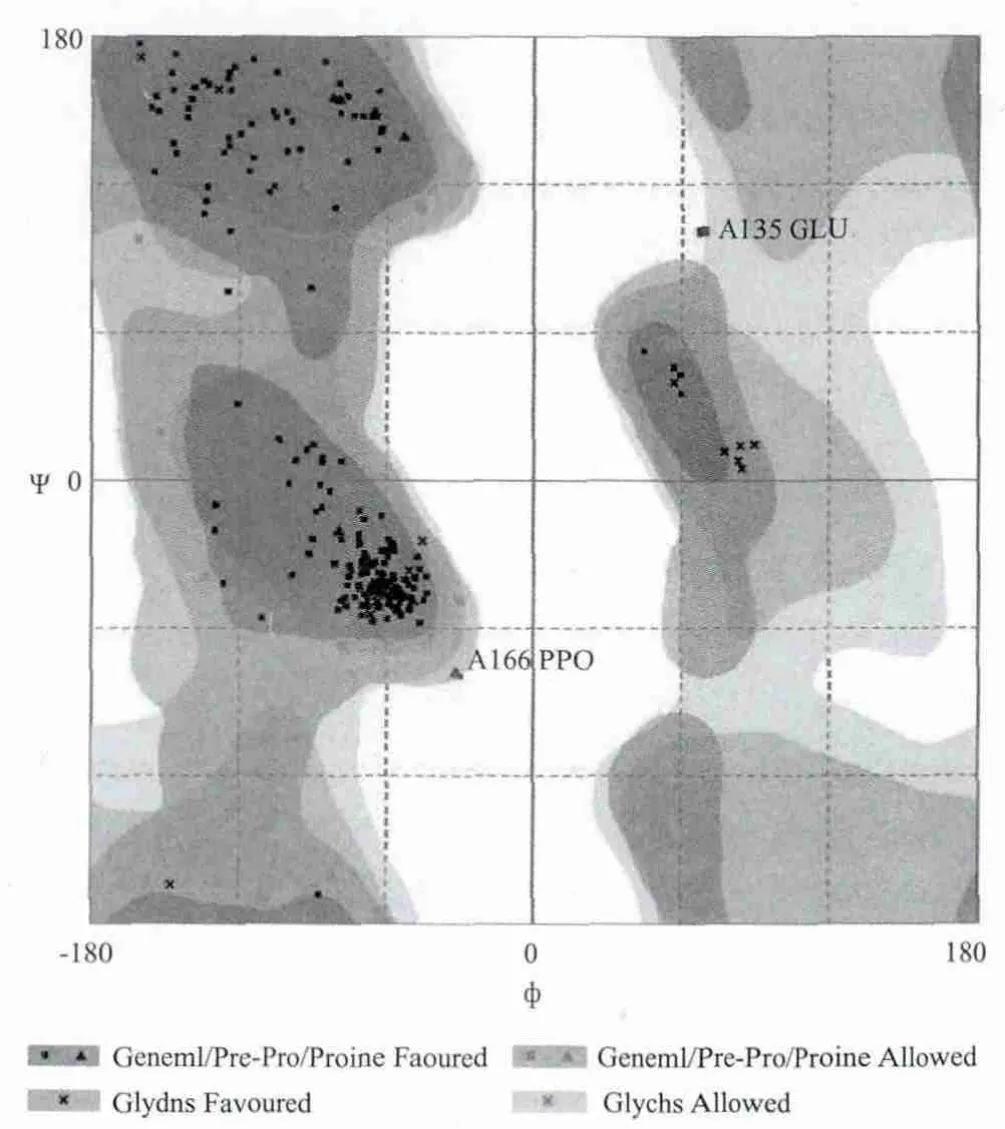
图7 AhyR蛋白片段3D模型的拉马钱德兰图分析
细菌转录调控蛋白(如UhpA、AhyR、LuxR等)磷酸化参与基因转录调控、细胞凋亡等生理病理过程,在感染致病过程中起重要调控作用[16-20]。因此,预测嗜水气单胞菌AhyR蛋白的磷酸化位点有助于研究AhyR蛋白功能。Dahl等[18]研究大肠杆菌转录调控蛋白UhpA磷酸化后,能够结合到糖磷酸转运蛋白UhpT启动子,实现UhpT蛋白表达。Ottosen等[19]鉴定单纯疱疹病毒VP16转录调控蛋白5个磷酸化位点(18S、353S、375S、411S、452S),其中375S在VP16与Oct-1相互作用过程中发挥重要作用,这可能与病毒介导早期基因启动及转录调控功能有关。Jeličić等[20]诱导酵母转录调控蛋白(Gal4)DNA结合域中7个丝氨酸位点突变,预测转录活性和与DNA结合能力,发现2个磷酸化位点(22S、85S),认为DNA结合域中的丝氨酸介导转录机制中蛋白质相互作用,从而稳定激活子Gal4蛋白。本研究预测Zf1菌株AhyR蛋白含有13个磷酸化位点发现,173S、184T为酪蛋白激酶Ⅱ和蛋白激酶C磷酸化位点。此外,对气单胞属AhyR蛋白序列比对,结果表明氨基酸序列同源性高于90%,系统发育进化树分析显示AhyR为LuxR同源蛋白,这与郑世超等[21]报道结果基本一致。进一步分析AhyR蛋白三级结构,以及拉马钱德兰图检测表明AhyR基因推导蛋白的三级结构模型合理,有助于进一步试验验证AhyR蛋白功能及其分子调控机制。
4 结论
获得嗜水气单胞菌Zf1菌株AhyR基因大小为1 063 bp,推导编码260 aa,发现含有自体诱导物结合域(PF03472)、LuxR型螺旋-转角-螺旋DNA结合结构域(PS50043)及13个磷酸化位点。AhyR蛋白三级结构显示LuxR型螺旋-转角-螺旋结构域主要以α螺旋分布在C端外侧,与拉马钱德兰图检测分析AhyR蛋白空间结构基本一致。
[1] Yadav AS, Kumar A. Prevalence of enterotoxigenic motile aeromonads in children, fish, milk and ice-cream and their public health significance[J] . The Southeast Asian Journal of Tropical Medicine and Public Health, 2000, 31(1):153-156.
[2] 蔡丽娟, 徐宝青, 林启存. 水产致病性嗜水气单胞菌耐药性比较与分析[J] . 水产科学, 2011, 1(30):42-45.
[3] 邱军强, 杨先乐, 等. 嗜水气单胞菌毒力因子特性及作用机理研究进展[J] . 中国病原生物学杂志, 2009, 4(8):616-619.
[4] Bi ZX, Liu YJ, Lu CP. Contribution of AhyR to virulence ofAeromonas hydrophilaJ-1[J] . Research in Veterinary Science,2007, 83(2):150-156.
[5] Swift S, Karlyshev AV, Fish L, et al. Quorum sensing inAeromonas hydrophilaandAeromonas almonicida:Identification of theLuxRIHomologsAhyRIand their cognate N-Acylhomoserine lactone signal[J] . Journal of Bacteriology, 1997, 179(17):5271-5281.
[6] 毕志香, 刘永杰. 嗜水气单胞菌转录调控蛋白基因(ahyR)突变株的构建及特性分析[J] . 农业生物技术学报, 2006, 14(1):55-59.
[7] Swift S, Lynch MJ, Fish L, et al. Quorum sensing-dependent regulation and blockade of exoprotease production inAeromonas hydrophila[J] . Infection and Immunity, 1999, 67(10):5192-5199.
[8] Kirke DF, Swift S, et al. TheAeromonas hydrophilaLuxR homologue AhyR regulates the N-acyl homoserine lactone synthase, AhyI positively and negatively in a growth phase-dependent manner[J] .FEMS Microbiology Letters, 2004, 241(1):109-117.
[9] Lynch MJ, Swift S, Kirke DF, et al. The regulation of biofilm development by quorum sensing inAeromonas hydrophila[J] . Environmental Microbiology, 2002, 4(1):18-28.
[10] 李雪, 王艺, 兰云, 等. 嗜水气单胞菌气溶素基因克隆与蛋白结构预测[J] . 生物技术, 2013, 23(2):4-9.
[11] 张林华, 邱红林, 刘超, 等. 天山雪莲PsaH基因的克隆及序列分析[J] . 生物技术通报, 2013(6):75-79.
[12] Nasser W, Reverchon S. New insights into the regulatory mechanisms of the LuxR family of quorum sensing regulators[J] .Analytical and Bioanalytical Chemistry, 2007, 387(2):381-390.
[13] Shindoh K, Maenaka K, Akiba T, et al. Crystallization and preliminary X-ray diffraction studies on the DNA-binding domain of the transcriptional activator protein PhoB fromEscherichia coli[J] .Acta Crystallographica. Section D, Biological Crystallography,2002, 58(Pt 10 Pt 2):1862-1864.
[14] Vannini A, Volpari C, Gargioli C, et al. The crystal structure of the quorum sensing protein TraR bound to its autoinducer and target DNA[J] . EMBO Journal, 2002, 21(17):4393-4401.
[15] Egland KA, Greenberg EP. Quorum sensing inVibrio fischeri:elements of the luxl promoter[J] . Molecular Microbiology, 1999,31(4):1197-1204.
[16] González JE, Keshavan ND. Messing with bacterial quorum sensing[J] . Microbiology and Molecular Biology Reviews, 2006,70(4):859-875.
[17] Correa NE, Lauriano CM, McGee R, et al. Phosphorylation of the flagellar regulatory protein FlrC is necessary forVibrio choleraemotility and enhanced colonization[J] . Molecular Microbiology,2000, 35(4):743-755.
[18] Dahl JL, Wei BY, Kadner RJ. Protein phosphorylation affects binding of theEscherichia colitranscription activator UhpA to the uhpT promoter[J] . Journal of Biological Chemistry, 1997, 272(3):1910-1919.
[19] Ottosen S, Herrera FJ, Doroghazi JR, et al. Phosphorylation of the VP16 transcriptional activator protein during herpes simplex virus infection and mutational analysis of putative phosphorylation sites[J] . Virology, 2006, 345(2):468-481.
[20] Jeličić B, Nemet J, Traven A, et al. Solvent exposed serines in the Gal4 DNA binding domain are required for promoter occupancy and transcriptional activationin vivo[J] . FEMS Yeast Research,2013, 14(2):1567-1356.
[21] 郑世超, 罗瑛, 鲁涛. LuxR 家族调控蛋白的结构及功能[J] .生命科学, 2010, 22(9):886-895.

