三种食源性致病菌的多重PCR快速检测及应用
余倩 黄梦娜
(仲恺农业工程学院 轻工食品学院,广州 510225)
民以食为天,食以安为先。近年来食品安全问题的频频发生,给人民的日常生活带来巨大的影响。目前影响食品安全的主要因素有:农业化学控制物质、农药残留、食品添加剂、动植物天然毒素、真菌毒素、食源性致病菌和病毒[1]。
据世界卫生组织(World health organization,WHO)统计数据显示,全球每年发生的食源性疾病病例数可达到10亿[2]。如日本发生的肠出血性大肠杆菌O157H7中毒事件,最终导致万人以上食物中毒[3]。据2004-2007年中国突发公共卫生事件报告管理信息系统统计,由微生物引起的食物中毒事件为652起[4]。如2012年8月19日,百余名游客在三亚某酒店进餐后,食用了被沙门氏菌污染的蛋炒饭而引起食物中毒;2011年下半年,我国各大速冻食品厂的食品均被检出金黄色葡萄球菌超标。由食源性致病菌引起的食品安全问题逐渐受到人民的关注与重视。
由于传统的微生物检测方法步骤繁琐,消耗时间长,工作量大,限制了它的使用。分子生物学方法作为食品微生物学的主要检测方法之一,在近几年得到广泛的运用,主要包括基因探针检测方法、PCR技术、基因芯片技术等[5-8]。
PCR技术又称聚合酶链式反应(Polymerase chain reaction,PCR),是从20世纪80年代中期发展起来的体外核酸扩增技术,因具有特异性强、灵敏度高、操作简便等优点而在生物医学领域中有较好的发展[9]。随后又出现了逆转录PCR、实时PCR、巢式PCR、多重PCR、荧光定量PCR和不对称PCR等,PCR技术也成为了分子生物学最重要的技术之一[10-12]。
本研究所采用的hilA基因为侵袭基因正调节蛋白基因,是沙门氏菌的毒力基因[13]。O157H7菌体抗原特异合成酶rfbE基因是参与O抗原脂多糖的生物合成基因,与Stx、eae、hlyA等其他毒力基因相比,特异性更强,所有O157H7菌体进行PCR都可扩增出该片段[14]。耐热核酸酶nuc基因是目前检测金黄色葡萄球菌重要的靶基因[15]。针对以上3个基因设计特异性引物,建立了可同时检测3种病原菌的多重PCR方法,并对其在食品检测方面的应用进行了初步的探讨。
1 材料与方法
1.1 材料
菌种名称及编号,见表1。

表1 菌种名称及编号
1.2 方法
1.2.1 引物的设计与合成 根据沙门菌的hilA基因、金黄色葡萄球菌的nuc基因和肠出血性大肠杆菌O157H7的rfbE基因,应用Primer Premier 5.0分别设计如下3对特异性引物(表2),并送至生工生物(上海)有限公司合成。
1.2.2 食源性致病菌的培养和基因组DNA的提取 从保藏斜面中挑取合适的菌落置于LB液体培养基中,37℃恒温培养24 h后,再以140的比例转接至新的LB培养液中37℃恒温培养24 h进行活化。最后以140的比例移接至新的LB培养液中37℃恒温振荡培养2-4 h,至菌液OD600为0.7-1.0,用细菌DNA 提取试剂盒分别提取3种菌的DNA,-20℃保存备用。
1.2.3 单重PCR反应体系的建立 单重PCR反应体系(50 μL):Taq酶0.25 μL,10×PCR Buffer 5 μL,dNTP Mixture 4 μL,模板DNA溶液3 μL,引物(20 μmol/L)各1 μL,加去离子水至50 μL。
PCR参数:94℃预变性5 min;94℃变性40 s,50℃退火1 min,72℃延伸2 min,30个循环;72℃延伸 7 min。4℃保存。
1.2.4 多重PCR 反应体系的建立及优化 将以上3对引物进行两两组合或三者混合,混合3种致病菌的基因组DNA作为模板进行PCR 反应,验证多重PCR反应的特异性及引物之间的相互作用。调整反应体系中的引物浓度和模板浓度等,优化多重PCR反应体系,反应程序同1.2.3。
1.2.5 人工模拟样品的PCR检测 分别制备沙门氏菌、肠出血性大肠杆菌O157H7和金黄色葡萄球菌的菌悬液,将3种培养液单独接种鲜奶培养24 h,或任意两两等量混合然后取少量接种到鲜奶中培养24 h。对人工染菌的食品样品先进行增菌,而后用试剂盒提取致病菌基因组DNA进行PCR检测。以未染菌的食品作为阴性对照。
2 结果
2.1 菌种及靶点在NCBI的编号
针对试验所用的沙门氏菌、肠出血性大肠杆菌O157H7、金黄色葡萄球菌这3个菌种,及筛选确定出的靶基因,从NCBI网站上下载3种菌的基因组及其特异性靶点的序列。

表2 设计的引物汇总表

表3 菌种及靶点在NCBI上的编号
2.2 单重PCR反应体系验证结果
分别使用3种食源性致病菌所特有的特异性引物进行单重PCR反应,均能扩增出与预计大小相符的目的条带(图1),且无非特异性条带和二聚体;肠出血性大肠杆菌O157H7的rfbE基因287 bp;金黄色葡萄球菌的nuc基因354 bp;沙门氏菌的hilA基因468 bp;Marker和PCR产物的上样量均为400 ng。回收3个PCR产物进行测序,并在线与NCBI数据库中的相应种的序列进行比对,比对结果显示序列同源性均在99%以上。
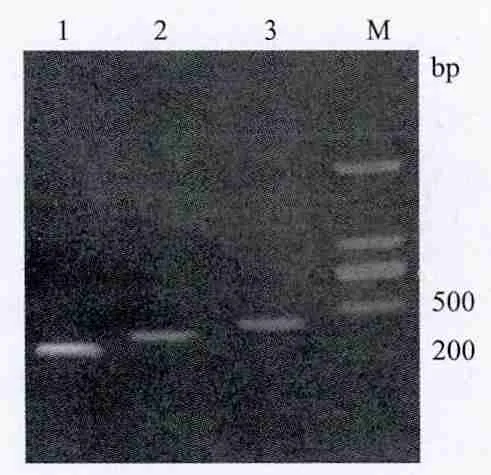
图1 单重PCR 反应
2.3 PCR反应特异性实验
将3种致病菌的基因组DNA等量混合为模板,分别用一对引物进行PCR反应,结果显示肠出血性大肠杆菌O157H7引物只能扩增出肠出血性大肠杆菌O157H7中287 bp大小的条带,没有非特异性条带和引物二聚体;金黄色葡萄球菌引物只能扩增出金黄色葡萄球菌的354 bp大小的条带,无非特异性条带和引物二聚体;同样沙门氏菌引物也只能扩增出沙门氏菌468 bp大小的条带,无其他非特异性条带。这说明所设计的引物具有高度特异性。
2.4 多重PCR反应体系的建立
分别将沙门氏菌、肠出血性大肠杆菌O157H7、金黄色葡萄球菌的基因组DNA等量混合为模板,按优化的多重PCR反应体系进行扩增,结果(图2)显示,双重PCR反应后在相应大小位置处出现了两条特异性条带,三重PCR反应后,在354、287和468 bp处分别出现了明显的特异性目的条带,且无非特异性条带和引物二聚体的形成,Marker和PCR产物的上样量均为400 ng。经过多次试验,确定多重PCR 的反应体系为:(50 μL):Taq酶0.25 μL,10×PCR Buffer 5 μL,dNTP Mixture 4 μL,模板DNA溶液3 μL,引物(20 μmol/l)各1 μL,加去离子水至50 μL。

图2 双重、三重PCR 反应
2.5 人工模拟样品的PCR检测
将沙门氏菌、肠出血性大肠杆菌O157H7和金黄色葡萄球菌的培养液单独接种至鲜奶中或任意两两等量混合取少量接种至鲜奶中培养。经增菌后提取致病菌基因组DNA进行PCR反应,结果(图3)显示,未加致病菌的鲜奶不能检测出特异性条带,而接种相应致病菌的鲜奶均能检测出对应的特异性目的条带,Marker和PCR产物的上样量均为400 ng。以上结果说明本研究所建立的多重PCR检测方法可应用于食品中的肠出血性大肠杆菌O157H7、金黄色葡萄球菌和沙门氏菌3种致病菌的检测,且该方法均有较高的特异性。
3 讨论

图3 人工模拟样品的PCR检测
在经济发展的现代,健康成为人们越来越关注的问题,食品的安全问题成为社会关注的焦点。PCR快速检测技术因为其特异性强和灵敏度高,操作简单,消耗时间和试剂少,现已用于肝炎、艾滋病、疱疹病毒感染诊断[16],也成为了食源性致病菌的重要检验方法之一。在PCR检测技术基础上发展起来的多重PCR技术也广泛地应用于食品检测方面。
目前用于检测沙门氏菌的靶基因的引物基因主要有invA、invB、invC、invD、invE、hilA、fimA、hns、spv和16S rRNA,血清群特异性引物基因rfb基因和血清型特异性引物基因fliC、fljB和via基因等[13]。目前用于检测肠出血性大肠杆菌O157:H7时,主要的毒力基因有:编码志贺毒素stx1和stx2基因、编码与细菌黏附作用有关的蛋白eaeA基因、编码溶血素hly基因[14]。目前,用于检测金黄色葡萄球菌肠毒素SE的相关靶基因有sea、seb、sec、sed、see、seh、sei和sej基因[13],以及编码耐热核酸酶基因nuc,编码血浆凝固酶coa基因[15]。通过实验,本研究所设计的沙门氏菌的引物hilA-f可有效扩增出468 bp的特异性基因片段,肠出血性大肠杆菌O157H7的引物rfbE-f可有效扩增出287 bp的特异性基因片段,金黄色葡萄球菌的引物nuc-f可有效扩增出354 bp的特异性基因片段,这3对引物可成功用于致病菌的多重PCR快速检测,此前未见报道。
在食品中人工添加3种致病菌沙门氏菌、肠出血性大肠杆菌O157H7和金黄色葡萄球菌,利用本实验所设计的3对引物可成功的进行多重PCR的快速检测。本研究所建立的PCR反应系统具有较好的特异性,为食品中常见致病菌的检测提供了一种快速、简便、准确的方法,具有重要的理论意义及实践意义。
同时多重PCR可以与其他技术相结合,如荧光定量PCR相结合,可提高检测效率。或是与其他检测方法相结合,如基因芯片、实时PCR等,可以创造一个更完整的体系。
4 结论
本研究针对常见的3种食源性致病菌肠出血性大肠杆菌O157H7 的rfbE基因、金黄色葡萄球菌的nuc基因及沙门氏菌的hilA基因,设计出相对应的特异性引物,单重PCR结果显示能扩增出与预计大小一致的片段,没有非特异性扩增。使用设计的引物对人工感染的鲜奶进行检测,结果表明未加致病菌的鲜奶不能检测出特异性条带,而接种相应致病菌的鲜奶均能检测出对应的特异性目的条带。
[1] 史贤明, 刘慧, 刘烈刚, 等.食品安全与卫生学[M] .北京:中国农业出版社, 2013:30-48.
[2] 苏莉莉.从食源性疾病的发生看食品安全的重要性[J] . 中国医药指南, 2007(4):115-118.
[3] 姚敬业, 金庆.1996年发生在日本的肠出血性大肠杆菌O157H7食物中毒[J] .安徽预防医学, 2000, 6(1):79-80.
[4] 金连梅, 李群. 2004-2007年全国食物中毒事件分析[J] .疾病监测, 2009, 6(24):459-462.
[5] 刘雨潇, 刘士敏, 王民, 等.分子生物学方法在食品微生物检测中的应用[J] .生物技术通讯, 2009, 20(3):451-452.
[6] 翁思聪, 朱军莉, 励建荣.水产品中4种常见致病菌多重PCR检测方法的建立及评价[J] . 水产学报, 2011(2):305-314.
[7] Li J, Qi SX, Zhang C, et al. A Two-tube multiplex reverse transcription PCR assay for simultaneous detection of sixteen human respiratory virus types/subtypes[J] . Biomed Research International,2013, 327620.
[8] 王慧, 朱瑞良, 谭燕玲, 等.多重PCR检测三种重要食源性致病菌方法的建立及应用[J] . 中国农业科学, 2011(11):2334-2340.
[9] Chandler D, Wagnon C, Boltonh J. Reverse transcriptase(RT)inhibition ofPCR at low concentrations of template and its implications for quantitative RT-PCR[J] . Appl Environ Microbiologic, 1998,64(2):669-672.
[10] 姜彦君, 都启晶, 赵宏坤.食源性致病菌多重PCR检测方法的建立与应用[J] .中国食品学报, 2013(10):162-169.
[11] 李丁玲, 任敬, 马晓燕, 等.多重PCR检测食源性致病菌的研究[J] .食品工业, 2012(10):159-163.
[12] Yang MJ, Luo L, Nie K, et al. Genotyping of 11 human papillomaviruses by multiplex PCR with a GeXP analyzer[J] . J Med Virol,2012(6):546-560.
[13] 陈诺, 唐善虎, 岑璐伽, 等.多重PCR技术在食品微生物检测中的应用进展[A] .中国畜牧兽医, 2010, 37(10):72-75.
[14] 平凡, 张守勇, 武盛.国内外乳品微生物限量标准的比较[J] .乳品工业, 2006(8):58-60.
[15] 范一灵, 潘峰, 史贤明.金黄色葡萄球菌分子检测技术的常用靶基因[J] .微生物学杂志, 2003, 3(28):72-76.
[16] 赵红庆, 苑锡铜, 黄留玉.多重PCR技术在病原检测中的应用[J] .生物技术通讯, 2007, 18(5):863-865.

