沙雷氏蛋白酶及其专一性抑制剂的研究进展
张琳桓,孙谧,王伟,孙晶晶,刘均忠,郝建华,3*
1(农业农村部极地渔业开发重点实验室,中国水产科学研究院 黄海水产研究所,山东 青岛,266071)2(上海海洋大学 食品学院,上海,201306)3(江苏省海洋生物产业技术协同创新中心,江苏 连云港,222005)
1 沙雷氏蛋白酶
1.1 蛋白酶
蛋白酶(protease)是生物体内通过切断蛋白质肽键从而水解蛋白质的一类酶的总称,控制着蛋白质的大小、组成、空间构象及其最终降解。生物体内的生理活动和疾病的发生与蛋白酶息息相关,如食物的消化吸收,血液的凝固、溶血作用、消炎、血压调节、细胞分化自溶、机体衰老、癌症转移以及生理活性肽的活化等。
蛋白酶来源广泛,初期来源于动物和植物,但这两者所分泌的均为胞内酶,生产耗时耗力,故工业上一般利用微生物进行大规模生产胞外蛋白酶。蛋白酶是目前在全世界产量占比百分之四十且广泛应用的商品酶(主要应用在食品、制革、日化和医药行业等)[1]。
按照国际生物化学和分子生物学联合会(IUBMB)命名委员会规定的命名法,蛋白酶隶属于水解酶类的第4亚类,然而,由于自身作用和结构多样性,蛋白酶的命名很难与通用命名系统一致[2]。按照最适作用的pH值,蛋白酶可分类为酸性蛋白酶、中性蛋白酶和碱性蛋白酶[3]。按其水解多肽的方式,可将蛋白酶归类为外肽酶和内肽酶两类[4]:外肽酶是从蛋白质分子的游离氨基或羧基末端逐个水解多肽链,从氨基端水解的为氨基肽酶,从羧基端水解的为羧基肽酶;内肽酶则是专一性地把蛋白质多肽链从分子内部切断,形成小分子量的朊和胨。工业生产用的蛋白酶主要为内肽酶。按催化中心的种类可分为丝氨酸蛋白酶、天冬氨酸蛋白酶、半胱氨酸蛋白酶、金属蛋白酶[5]。其中,金属蛋白酶主要是锌金属蛋白酶[6],跟据锌离子的结合位点又可将锌金属蛋白酶分为五类:嗜热菌蛋白酶(thermolysin)、沙雷氏蛋白酶(serralysin)、龙虾肽酶(astacin)、基质金属蛋白酶(matrixin,metalloproteinase MMP)以及蛇毒金属蛋白酶(adamalysin)[7]。HOOPER[8]对此分类进行扩充,将嗜热菌蛋白酶(thermolysin)与其他拥有谷氨酸配位的蛋白酶合并为谷氨酸锌蛋白(gluzincin),相应的,将剩余后四类合并为甲硫氨酸锌蛋白(metzincin)。
1.2 沙雷氏蛋白酶
沙雷氏蛋白酶属于锌金属蛋白酶M10B亚家族(http://merops.sanger.ac.uk/),是一种广泛存在于革兰氏阴性菌中的胞外内肽酶,多存在于沙雷氏菌、菊欧文氏菌、弗氏埃希氏菌和铜绿假单胞菌中[9]。
1.2.1 沙雷氏蛋白酶的活性中心
锌金属蛋白酶的活性中心是由Zn2+构成,其作用是活化水分子,使水分子亲核攻击肽键的羰基。N段有一段保守序列HEXXH(His-Glu-Xaa-Xaa-His,斜体表示配位体),包含2个组氨酸配位体和1个作为一般碱基的谷氨酸[10]。甲硫氨酸锌蛋白保守区序列延长为HEXXHXXGXXH,提供了3个组氨酸配体与Zn2+结合。HEXXH基序位于1个α-螺旋上,第三配位体在另1个α-螺旋上,而配位体要在空间上缩进距离,必然要有一个转角[11]。因此,β-转角使3个金属配体在空间上相互靠近,也是活性位点形成的基础[12]。在β-转角区域是否存在1个保守的甲硫氨酸,是判断蛋白酶是否属于甲硫氨酸锌蛋白的依据,故又称“甲硫氨酸转角”[13]。对于沙雷氏蛋白酶来说,锌配位保守序列是HEXXHXXGXXHP,在第12位上是1个脯氨酸,甲硫氨酸转角的保守序列是SBMSY,酪氨酸是一般碱基[14]。
孙谧[15-16]等发现了由海洋细菌YS-80-122分泌的胞外海洋低温蛋白酶MP,对其进行了基因测序和晶体结晶。研究表明MP存在2个结构域:N-端结构域是蛋白水解结构域,含有活性位点;C端结构域主要和蛋白稳定性有关,含平行β-卷结构和7个结合的Ca2+。其N-端保守序列为HEXXHXXGXXHP,其中His186、His190、His196、Tyr226以及水分子是Zn2+的配体,形成了三角双锥结构,符合沙雷氏蛋白酶特征。除此之外,MP的N端部分氨基酸序列为ANGTSSAFTQ,与来自假单胞菌属TAC II 18的沙雷氏蛋白酶的氨基酸序列相同,证明其确实属于沙雷氏金属蛋白酶[17]。
1.2.2 沙雷氏蛋白酶性质
沙雷氏蛋白酶是胞外酶,可水解酪蛋白,被EDTA和邻菲咯啉抑制。
KWAK[18]等发现了沙雷氏菌(Escratiaproteamaculans)HY-3产生的属于沙雷氏蛋白酶的胞外酶arazyme,可有效地水解许多蛋白质底物,包括白蛋白,角蛋白和胶原蛋白等。酶的蛋白水解活性不被天冬氨酸,半胱氨酸或丝氨酸蛋白酶抑制剂抑制,但是被1,10-菲咯啉和EDTA强烈抑制。
荧光假单胞菌KT1可以分泌一种细胞外金属蛋白酶,分子量47~48 kDa,部分氨基酸序列分析显示该酶与沙雷氏蛋白酶高度同源。该酶被螯合剂如EDTA和邻菲咯啉强烈抑制,并被某些表面活性剂活化[19]。
1.2.3 沙雷氏蛋白酶的应用及危害
沙雷氏蛋白酶的水解能力和对应产生的致病效果,使其拥有了应用价值。KIM[20]等用几丁质诱导一种新型沙雷氏菌属细菌KCK得到的沙雷氏蛋白酶Mpr,可以通过预处理几丁质来促进几丁质酶A对几丁质的降解。通过生物化学和分子生物学方法从粘质沙雷氏菌FS14中分离鉴定出一种具有独特V型热稳定性的沙雷氏蛋白酶SPB(Serralysin-like protease B,SPB),在60 ℃时具有自溶性质,对棉铃虫幼虫具有毒性,在昆虫控制中具有潜在的应用[21]。
沙雷氏蛋白酶在细菌生理学中的功能被认为是水解周围环境中的蛋白质底物,为细菌细胞提供简单的营养[22]。奇异变形杆菌(Proteusmirabilis)在游动细胞分化过程中产生许多毒素,其中包括胞外金属蛋白酶ZapA(也称为Mirabilysin),该蛋白酶属于沙雷氏蛋白酶。ZapA在感染部位分泌,破坏组织和宿主的免疫系统[23]。SlpE是与粘质沙雷氏菌属临床分离株相关的钙依赖性细胞毒性金属蛋白酶,并且有证据表明SlpE导致沙雷氏菌对A549气道癌细胞系的毒性[24]。郝俊[25]用PCR方法和电子显微镜观察的方法验证了柑橘黄龙病病原中进攻性的I型分泌蛋白(COG2931)的基因属于沙雷氏蛋白酶,并探究了其对黄龙病的致病机理。
2 沙雷氏蛋白酶抑制剂
2.1 蛋白酶抑制剂
蛋白酶抑制剂是一类在动植物和微生物体内普遍存在且分子量很小的有环状结构的蛋白质,可竞争性或非竞争性抑制蛋白酶水解活性,在调节涉及组织蛋白动员和蛋白质前体加工的各种生理和病理过程中起关键作用,还可间接使病毒颗粒无法成熟,抑制病毒的复制。因此,许多致病蛋白酶的抑制剂是有效的抗病药物。
不同类型的抑制剂其活性和作用靶酶不同,不同来源的抑制剂其性质和药理作用也各不相同,这又增加了此类药物临床疗效的选择性。进一步研究蛋白酶抑制剂可以提供无毒无污染的生物农药,还可开发成更具特色的新型药物[26]。
2.2 沙雷氏蛋白酶抑制剂
能抑制沙雷氏蛋白酶的抑制剂有很多种类,包括螯合剂如EDTA和邻菲咯啉,但本文描述的抑制剂是特指从属于沙雷氏蛋白酶的抑制剂,专一性抑制沙雷氏蛋白酶。在对产沙雷氏蛋白酶的微生物进行基因组分析发现:这类蛋白酶基因附近都有一段抑制其酶活性的抑制剂基因,与蛋白酶基因在基因组序列中处于紧邻的位置,属于同一个分泌体[27]。该抑制剂基因编码的蛋白即为沙雷氏蛋白酶抑制剂,是一种小分子蛋白质。
沙雷氏蛋白酶抑制剂具有相当的生物学价值,因为它们涉及在许多情况下调节锌金属蛋白酶活性,包括假单胞菌感染、肿瘤转移和自身免疫性疾病中对组织的破坏[28]。虽然蛋白酶抑制剂具有良好的发展潜力,但是只有少数报道描述了沙雷氏蛋白酶抑制剂的特征,至于沙雷氏蛋白酶和对应抑制剂的复合物,至今为止仅有4种被综述。
2.2.1 沙雷氏蛋白酶抑制剂的性质
沙雷氏蛋白酶抑制剂稳定性较强,热处理后大多可恢复抑制活性,分子量约为10 kDa。ODA[29]等从黑色链霉菌TK-23的培养滤液中分离出能够抑制金属蛋白酶活性的新型金属蛋白酶抑制剂。pH 2~7条件下100 ℃处理5 min后,抑制剂保留其原始活性的80%。分子量为12 kDa,等电点为10.3。该抑制剂显示出高含量的疏水性氨基酸,不含色氨酸,并具有2个二硫键。
LIANG[30]等从海洋细菌黄杆菌sp.YS-80-122克隆了1种新的沙雷氏抑制基因lupI,在高温下是耐热的。沙雷氏金属蛋白酶抑制剂SmaPI的等电点约为10.0,是分子量为10 kDa的单体蛋白质。该抑制剂在沸水中稳定长达30 min,其热稳定性是由于其可逆变性[31]。
2.2.2 沙雷氏蛋白酶抑制剂的作用
沙雷氏蛋白酶抑制剂具有相当的生物学价值,可以治疗沙雷氏蛋白酶诱发的疾病[32-33]。沙雷氏蛋白酶可不同程度的加重脑膜炎、心内膜炎、肾炎、鼠疫、皮炎、软组织感染、败血症、类鼻疽、肺炎以及其他呼吸道和尿道感染等人类疾病,甚至进一步引起菌血症和各种全身感染,特别是对免疫低下的癌症和艾滋病患者尤为严重。在医院感染中,主要造成手术伤口感染和新生儿感染。这种威胁被抗生素耐药菌株的出现所扩大,并且增加了对新型治疗方法的需求。除人类外,这些病原体还可能感染其他生物,脊椎动物和无脊椎动物。例如,铜绿假单胞菌和粘质沙雷氏菌都能够通过基于毒素的机制或通过感染杀死线虫。铜绿假单胞菌还可能攻击植物也可在马中造成鼻疽。沙雷氏蛋白酶的危害程度由特定的约10 kDa内源性抑制剂(即沙雷氏蛋白酶抑制剂)所控制。这些抑制剂由相同的蛋白酶分泌物编码,并进一步提供约25个残基的分泌信号肽。推测其生理功能是保护细菌周质空间从而保证其免受蛋白酶的影响[34]。
CARSON[35]等通过绘制蛋白酶的S10结合位点,试图找到蛋白酶与蛋白酶抑制剂结合的喜好与差异。在2个原始金属蛋白酶抑制剂(1个嗜热蛋白酶抑制剂和1个沙雷氏蛋白酶抑制剂)的基础上,对抑制剂类似物的设计、合成和筛选进行了研究。验证了可以开发有效地抑制沙雷氏蛋白酶的广谱沙雷氏蛋白酶抑制剂的可能性。
植物不可避免地受到各种有害生物和病原体的侵袭,造成作物产量的整体损失。由于缺乏特异性,长期使用化学农药会使病菌产生抗性,污染环境,具有严重的缺陷。因此,可降低抗性发展并且可生物降解的生物防治剂是有利的替代品。蛋白酶抑制剂具有调节蛋白酶的作用,在保护植物免受有害生物和病原体入侵中起重要作用[36]。
3 沙雷氏蛋白酶与抑制剂复合物
3.1 沙雷氏蛋白酶与抑制剂复合的结构
沙雷氏蛋白酶抑制剂对蛋白酶活性位点的抑制通常通过抑制剂的暴露结构元件(如单个环或蛋白质末端)独立地或以2种及以上元件与蛋白酶活性位点对接来实现。通常来说,抑制剂的反应位点和蛋白酶的活性中心是互补的[37]。例如利用N-端残基与Zn2+的配位键,N-端Trunk结构的长度保证了N-端残基和锌离子之间精确和密切的相互作用(如图1所示)。
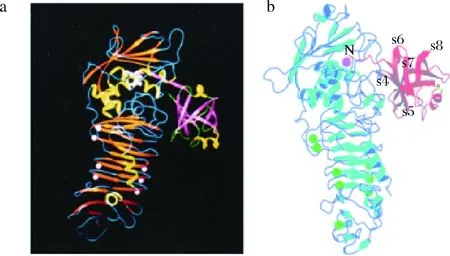
a-Serratia marcescens的蛋白酶SMP与Erwinia chrysanthemi的沙雷氏蛋白酶抑制剂Inh的复合体结构;b-APR与抑制剂APRin的复合物的晶体结构(1JIW)图1 沙雷氏蛋白酶与其抑制剂复合物三维结构图Fig.1 Three-dimensional structure diagram of Serralysin and its inhibitor complex
3.2 四种沙雷氏蛋白酶与抑制剂复合物实例
3.2.1 蛋白酶APR与其抑制剂APRin
来自铜绿假单胞杆菌(Pseudomonasaeruginosa)的1种碱性蛋白酶APR和抑制剂APRin是一组典型的沙雷氏蛋白酶与抑制剂。蛋白酶抑制剂APRin是由几种革兰氏阴性细菌分泌的,具有高亲和性,分子量为11.5 kDa[38]。
蛋白酶APR和抑制剂APRin复合物的晶体衍射结构分析显示,有两个空间上的接触:一个是抑制剂β-折叠IV和V之间的loop环,它与蛋白酶的甲硫氨酸转角相互接触;另一个是N-端5个残基构成的Trunk结构,约成直线状伸入蛋白酶的β-桶结构,占据了酶的活性中心,阻止其他多肽底物进入酶的活性中心,末端氨基基团(Ser)与酶的催化锌配位,从而抑制该蛋白酶的活性[39]。
3.2.2 蛋白酶SMP与其抑制剂SmaPI
沙雷氏金属蛋白酶抑制剂(SmaPI)是沙雷氏金属蛋白酶(SMP)的抑制剂。前体抑制剂通过切割信号肽(26个氨基酸残基)产生SmaPI。该抑制剂具有可逆变性,可在沸水中稳定长达30 min。SmaPI以摩尔比1∶1的比例抑制SMP形成非共价复合物,显示出高蛋白酶特异性,在检测的各种蛋白酶中仅抑制SMP[31]。
LÉTOFFÉ[40]等从365株粘质沙雷氏菌(Serratiamarcescens)中克隆了SMP基因,并从携带重组质粒的大肠杆菌转化体中检测出针对SMP的抑制活性。他们认为SmaPI的抑制活性是保护细胞免受SMP蛋白水解损伤所必需的。在SmaPI的N-端区域的连续缺失分析中, SmaPI基本能全面抑制SMP活性。Leu-3与SMP的相互作用对SMP-SmaPI复合物(8.44 kcal/mol)的整体稳定性贡献0.73 kcal/mol。通过对Leu-3定点突变,验证了疏水的Leu-3在SMP与其抑制剂SamPI结合过程中起重要作用[41]。
3.2.3 多种蛋白酶与抑制剂Inh
菊欧文氏菌(Erwiniachrysanthemi),1种植物病原菌,可产生沙雷氏蛋白酶抑制剂Inh。Inh是1种非常具有热稳定的(95 ℃下t1/2>30 min)碱性蛋白,等电点约为8.5。抑制剂Inh在胞内被合成为12 kDa的蛋白,包括19个残基的信号肽[42]。当抑制剂被分泌到细胞质中后,信号肽被切割,成熟抑制剂的分子量为10 kDa。像许多蛋白酶抑制剂一样,它与蛋白酶以非共价键结合,形成1∶1的非共价复合物。
与SmaPI不同的是,Inh可以抑制不同的沙雷氏蛋白酶。除了对3种菊欧文氏胞外蛋白酶A、B和C有作用外,还强烈抑制来自沙雷氏菌的50 kDa细胞外蛋白酶SMP。BAUMANN[43]等对SMP和Inh的复合物进行晶体分析,发现Inh主要通过5个N末端残基与蛋白酶相互作用,插入活性位点裂隙,占据S'位点。第1个N-末端残基SerI1被蛋白酶切割,而SerI2与蛋白酶的谷氨酸Glu177形成氢键。蛋白酶中位于甲硫氨酸转角之后的218~228片段与由链s3,s4和s5形成的抑制剂的一个面还会发生进一步的相互作用。
3.2.4 蛋白酶MP与其抑制剂LupI
来源于海洋细菌菌株YS-80-122的低温蛋白酶MP基因下游有一个抑制剂基因LupI,该基因的表达产物LupI能在体外完全抑制蛋白酶MP的活性[44]。LupI对其靶金属蛋白酶MP的抑制常数为0.64 μmol/ L;高温下耐热,在100 ℃下处理1~60 min后其抑制活性仍保留35.6%~90.7%。该新型抑制剂可代表用于治疗沙雷氏蛋白酶相关感染的候选药物[30]。
MP与LupI的结构虽然还没有具体复合物晶体数据研究,但梁朋娟[45]等突变了抑制剂LupI的N-端Trunk结构,发现其抑制活性大大降低。结合结构模拟与分子对接,认为该抑制剂与蛋白酶的结合类似于蛋白酶APR和抑制剂APRin,N-端Trunk结构可以直接插入蛋白酶MP的活性中心,导致其失活。
4 结语
近年来,越来越多的学者对沙雷氏蛋白酶或者沙雷氏蛋白酶抑制剂进行研究,提取纯化、基因测序、晶体解析等研究方法日趋成熟,但对于两者结合的具体位点及结构的表述较少,仅有4种沙雷氏抑制剂及其对应蛋白酶复合物被详细描述。沙雷氏蛋白酶在调节组织蛋白动员和蛋白质前体加工的各种生理和病理过程中起关键作用,尤其是对感染类疾病有着重要的作用。沙雷氏蛋白酶抑制剂作为特异性抑制可以只针对特定的靶蛋白酶进行抑制,并且不受抗生素耐药菌株的抗药性影响,因此可就此进行药物的设计,以阻止沙雷氏蛋白酶的危害。进一步探究沙雷氏蛋白酶和其抑制剂的结合有助于利用沙雷氏抑制剂针对性治疗沙雷氏蛋白酶相关疾病,在医学、农业等方面均有巨大潜力。

