共表达内质网响应蛋白HAC1对α-半乳糖苷酶在毕氏酵母中表达的影响
钟开新 陈丽芝 李阳源
(广东溢多利生物科技股份有限公司,珠海 519060)
分泌蛋白进入内质网腔后开始一系列分泌过程。在内质网腔内,分泌蛋白进行折叠,随后完成糖基化、磷酸化和二硫键形成等翻译后修饰过程,才能被转运到细胞外。只有正确折叠的分泌蛋白才能被转运出内质网,而未折叠或折叠错误的分泌蛋白留在内质网腔内。在酵母过表达体系中,如果蛋白折叠机制饱和或蛋白折叠错误,导致内质网腔内不断积累未折叠或折叠错误的分泌蛋白,从而引发细胞内UPR(The unfolded protein response)反应[1]。最新研究表明,UPR反应是酵母细胞中由错误折叠蛋白或未折叠蛋白胁迫引发的信号调控途径,与一系列UPR目的基因的转录调控相关,如分子伴侣、折叠酶及参与糖基化、脂类代谢的蛋白酶等。转录因子Hac1p在激活、维持UPR反应中起着关键作用,通过依赖于UPR信号响应元件(UPRE)调节蛋白折叠或降解等相关基因的转录过程,从而缓解内质网腔内错误折叠蛋白或未折叠蛋白引发的信号胁迫。
利用共表达HAC1蛋白提高外源蛋白在酵母中表达量的报道甚少。Guerfal等[2]将AOX1启动子调控的hac1p基因分别与小鼠白介素-10基因(mIL-10)、反式唾液酸酶基因(TS)在酵母中共表达,提高了mIL-10、TS蛋白表达量;而由GAP启动子调控的hac1基因对蛋白表达量无影响[3,4]。这一研究结果表明过表达HAC1可提高酵母表达系统中外源蛋白的表达含量。本研究将来源于毕氏酵母GS115的hac1基因构建到pPIC9K表达载体中,经线性化后电击转入Gal-21#感受态(α-半乳糖苷酶表达菌株pPiczαA-Gal-X33)中,以期过表达HAC1提高酵母表达系统中α-半乳糖苷酶表达量。通过50 L发酵罐高密度发酵对比,进一步验证共表达HAC1蛋白的毕氏酵母产α-半乳糖苷酶菌株在工业生产中的应用价值。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 克隆受体菌Escherichia coliTOP10,重组酵母菌株GAL-21#(以毕氏酵母X33为受体菌,在基因组内已整合有α-半乳糖苷酶基因),酵母GS115为本试验室保存。质粒pPICZαA、pPIC9K购自Invitrogen公司。
1.1.2 工具酶及试剂PfuDNA聚合酶、TaqDNA聚合酶、T4连接酶均购自上海生工公司;限制性内切酶购自NEB公司;抗生素G418购自Invitrogen公司;对硝基酚-α-D-吡喃半乳糖苷购自Sigma公司。
1.2 方法
1.2.1hac1基因的克隆 根据NCBI发布的hac1基因序列(XM_002489994.1),设计引物hac1F:5'-cg catgcccgtagattcttctc-3'和hac1R:5'-actattcctggaagaatacaaagtc-3'。以毕氏酵母GS115基因组DNA为模板,用高保真PfuDNA聚合酶进行PCR扩增,得到hac1基因序列。
1.2.2hac1基因的毕氏酵母表达质粒构建 将hac1基因PCR扩增产物进行BamH I和NotI双酶切后,与经BamHI和NotI双酶切的pPIC9K混合,用T4DNA连接酶在4℃过夜连接。连接产物转化大肠杆菌TOP10后,通过原位菌落PCR验证及双酶切鉴定获得pPIC9K-hac1重组子。
1.2.3 重组表达质粒的酵母转化 构建好的pPIC9K-hac1表达载体经SacI线性后纯化并回收,取适量回收物进行电转化。电转化后的酵母细胞30℃预培养3 h,然后涂布于含50 μg/mL G418的YPD平板,30℃培养48-72 h,至菌落出现。
1.2.4 共表达HAC1重组毕氏酵母的鉴定 提取重组毕氏酵母基因组DNA,以Invitrogen公司提供的5'AOX1引物(5'-GACTGGTTCCAATTGACAAGC-3')和3'AOX1引物(5'-GCAAATGGCATTCTGACATCC-3')进行PCR扩增,反应条件:94℃预变性4 min;95℃ 30 s,50℃ 30 s,72℃ 90 s,共30个循环;72℃延伸5 min,16℃保温。PCR产物经琼脂糖凝胶电泳进行鉴定。
1.2.5 转化子的α-半乳糖苷酶活性筛选 挑取40个转化子分别培养于装有5 mL BMGY培养液的50 mL离心管中,置于30℃、250 r/min的摇床中培养1 d后,每24 h加入终浓度0.6%的甲醇进行诱导。2 d后测定各转化子酶活进行初筛。从初筛结果中挑选出2个具有较高表达酶活的菌株,分别培养于5 mL BMGY培养液的50 mL离心管中,30℃摇床培养1 d后转接至装有50 mL BMGY培养液的250 mL三角瓶中,且调整初始细胞浓度OD600均约为1。30℃、250 r/min的摇床中培养1 d后,每24 h加入终浓度0.6%的甲醇进行诱导。每24 h测定一次总蛋白浓度及α-半乳糖苷酶活性。
1.2.6 总蛋白浓度及α-半乳糖苷酶活性测定 总蛋白浓度测定方法:取适量培养液离心后获得的上清液进行稀释,按改良型Bradford法蛋白浓度测定试剂盒法进行测定。
α-半乳糖苷酶活性测定方法[5,6]:酶活单位定义:在pH5.5且37℃条件下,10 min内从10 mmol/L对硝基酚-α-D-吡喃半乳糖中降解释放1 μmol对硝基酚所需要的酶量为一个酶活单位U。经浓度为0.05 mol/L的醋酸钠缓冲液(pH5.5)稀释的酶液和底物对硝基酚-α-D-吡喃半乳糖溶液于37℃下振荡10 min预热,然后吸取各溶液0.1 mL,充分混合,于37℃恒温振荡10 min,加入0.8 mL 浓度为0.2 mol/L的碳酸钠溶液,振荡混匀,终止酶反应,在400 nm处测定吸光度。空白对照用经过预热的酶液各0.1 mL,然后加入0.8 mL碳酸钠溶液,振荡混匀,再加入0.1 mL预热的底物于37℃振荡10 min。
1.2.7 50 L发酵罐中高密度发酵对比 将Gal-21#与Gal-HAC1-4#工程菌进行50 L发酵罐高密度发酵,对比其产酶能力。50 L发酵罐中的工程菌诱导过程分为甘油单批培养,甘油分批补料培养和甲醇分批补料培养3个不同阶段。首先,将工程菌种子液按10%的接种量转入装有20 L甘油培养基的发酵罐中,于pH为5.5、温度为30℃、搅拌转速为500 r/min的初始条件下培养约18 h,此过程通过调节罐内气压将溶氧控制在30%左右。当甘油耗尽时开始分批流加甘油补料培养基,如此反复进行几次,当培养基湿重高于150 mg/mL时开始流加甲醇补料培养基以诱导产酶。诱导前期根据DO曲线的变化采取梯度流加,控制甲醇终浓度分别为2%、3%、5%、8%和12%,如此培养12-15 h后进入诱导稳定期,此后以10 g/h的速率恒速流加甲醇补料培养基,并每隔24 h取样进行酶活及蛋白含量分析。
2 结果
2.1 PCR扩增hac1基因
以酵母GS115基因组DNA为模板,利用高保真性Pfu酶扩增hac1基因,经1%琼脂糖凝胶电泳分析,在1.2 kb处可见一条特异性条带,与预期的目的条带大小相同,见图1。
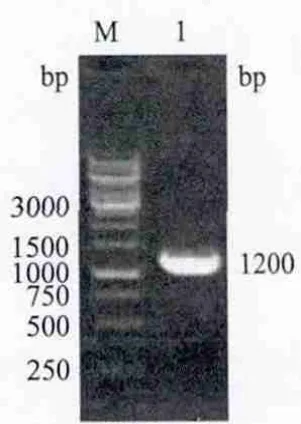
图1 hac1基因扩增产物鉴定
2.2 构建重组表达质粒
hac1基因经酶切后连接到pPC9K载体中,转化大肠杆菌后经LBA(含Amp+)抗性平板筛选获得转化子。原位菌落PCR产物及双酶切产物经1%琼脂糖凝胶电泳分析,均可见约1.2 kb的特异性DNA条带,见图2,图3,表明重组表达质粒构建成功。其测序结果与GenBank中录入的基因序列一致。
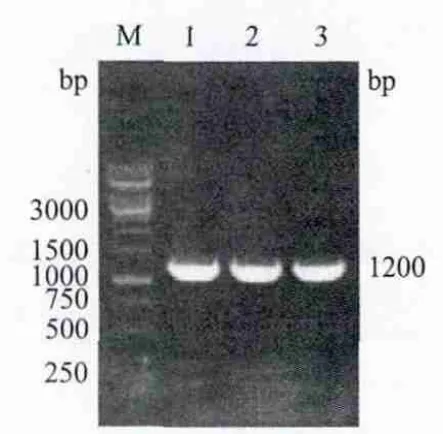
图2 原位菌落PCR产物鉴定

图3 重组表达载体pPIC9K-Hac1双酶切鉴定
2.3 重组酵母的获得与筛选
重组载体pPIC9K-hac1经线性化后,电击转化感受态工程菌GAL-21#,通过加有G418的YPD固体平板进行筛选获得重组转化子。重组转化子转接到5 mL BMGY培养基中培养,经甲醇诱导48 h,测定培养基上清液中α-半乳糖苷酶的活性。在近40个转化子中,筛选得到GAL-HAC1-4#(126.95 U/mL)、GAL-HAC1-21#(66.66 U/mL),其表达α-半乳糖苷酶活性分别是GAL-21#(26.43 U/mL)的4.8、2.5倍。
2.4 HAC1共表达对重组酵母α-半乳糖苷酶表达的影响
250 mL摇瓶培养重组酵母GAL-21#、GALHAC1-4#、GAL-HAC1-21#菌种,每24 h加甲醇诱导表达α-半乳糖苷酶,测定上清液中总蛋白含量及α-半乳糖苷酶活性。在培养液中细胞浓度几乎相同的情况下,GAL-HAC1-4#发酵培养液中总蛋白含量明显高于GAL-21#发酵液(图4),甲醇诱导96 h时GAL-HAC1-4#发酵液中α-半乳糖苷酶活性是GAL-21#发酵液的2.2倍(图5)。表明HAC1共表达显著增加了酵母表达系统中外源蛋白α-半乳糖苷酶的分泌量,大大提高了发酵液中α-半乳糖苷酶的酶活。

图4 共表达菌株与原始菌株发酵表达总蛋白含量
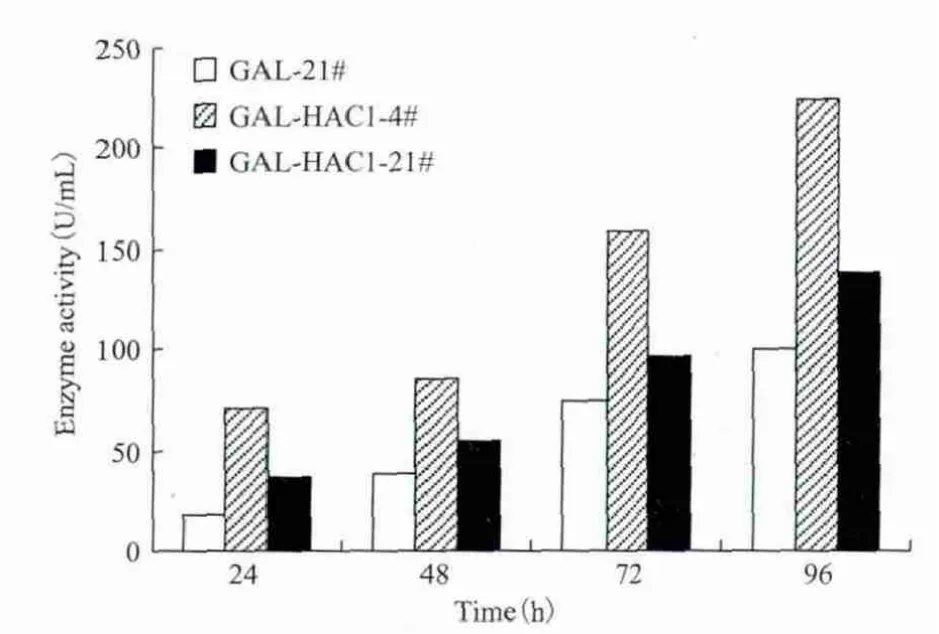
图5 共表达菌株与原始菌株发酵表达α-半乳糖苷酶酶活
2.5 共表达HAC1重组毕氏酵母鉴定
提取重组毕氏酵母GAL-21#、GAL-HAC1-4#、GAL-HAC1-21#基因组DNA,以此为模板进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳分析。GALHAC1-4#、GAL-HAC1-21#可见约1.4 kb(包含载体片段200 bp,hac1基因片段约1.2 kb)、2.4 kb(包含载体片段约200 bp,gal基因片段约2.2 kb)及2.8 kb(酵母基因组AOX1基因)的DNA片段,而GAL-21#只可见2.4 kb和2.8 kb的D NA片段,见图6。表明重组表达质粒pPIC9K-hac1已重组至GAL-21#酵母基因组中。
2.6 50 L发酵罐进行工程菌发酵

图6 共表达HAC1重组毕氏酵母的PCR产物鉴定
Gal-21#与Gal-HAC1-4#工程菌在50 L发酵罐中分别经过甘油单批培养,甘油分批补料培养和甲醇分批补料培养3个不同阶段,其最终发酵酶活分别为5 200 U/mL和6 560 U/mL(图7)。相比Gal-21#,Gal-HAC1-4#工程菌最终发酵酶活提高了27%。加入甲醇诱导后,Gal-HAC-4#工程菌发酵液中粗蛋白含量均高于Gal-21#工程菌(图8)。这些结果进一步表明,毕氏酵母产α-半乳糖苷酶工程菌中共表达HAC1蛋白,可以大大提高工程菌产α-半乳糖苷酶的产酶能力,提高了目的蛋白的表达量,且可运用于大工业化生产中。
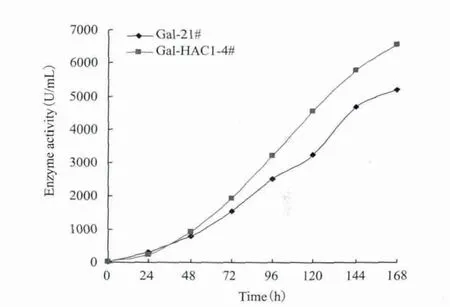
图7 50 L发酵罐中Gal-21#和Gal-HAC1-4#发酵酶活对比

图8 50 L发酵罐中Gal-21#和Gal-HAC1-4# 发酵液中蛋白含量对比
3 讨论
酵母表达系统中外源蛋白分泌是一个极其复杂连续的过程,影响其表达量的因素众多,包括重组载体启动子的强弱,基因密码子的优化,基因拷贝数,mRNA转录过程,非成熟肽在内质网的转运过程,蛋白的翻译后修饰过程等[7]。
在真核细胞中,大部分分泌蛋白和跨膜蛋白以非折叠肽的形式转运到内质网中,且在其腔内进行一系列的折叠和加工过程,从而形成成熟蛋白,并被主动运送到细胞外,这就形成了一种蛋白成熟过程的动态平衡[8]。如果蛋白折叠过程受到限制,导致未折叠蛋白在内质网中过量积累,从而打破这一平衡,细胞就会激发胞内UPR效应[9]。UPR效应激活胞内转录因子HAC1mRNA在细胞核中进行非常规剪接反应,翻译形成Hac1p,Hac1p激活相关伴侣蛋白、折叠因子等基因的转录翻译,进一步提高内质网中未折叠蛋白的折叠过程,促进蛋白成熟过程的动态平衡[10]。如果这一稳态未能重新形成,过度积累的未折叠蛋白加速细胞死亡,从而导致表达蛋白分泌量下降或酶活降低[11]。
Guerfal等[2]将由AOX1启动子调控表达的HAC1p分别与小鼠白介素-10(mIL-10)和来源于克氏锥虫的反式唾液酸酶(TS)在酵母表达系统中诱导表达。研究结果表明,HAC1p的过表达提高了mIL-10蛋白表达量2.2倍,提高了TS蛋白表达量2.1倍。本研究将由AOX1启动子调控表达的HAC1与相同启动子调控表达的α-半乳糖苷酶在酵母表达系统中共表达,研究结果表明,HAC1的过表达提高了酵母表达系统中总蛋白的含量,甲醇诱导96 h时其α-半乳糖苷酶活性最大提高了2.2倍。通过在50 L发酵罐高密度发酵研究,表明Gal-HAC1-4#工程菌在168 h时的最终发酵酶活比Gal-21#工程菌提高了27%,自加入甲醇诱导后,Gal-HAC1-4#工程菌发酵液中粗蛋白浓度均高于Gal-21#。这些研究结果说明,在酵母表达系统中,可能存在大量非折叠蛋白或错误折叠蛋白,而利用过表达HAC1可将这些非折叠蛋白或错误折叠蛋白重新折叠成成熟蛋白的功能,可以大大提高目的蛋白的表达量。
作者尝试将过表达HAC1蛋白分别与木聚糖酶、纤维素酶、植酸酶等在酵母系统中共表达,木聚糖酶、纤维素酶和植酸酶蛋白表达量均无显著提高,表明过表达HAC1影响分泌蛋白的蛋白表达可能具有一定的选择调控机制,这一机制有待进一步深入研究。
4 结论
将hac1基因转入产α-半乳糖苷酶的重组酵母菌株Gal-21#中,在5 mL培养基中诱导48 h筛选获得产α-半乳糖苷酶高表达菌株:GAL-HAC1-4#、GALHAC1-21#,其表达α-半乳糖苷酶活性分别是原始菌株GAL-21#的4.8、2.5倍。在50 L发酵罐中高密度发酵进一步对比Gal-21#菌株和Gal-HAC1-4#菌株的产酶能力,Gal-HAC1-4#菌株最终发酵酶活比Gal-21#菌株提高了27%,Gal-HAC1-4#菌株发酵液中粗蛋白浓度也均高于Gal-21#菌株。表明共表达HAC1蛋白提高了毕氏酵母异源表达α-半乳糖苷酶的能力,且可运用于大工业生产中。
[1] Graf A, Gasser B, Dragosits M, et al. Novel insights into the unfolded protein response usingPochia pastorisspecific DNA microarrays[J] . BMC Genomics, 2008, 9:390.
[2] Guerfal M, Ryckaert S, Jacobs PP, et al. The HAC1 gene fromPichia pastoris:characterization and effect of its overpression on the production of secreted, surface displayed and membrane proteins[J] . Microbial Cell Factories, 2010, 9(1):40-61.
[3] Valkonen M, Penttila M, Saloheimo M. Effects of inactivation and constitutive expression in the yeastSaccharomyces cerevisiae[J] .Appl Environ Microbiol, 2003, 69(4):2065-2072.
[4] Breinig F, Diehl B, Rau S, et al. Cell surface expression of bacterial esterase A bySaccharomyces cerevisiaeand its enhancement by constitutive activation of the cellular unfolded protein response[J] .Appl Environ Microbiol, 2006, 72(11):7140-7147.
[5] 王春林, 陆文清, 李德发, 等. 饲用型青霉α-半乳糖苷酶活力测定的研究[J] . 工业微生物, 2005, 1(35):28-32.
[6] 潘宝海, 李德发, 陆文清, 等. 对硝基酚-α-D-吡喃半乳糖法测定饲用α-半乳糖苷酶(黑曲霉)活力的方法[J] . 中国农业大学学报, 2002, 7(5):107-111.
[7] 屈琳, 雷楗勇, 张琦, 等. 共表达蛋白二硫键异构酶对IFNβ-HAS融合蛋白在毕赤酵母中表达的影响[J] . 中国生物制品学杂志, 2010, 23(4):346-349.
[8] Zito E, Chin KT, Blais J, et al. ERO1-β, a pancreas-specific disulfide oxidase, promotes insulin biogenesis and glucose homeostasis[J] .Journal of Cell Biology, 2010, 188(6):821-832.
[9] De Schutter K, Lin YC, Tiels P, et al. Genome sequence of the recombinant protein production hostPichia pastoris[J] . Nat Biotechnol, 2009, 27(6):561-566.
[10] Cox JS, Walter P. A novel mechanism for regulating activity of a transcription factor that controls the unfolded protein response[J] . Cell, 1996, 87(3):391-404.
[11] Travers KJ, Patil CK, Wodicka L, et al. Functional and genomic analyses reveal an essential coordination between the unfolded protein response and ER-associated degradation[J] . Cell, 2000,101(3):249-258.

