一株产阿魏酸酯酶丝状真菌的分离鉴定及其粗酶性质研究
胡泓宇 周燕燕 陈静 侯运华
(齐鲁工业大学食品与生物工程学院,济南 250353)
阿魏酸酯酶(EC 3.1.1.73,feruloyl esterase,FAE)又称肉桂酸酯酶或肉桂酰酯酶,可以水解阿魏酸、二聚阿魏酸形成的酯键,将阿魏酸释放出来,属于羧酸酯水解酶亚类[1]。该酶可以协同木聚糖酶、纤维素酶和木质素酶最大程度降解植物细胞壁[2]。因此,阿魏酸酯酶在食品、医药、造纸、饲料加工、生物合成及能源开发等诸多领域都有着巨大的应用潜能。
产生阿魏酸酯酶的来源极其广泛,在微生物、植物和动物中均有发现,其中以细菌和丝 状真菌的来源为主。产阿魏酸酯酶的细菌多为厌氧营养型,不利于大规模工业化生产,因此关于丝状真菌产阿魏酸酯酶的研究就显得十分重要[2,3]。丝状真菌产阿魏酸酯酶的研究主要集中在曲霉属,以黑曲霉研究得最为清楚。通常丝状真菌产阿魏酸酯酶活力较低,如de Vries等[4]报道重组黑曲霉和塔宾曲霉产阿魏酸酯酶活力分别为7.71 U/mL和3.16 U/mL。关于侧孢霉和黑曲霉生产阿魏酸酯酶研究比较多。侧孢霉液态发酵酶活达到2.0 mU/mL,固态发酵酶活达到156 mU/g[5]。阿魏酸酯酶活力低下限制了其在工业中的实际应用。
链隔孢属真菌是引起农作物病害的重要致病真菌之一,属于丝孢纲丝孢目。对该类真菌的研究主要集中在致病机理和生物防治方面[6],该菌产生阿魏酸酯酶的报道较少[7]。多数丝状真菌产阿魏酸酯酶已经被国外酶制剂公司申请专利,要进行工业化应用就需要筛选新的产酶菌株。基于此,本试验通过对腐烂木质纤维的土壤样品中分离的产阿魏酸酯酶丝状真菌进行筛选,得到1株产阿魏酸酯酶活性高的菌株,对该菌株进行了菌种形态和分子生物学鉴定,并对其所产阿魏酸酯酶的粗酶性质进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 样品材料 土样采集自山东济南长清周边含有腐烂木质纤维(5-15 cm)的土壤。
1.1.2 化学试剂 对硝基苯酚、阿魏酸乙酯购自Sigma公司。凝胶回收试剂盒、pUM-T载体购自百泰克生物技术公司。T4DNA连接酶购自TaKaRa公司,Taq DNA聚合酶、pfuDNA聚合酶为Bioteke公司的产品,DNA凝胶回收试剂盒购自Sangon公司;阿魏酸对硝基苯酚酯根据文献一步法合成[8];其他常规试剂为国产分析纯。
1.1.3 培养基 富集培养基:马铃薯蔗糖琼脂培养基(PDA)[9],0.1% 阿魏酸乙酯(溶于N,N-二甲基甲酰胺溶液,过滤除菌)。
筛选培养基:(NH4)2SO42.5%,KH2PO40.2%,MgSO40.6%,CaC120.07%,酵母粉0.5%,0.02%TritonX-100,琼脂1.5%。每个平板倒20 mL筛选培养基,立即加300 μL 的10%(W/V)阿魏酸乙酯中,立即摇匀,直至呈现云雾状。28℃培养4 d,观察菌落周围有无透明圈。
发酵培养基:麦麸汁 10%,NH4NO30.28%,KH2PO40.2%,MgSO4.7H2O 0.08%,NaNO30.31%,pH 5.5。
1.2 方法
1.2.1 产阿魏酸酯酶菌株的筛选 准确称取1 g土样,加入100 mL含有无菌玻璃珠的生理盐水中,振荡培养2 h,即为土壤浸提液。取1 mL浸提液液接种于富集培养基中进行培养,置于28℃下200 r/min摇床培养2 d。梯度稀释(10-1-10-6)培养物,各稀释度取100 μL涂布于PDA平板上,28℃培养4 d,观察平板,菌落周围出现透明圈的即为具有产阿魏酸酯酶能力的菌株。挑取有透明圈的菌落于5 mL生理盐水试管中,制备孢子悬浮液,梯度稀释后涂布在PDA平板培养基上培养至出现单菌落。重复3次后的单菌落认为是纯化的菌株。根据透明圈直径大小进行初筛,通过初筛的菌株液体培养后测上清阿魏酸酯酶活进行复筛。
1.2.2 菌株的形态观察 按照《真菌鉴定手册》,将纯化的菌株在PDA培养基上培养7 d,观察菌落外观形态和菌丝生长情况;显微镜高倍镜下观察菌丝体和分生孢子的形态。
1.2.3 菌株的18S rDNA和ITS分子鉴定 将菌株斜面孢子接种于PDA液体培养基中,30℃培养72 h,过滤收集菌丝体,采用液氮研磨法[10]提取其染色体DNA。
待测菌株的18S rDNA基因是以染色体DNA为模板,在18S rDNA通用引物(EF3和EF4)的介导下,采用PCR进行扩增。通用引物的序列如下:
EF3:5'-TCCTCTAAATGGT-GACCAAGTTTG-3',
EF4:5'-GGAAGGG[G/A] TG-TATTTATTAG-3'。
PCR扩增程序:94℃ 5 min;94℃ 30 s,47℃ 30 s,72℃ 1 min 40 s,28个循环;72℃ 10 min。
待测菌株的ITS序列是在通用引物(ITS4和ITS86)的介导下,采用PCR进行扩增。通用引物的序列如下:
ITS4:5'-TCCTCCGCTTATTGATATGC-3',
ITS86:5'-GTGAATCATCGAATCTTTGAAC-3'。
PCR扩增程序除了退火温度为50℃外,其余步骤与18S rDNA的相同。
将18S rDNA和ITS PCR产物于0.8%琼脂糖凝胶中电泳检查扩增结果。按照DNA凝胶回收试剂盒说明书回收PCR产物,然后委托济南力戈生物公司直接进行测序。
1.2.4 序列同源性分析及系统发育树的构建 测序后将序列提交NCBI GenBank进行序列同源性分析,并利用Mega5.2软件[11]进行18S rDNA基因的系统发育树的构建。
1.2.5 阿魏酸酯酶粗酶液的制备及酶活测定 取1 mL发酵液于4℃,10 000 r/min离心10 min,上清液即为粗酶液。阿魏酸酯酶的酶活测定方法采用分光光度法[12]测定,将反应条件下,每分钟降解阿魏酸对硝基苯酚酯生成1 μmol对硝基苯酚所需的酶量定义为一个酶活力单位U。
1.2.6 温度和pH对阿魏酸酯酶粗酶液活性的影响
1.2.6.1 粗酶液最适温度及温度稳定性 分别在不同温度下(30-70℃)测定阿魏酸酯酶活性。以最高酶活为100%,计算其他温度下的相对酶活,绘制温度—相对酶活曲线。将粗酶液分别置于45、55和65℃保温60 min,测定残余酶活性,绘制不同温度下相对酶活—温育时间曲线。
1.2.6.2 粗酶液最适pH及pH稳定性 将粗酶液在不同pH(pH3.0-7.5)条件下测阿魏酸酯酶的活性。与温度类似,绘制相对酶活随pH变化的曲线。将粗酶液用不同pH值缓冲液(pH3.5-7.5的0.1 mol/L磷酸钠缓冲液)稀释,于35℃下保温1 h,测定残余酶活。以其中酶活性最高者为100%,其他pH值下与该酶活的比值为该pH值下的相对酶活,绘制相对酶活—pH曲线。
2 结果
2.1 产阿魏酸酯酶丝状真菌的筛选
利用平板透明圈法,从含有腐烂木质纤维的土壤中筛选分离到37株丝状真菌,其中1株透明圈直径较大,将其编号为HA4087,如图1。该菌株在发酵培养基中培养5 d后收集上清,测得发酵液上清中阿魏酸酯酶活性为86 mU/mL。
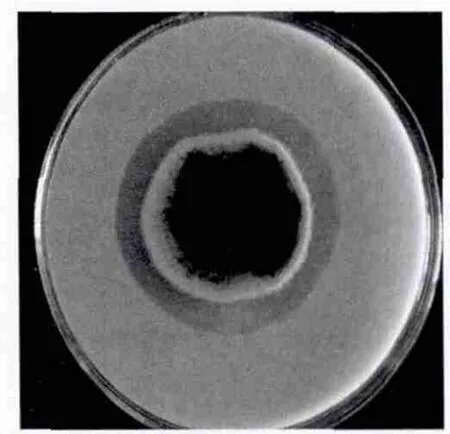
图1 菌株HA4087在筛选平板上形成的透明圈(背面)
2.2 产阿魏酸酯酶丝状真菌的鉴定
2.2.1 菌株形态结构观察 菌株HA4087生长迅速,菌丝蔓延速度快,在PDA培养基上28℃ 培养4 d后,即可铺满整个平板。生长初期菌丝为白色绒毛状,后期菌丝为灰黑色,菌落高耸突起,呈棉绒状。该菌在生长过程中向培养基中分泌色素,因此平板背面呈蓝黑色(图1)。对HA4087的菌丝体和分生孢子结构进行了显微观察,结果如图2所示。该菌株的菌丝透明,有隔膜。菌丝顶端形成分生孢子。分生孢子卵形,具有典型横隔膜,呈砖格状分隔(图2-B),根据分生孢子的形态特征初步认为该菌属于链格孢菌。

图2 菌株HA4087的菌丝和分生孢子形态(16×40)
2.2.2 菌株分子鉴定 对菌株HA4087分别进行18S rDNA和ITS序列的克隆,结果如图3所示。从图3中可以看出PCR产物扩增条带单一且明亮,产物大小与预期吻合,初步表明18S rDNA和ITS序列已经克隆得到。PCR产物回收后,进行序列测定,测序(结果省略)显示18S rDNA基因和ITS序列的PCR产物长度分别为1 561 bp 和783 bp。两个基因序列已经提交NCBI GenBank,编号分别为KF962959和KF962960。
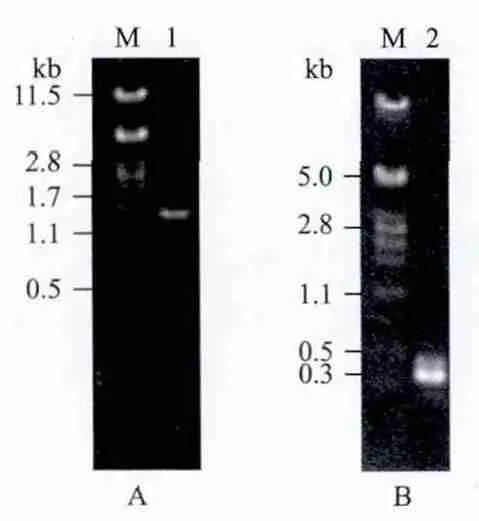
图3 菌株HA4087 18S rDNA(A)和ITS PCR(B)扩增电泳图
将克隆的18S rDNA基因序列输入 GenBank 进行BLAST分析,结果显示其与Alternariasp.的相似性最高,达100%,初步鉴定其为链格孢属。并与其他同源性高的菌株进行系统发育树的构建,结果如图4所示。HA4087 与Alternaria alternata的相似性达 99%,结合该菌的形态特征确定该菌属于链格孢属。
将克隆的ITS序列进行BLAST分析,结果显示其与A. alternata的相似性为100%。结合该菌的形态特征及18S rDNA序列,确定所分离的菌株为互隔交链格孢霉。
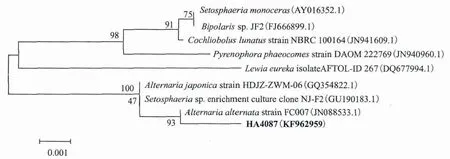
图4 菌株HA4087的18S rDNA基因序列系统发育树
2.3 粗酶的酶学性质
2.3.1 温度对酶活力和稳定性的影响 分别在30-70℃测定粗酶液的活力,结果见图5。结果显示,菌株HA4087阿魏酸酯酶最适反应温度为55℃,在50-60℃的范围内催化活性较高。将酶液在45-65℃之间保存一定时间,测定残余酶活,结果(图6)表明,温度为45℃时,该酶稳定,处理60 min后,剩余酶活仍能达到93.7%;当温度为55℃时,处理30 min后剩余酶活为90.1%,随着温育时间的延长,剩余酶活力下降较快;当温度达65℃时,保温10 min,剩余酶活力仅为16.8%。
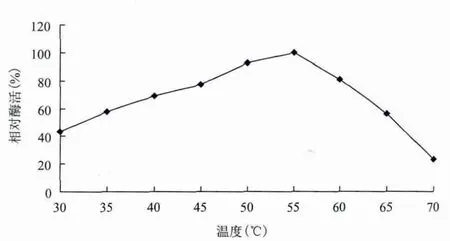
图5 温度对酶活力的影响
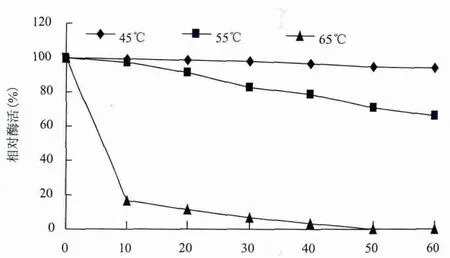
图6 温度对粗酶液稳定性的影响
2.3.2 pH值对酶活力和稳定性的影响 粗酶液在不同pH下测定酶活力,以pH作出相对酶活力曲线,结果(图7)表明,菌株HA4087阿魏酸酯酶的最适反应pH值为5.5。在pH5.0-7.0的范围内,酶活力保持较高水平(80%以上)。将酶液于pH3.5-7.5中温育60 min后测定剩余酶活力,结果(图8)表明,该酶在pH4.5-6.5的范围内稳定,残余酶活接近85%。
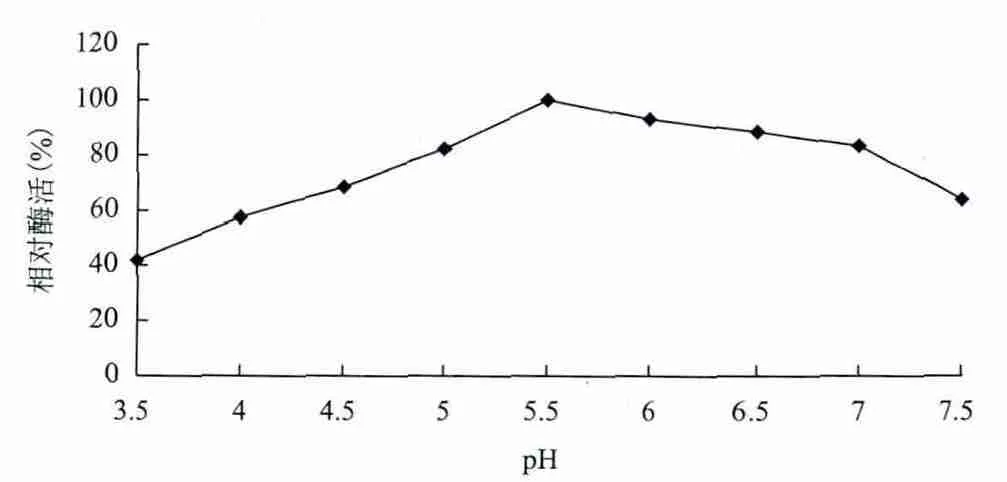
图7 pH值对酶活力的影响
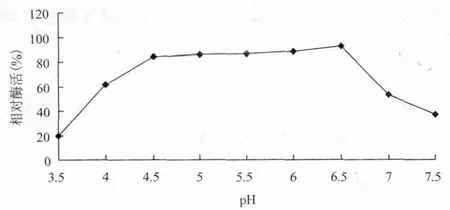
图8 pH值对酶稳定性的影响
2.4 互隔交链格孢霉阿魏酸酯酶与其他丝状真菌产酶性质的比较
本研究将互隔交链格孢霉的阿魏酸酯酶性质和黑曲霉、米曲霉、土曲霉和腐质霉所产生的酶进行了酶学性质的比较(表1)。表1显示,酶活高低次序是黑曲霉>腐质霉>互隔交链格孢霉>米曲霉和土曲霉。互隔交链格孢霉的活力为86 mU/mL,比土曲霉和米曲霉的活力稍高,具有较强的酶活力。测定的酶活和Xiao等[7]报道的酶活一致。后续通过对培养基组成和发酵条件的优化及对出发菌株诱变还能较大幅度提高酶的产量。酶的热稳定试验显示HA4087菌株产生的酶具有良好的热稳定性,当在55℃温育30 min仍能保留90%以上的酶活,该特性有助于在饲料工业中的应用开发。pH稳定性和其他来源的酶相比显得稍弱,后续可以通过定向进化来提高pH稳定性。

表1 不同菌株产生的阿魏酸酯酶A的性质比较
3 讨论
阿魏酸酯酶是半纤维水解酶系中关键的一员,属于辅助酶,能够协同木聚糖酶和纤维素酶更好水解相应的基质[16,17]。本研究分离得到1株高产阿魏酸酯酶的互隔交链孢霉HA4087,对该菌株所产阿魏酸酯酶的粗酶性质进行了初步研究。结果表明该菌株产生的阿魏酸酯酶活性较强,并具有良好的热稳定性。这些特征表明互隔交链格孢菌所产的阿魏酸酯酶具有重要的应用价值。对其阿魏酸酯酶酶学性质的测定将有助于该酶实际应用参数的确定和优化,尤其是对后续开展该菌阿魏酸酯酶的定向进化和高效分泌表达的研究提供了前提和参考。
对互隔交链格孢霉HA4087的阿魏酸酯酶和其他丝状真菌来源的酶进行了性质比较显示该酶具有较好的应用前景。不同丝状真菌产生的阿魏酸酯酶产量和酶学性质的不同可能是由目的基因转录强度、mRNA稳定性、分泌强弱、蛋白一级结构和翻译后糖基化修饰等造成[16,17]。令人疑惑的是,黑曲霉、黄曲霉和米曲霉的基因和蛋白序列的相似性达90%,但是酶活差异较大。此外,暗色孢属真菌产阿魏酸酯酶的产生与其在植物组织中的强烈的蔓延性具有一定的相关性,这可能也是该菌株产阿魏酸酯酶活高于其他常规丝状真菌的活性。因此对其阿魏酸酯酶的研究不仅能为阿魏酸酯酶家族增加新的试验材料,还能加深暗色真菌侵染植物机制的理解。
4 结论
本试验从含有腐烂木质纤维的土壤中筛选分离得到1株高产阿魏酸酯酶的丝状真菌HA4087,经传统形态学和分子生物学鉴定为互隔交链孢霉。该菌株所产阿魏酸酯酶活力为86 mU/mL,最适反应温度为55℃,最适pH值为5.5;在55℃保温30 min后酶活力仍为90%以上;在pH4.5-6.5范围内稳定性较好,酶活仍为85%以上。
[1] Williamson G, Kroon PA, Faulds CB. Hairy plant polysaccharides:a close shave with microbial esterases[J] . Microbiology, 1998,144:2011-2023.
[2] Wong DW. Feruloyl Esterase:a key enzyme in biomass degradation[J] . Applied Biochemistry and Biotechnology, 2006, 133:87-112.
[3] Benoit I, Danchin EGJ, et al. Biotechnological applications and potential of fungal feruloyl esterases based on prevalence,classification and biochemical diversity[J] . Biotechnol Lett, 2008,30:387-396.
[4] de Vries RP, Michelsen B, Poulsen CH, et al. The faeA genes fromAspergillus nigerandAspergillus tubingensisencode ferulic acid esterases involved in degradation of complex cell wall polysaccharides[J] . Appl Environ Microbiol, 1997, 63(12):4638-4644.
[5] 王洪川, 陈洪章.高产阿魏酸酯酶菌株的筛选及其固态发酵的研究[J] . 食品与发酵工业, 2007, 33(4):11-14.
[6] Ito K, Tanaka T, Hatta R, et al. Dissection of the host range of the fungal plant pathogenAlternaria alternataby modification of secondary metabolism[J] . Mol Microbiol, 2004, 52(2):399-411.
[7] Xiao Z, Bergeron H, Lau PC.Alternaria alternataas a new fungal enzyme system for the release of phenolic acids from wheat and triticale brans[J] . Antonie Van Leeuwenhoek, 2012, 101:837-844.
[8] Hegde S, Srinivas P, Muralikrishna G. Single-step synthesis of 4-nitrophenyl ferulate for spectrophotometric assay of feruloyl esterases[J] . Analytical Biochemistry, 2009, 387(1):128-129.
[9] 刘国生. 微生物实验技术[M] . 科学科学出版社, 2007, 10.
[10] Penttilä M, Nevalainen H, Rättö M, et al. A versatile transformation system for the cellulolytic filamentous fungusTrichoderma reesei[J] . Gene, 1987, 61:155-164.
[11] Tamura K, Peterson D, Peterson N, et al. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance, and maximum parsimony methods[J] .Molecular Biology and Evolution, 2011, 28:2731-2739.
[12] 刘元元, 徐泽平. 阿魏酸酯酶活性的分光光度法测定及影响因素研究[J] . 食品工业科技, 2013, 34(13):284-288.
[13] Faulds CB, Vries RP, Kroon PA, et al. Influence of ferulic acid on the production of feruloyl esterases byAspergillus niger[J] .FEMS Microbiol Lett, 1997, 57:239-244.
[14] TenkanenM, Schuseil J, Puls J, et al. Production, purification and characterisation of an esterase liberating phenolic acids from lignocellulosics[J] . J Biotechnol, 1991, 18:69-84.
[15] Mandalari G, Bisignano G, Lo Curto RB, et al. Production of feruloyl esterases and xylanases byTalaromyces stipitatusandHumicola griseavar. thermoidea on industrial food processing byproducts[J] . Bioresour Technol, 2008, 99(11):5130-5133.
[16] 陈静, 朱汇源, 侯运华, 等. 阿魏酸酯酶基因工程菌研究进展[J] . 生物技术通报, 2012(9):35-40.
[17] 胡雪松, 李夏兰. 阿魏酸酯酶基因克隆表达调控及其应用进展[J] . 生物技术通报, 2009(12):11-16.

