一株生物表面活性剂产生菌的分离及产剂性能研究
王睿 吴涓
(安徽大学资源与环境工程学院,合肥 230601)
生物表面活性剂(Biosurfactants,简称BS)是由酶或微生物等通过生物催化和生物合成等生物技术,由植物、动物或微生物产生的集亲水基和憎水基于一体的具有表面活性的代谢产物[1]。生物表面活性剂包括糖脂类、脂肽和脂蛋白、脂肪酸和磷脂类、高分子聚合物及微粒生物表面活性剂等不同种类。与化学合成表面活性剂相比,生物表面活性剂除具有降低表面张力、稳定乳化液和发泡功能外,还具有良好的热稳定性和化学稳定性;乳化和破乳能力强;无毒、用量少;与生态环境相容,能被微生物完全降解等优良性能。因此,生物表面活性剂在石油工业和环境工程中展示出独特的应用前景[2]。刘五星等[3]分离得到一株醋酸钙不动杆菌,该菌具有较强的乳化柴油的能力。有研究表明,用产生物表面活性剂菌株的菌液直接进行石油污泥洗脱处理,取得了很好的除油效果[4,5]。
目前国外主要在开发各类新型生物表面活性剂、寻找最适合成条件,表面活性剂结构的剖析与改性,以及室内驱油物理模拟等方面展开研究[6]。而国内研究起步较晚,重点则主要集中在生物表面活性剂产生菌的筛选和培养条件的优化等方面。张秋卓等[7]研究了铜绿假单胞菌产鼠李糖脂的适宜条件。张翠竹等[8]研究了地衣芽饱杆菌(Bacillus licheniformis)产脂肽类生物表面活性剂的最适条件。
研究生物表面活性剂产生菌的生长规律,探讨生物表面活性剂的特性及作用机理,对微生物采油技术的改进和完善以及原油的驱油降黏具有十分重要的理论和实际意义[9]。而目前国内外筛选出的生物表面活性剂产生菌种类还不是十分丰富,且高效菌比较少。本研究采用蓝色凝胶平板筛选法从某油田受污染的土样中分离出一株具有较强产生物表面活性剂能力的菌株,并对其进行分子生物学鉴定;同时对该菌株合成生物表面活性剂的条件进行优化,旨为今后的工业化应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源 华北某油田受污染的土样。
1.1.2 富集培养基(g/L) (NH4)2SO45.0,葡萄糖2.0,KCl 1.1,NaCl 1.1,FeSO40.028,KH2PO41.5,K2HPO41.5,MgSO40.5,酵母粉0.5。微量元素溶液5 mL,液体石蜡0.5 mL,蒸馏水1 000 mL。
1.1.3 蓝色凝胶培养基(g/L) 牛肉膏1.0,葡萄糖20.0,蛋白胨5.0,酵母粉0.2,C16H33N(CH3)3Br 0.2,C16H18ClN3S 0.005,琼脂20。蒸馏水1 000 mL。
1.1.4 发酵培养基(g/L) 葡萄糖2.0,(NH4)2SO45.0,KCl 1.1,NaCl 1.1,FeSO40.028,KH2PO41.5,K2HPO41.5,MgSO40.5,酵母粉0.5。液体石蜡0.5 mL,微量元素溶液5 mL。
1.2 生物表面活性剂产生菌的筛选与鉴定
1.2.1 筛选 称取样品10 g,加入90 mL 无菌水,150 r/min摇床振荡1 h,静置30 min后取上清液10 mL接种到100 mL已灭菌的富集培养集中,于35℃、150 r/min 的恒温摇床上振荡培养3 d。在同样条件下进行二次培养。取二次富集培养的培养液1 mL,用无菌水进行梯度稀释,取不同浓度梯度的富集培养液,均匀涂布在蓝色凝胶培养基上,于35℃下恒温培养3 d。挑选蓝色凝胶平板上蓝色晕圈较大的菌落,进一步纯化,得到初筛菌株[10-12]。将初筛菌株接种至发酵培养基中,于35℃、150 r/min 条件下培养3 d。测定发酵液的表面张力,筛选出产生物表面活性剂的优势菌种。
1.2.2 表面张力的测定方法 将发酵液过滤除油,12 000 r/min离心20 min,取上清液,采用JZHY 1-180型界面张力仪测定其表面张力。
1.2.3 菌株的生理生化性质测定 参照《简明第八版伯杰细菌鉴定手册》、《常见细菌系统鉴定手册》对菌株H1进行生理生化性质的测定。采用 DNA 快速提取试剂盒提取降解菌的DNA,对提取的DNA进行16S rDNA的PCR 扩增,引物为通用引物:正向引物F27(+)5'-AGTTTGATCMTGGCTCAG-3',反向引物 R1492(-)5'-GGTTACCTTGTTACGACTT-3'。将PCR扩增产物进行1%的琼脂糖凝胶电泳后,由上海生物工程技术服务有限公司进行 16S rRNA测序,将所测序列在GenBank核酸序列数据库中与已有的其他 16S rRNA 序列数据进行同源性分析,并构建系统发育树。
1.2.4 发酵条件的优化 在发酵液表面张力为指标,以发酵培养基为基础,分别考察碳氮源种类、碳氮源浓度、初始pH值及温度对生物表面活性剂合成的影响。
2 结果
2.1 生物表面活性剂产生菌的筛选鉴定
从华北某油田受污染的土样中分离得到1株产生物表面活性剂的能力较强的菌株H1。由图1可见,有蓝色晕圈的单菌落即为目标菌株,其菌落特征是:扁平、圆形、表面光滑。该菌株为革兰氏阳性菌。该菌株的生理生化特征,见表1。

图1 菌落形态

表1 菌株H1的生理生化特性
经PCR扩增后,菌株H1的16S rDNA片段长约1 440 bp,经BLAST比对后发现该菌株与Klebsiella pneumoniae同源性为99%。使用MEGA5软件构建系统发育树,结果如图2所示。结合形态学特征、生理生化特征和BLAST不比对分析,菌株H1可鉴定为肺炎克雷伯氏菌。

图2 菌株H1的16S rDNA系统发育树
2.2 产剂性能研究
2.2.1 碳源对生物表面活性剂合成的影响 碳源提供细胞生长繁殖所需要的能量,为细胞和代谢产物提供物质基础。试验以发酵培养基为基础,分别以葡萄糖、蔗糖、果糖、麦芽糖、淀粉、正十二烷为碳源,在30℃,150 r/min条件下发酵培养,分别测定培养液的OD值和表面张力。由图3可见,当碳源为水溶性碳源时,细胞生长良好,除蔗糖外,其他几种碳源对细胞的生长及发酵液表面张力的影响大体相同。而采用正十二烷为碳源时,OD值很低,且培养液表面张力也很大。而以蔗糖为碳源时,细胞生长良好,且培养液的表面张力最小,应为最适碳源。
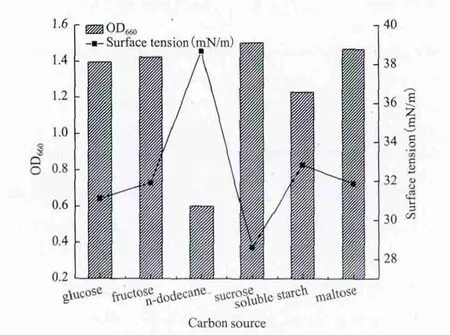
图3 碳源种类对菌株H1培养液表面张力的影响
以蔗糖为唯一碳源,其他条件不变,考察不同蔗糖浓度对菌株H1合成生物表面活性剂的影响。由图4可见,当蔗糖浓度从0 g/L逐渐增大到4 g/L时,发酵液的表面张力逐渐降低,且在蔗糖浓度为4 g/L时其表面张力值最低。由此表明,蔗糖浓度过高对生物表面活性剂的合成起到了抑制作用。

图4 蔗糖浓度对菌株H1培养液表面张力的影响
2.2.2 氮源对生物表面活性剂合成的影响 氮源是细胞生长过程中蛋白质和核酸等生物大分子中氮元素的来源,对微生物的生长发育和生物表面活性剂的合成起重要作用。试验以发酵培养基为基础,以蔗糖为碳源,分别以尿素、硝酸铵、蛋白胨、硫酸铵、硝酸钠为氮源,于30℃,150 r/min下恒温振荡培养,分别测定培养液的OD值和表面张力。由图5可见,采用硝酸铵做氮源时,细胞生长良好,仅次于蛋白胨,培养液的表面张力是最低的,而其他氮源均不利于生物表面活性剂的合成。由此可见,蛋白胨虽然由于营养较为丰富,能促进细胞的生长,但对生物表面活性剂的合成来说它并不是最适氮源,最适氮源为硝酸铵。

图5 氮源种类对菌株H1培养液表面张力的影响
以硝酸铵为唯一氮源,考察不同硝酸铵浓度对菌株H1合成生物表面活性剂的影响。由图6可知,当硝酸铵浓度逐渐增大时,发酵液的表面张力值呈先减小后增大的趋势,并且在硝酸铵浓度为3 g/L时其表面张力值最低,硝酸铵浓度大于3 g/L时,发酵液表面张力值值反而增大,因此应将硝酸铵浓度选择为3 g/L。
2.2.3 pH值对生物表面活性剂合成的影响 微生物在过酸和过碱的条件下生长状况都不佳。以发酵培养基为基础,以蔗糖为碳源,以硝酸铵为氮源,将菌株H1接种于不同初始pH值的培养基中,30℃,150 r/min下恒温振荡培养,所测定的培养液OD值及表面张力值,如图7所示。不同pH值条件下的培养液的表面张力值不同,当培养液pH值从6.0增大至7.0时,其表面张力值略有下降;当培养液pH值为7.0时,其表面张力值最低;而当pH值大于7.0时,培养液的表面张力值显著增大,并且细胞的生长也并非最佳状态。因此,控制培养基pH值在7.0将有利于生物表面活性剂的合成。

图6 硝酸铵浓度对生物表面活性剂表面张力的影响
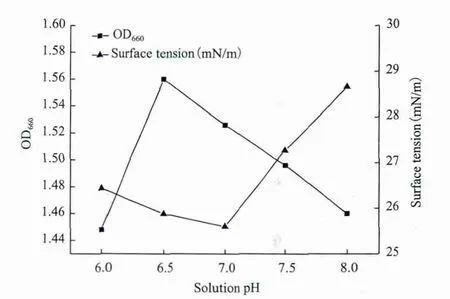
图7 pH值对菌株H1培养液表面张力的影响
2.2.4 温度对生物表面活性剂合成的影响 温度也是影响微生物产表面活性剂的重要影响因素之一,微生物的生长和生物表面活性剂的合成是在各种酶催化下进行的,而温度是保证酶活的首要条件。以蔗糖为碳源,以硝酸铵为氮源,将菌株H1接种于pH7.0的发酵培养基中,分别于20℃、30℃、35℃、40℃、50℃下150 r/min振荡培养。图8表明,当温度从20℃升高到40℃时OD值缓慢下降,其后当温度升高到50℃时,OD值急剧下降,可见高温不利于该微生物的生长代谢。而随着温度升高,培养液的表面张力值则表现出先减小后增大的趋势,当温度为30℃时表面张力值最低,此后表面张力值显著增大。显然,30℃的培养温度有利于生物表面活性剂的合成。

图8 培养温度对菌株H1培养液表面张力的影响
3 讨论
生物表面活性剂由于其良好的表面活性及环境良好性,受到广泛关注。迄今为止,国内外已筛选出一些能够产生生物表面活性剂的纯菌株,但种类不多,目前报道能够产生生物表面活性剂的菌属有假单胞菌属、红球菌属和芽孢杆菌属等。本研究从华北某油田受污染的土样中筛选到一株产生物表面活性剂的菌株H1,经16S rDNA分析鉴定为肺炎克雷伯氏菌(Klebsiella pneumoniae)。菌株H1能使培养液表面张力降低60%以上,表明该菌株具有较强的产生物表面活性剂的能力。
在筛选生物表面活性剂产生菌时,通常是采用溶血圈法[13],但溶血圈不规则,而且血液成分较复杂,其中一些成分或杂菌也会产生类似的溶血圈,给筛选带来干扰。本研究在筛选时利用蓝色凝胶培养基,微生物合成的表面活性剂能够在不易染菌的蓝色凝胶培养基上产生深蓝色晕圈,更容易观察判断,也使得筛选结果更具准确性。
目前,生物表面活性剂主要通过微生物发酵法合成,其种类和产量取决于产生菌的种类和培养条件。虽然生物表面活性剂具有生物可降解性、更强的表/界面活性和热稳定性,但其产量低、成本高,使其推广应用受到限制。本研究考察了碳氮源种类、碳氮源浓度、初始pH值、温度等因素对菌株H1生长和合成生物表面活性剂能力的影响,旨在寻求该生物表面活性剂的最适合成条件。碳源为细胞和代谢产物中的碳提供来源,并供给微生物生长发育所需要的能量;氮源是合成原生质和细胞其它结构的原料,对微生物的生长发育和稳定生长起重要作用[14]。在本试验中最适碳源为蔗糖,最适氮源为硝酸铵。在所考察的因素中,环境pH值和培养温度对生物表面活性剂的合成也非常重要。一般认为初始pH值控制在6.5-8.5范围内有利于生物表面活性剂的合成[15]。本试验中合成生物表面活性剂的最适pH值是7.0。高小朋等[16]从受石油污染的土壤中筛选得到1株生物表面活性剂产生菌CT-6,优化试验表明该菌产表面活性剂的最适pH值是8.0。介质pH会影响细胞膜电荷的变化,从而影响微生物对营养物质的吸收,进而影响微生物的生长。在过高或过低的pH条件下,微生物生长状态不佳,就会影响到表面活性剂的合成,因为表面活性剂是次生代谢产物。培养温度对于微生物的生长和发酵产物的合成影响也较大,适宜的温度不仅有利于细胞的生长,也利于发酵产物的积累[17]。但不同的菌种产表面活性剂时对温度的要求不一样。本试验所筛菌株产表面活性剂的最适温度是30℃,而刘畅等[18]从自然腐烂的秸秆中筛选到1株表面活性剂产生菌B-17,该菌产表面活性剂的最适温度是20℃。
本研究通过对生物表面活性剂产生菌的筛选、鉴定,以及影响生物表面活性剂合成的因素的研究,为生物表面活性剂的合成提供了新的菌源,也为提高生物表面活性剂的合成能力提供了科学依据,从而为新型表面活性剂的开发和应用奠定了基础。
4 结论
本研究采用蓝色凝胶平板筛选法,从华北某油田受污染的土壤中筛选到一株产生物表面活性剂的菌株H1,经16S rDNA分析鉴定为肺炎克雷伯氏菌(Klebsiella pneumoniae)。该菌株能使培养液表面张力降低60%以上。同时考察了碳氮源种类、初始pH值、温度等因素对菌株H1生长和合成生物表面活性剂能力的影响,结果表明,其最适碳源为蔗糖,最适氮源为硝酸铵,且初始pH值为7.0,培养温度为30℃对该生物表面活性剂的合成是最有利的。
[1] Youssef NH, Duncan KE, Nagle DP, et al. Comparison of methods to detect biosurfactant production by diverse microorgaisms[J] .Journal of Microbiological Methods, 2004, 56(3):339-347.
[2] 赵国文, 张丽萍, 白利涛. 生物表面活性剂及其应用[J] . 日用化学工业, 2010, 40(4):293-295.
[3] 刘五星, 骆永明, 滕应, 等.石油污染土壤的生态风险评价和生物修复 I.一株具有乳化石油能力的细菌分离鉴定[J] .土壤学报, 2006, 43(3):461-466.
[4] 陈忠喜, 郭书海, 刘广民, 等.除油生物表面活性剂产生菌的分离及其特性[J] .哈尔滨工业大学学报, 2007, 39(4):586-588.
[5] 牛明芬, 李凤梅, 韩晓日, 等. 生物表面活性剂产生菌筛选及表面活性剂稳定性研究[J] . 生态学杂志, 2005, 24(6):631-634.
[6] Pornsunthorntawee O, Wongpanit P, Chavadej S, et al. Structural and Physicoehemical charaeterization of crude biosurfactant produced byPseudomonas aerugjnosaSP4 isolated from petroleum eontaminated soil[J] . Bioresource Technology, 2008, 99(6):1589-1595.
[7] 张秋卓, 蔡伟民. 生物表面活性剂产生菌的筛选及产剂性能研究[J] . 环境科学与技术, 2008, 31(11):38-40.
[8] 张翠竹, 梁凤来, 张心平, 等.一种脂肽类生物表面活性剂的理化性质及其对原油的作用[J] .油田化学, 2000, 17(2):172-176.
[9] 邓勇, 易绍金.稠油微生物开采技术现状及进展[J] .油田化学,2006, 23(3):289-292.
[10] 宁长发, 沈薇, 孟广荣, 等.产生生物表面活性剂菌种的一种快速筛选模型[J] .微生物学通报, 2004, 31(3):55-58.
[11] 沈薇, 杨树林, 宁长发, 等.蓝色凝胶平板法筛选生物表面活性剂产生菌[J] .南京理工大学学 报, 2005, 29(4):486-490.
[12] Arino S, Marehal R, Vandeeasteele JP. Identifieation and production of a rhamnolipic biosurfactant by aPseudomonasspecies[J] .Appl Microbiol Biotechnol, 1996, 45(2):162-168.
[13] 孙燕, 洪青, 李顺鹏. 一株生物表面活性剂产生菌的分离及其特性研究[J] . 微生物学通报, 2009, 36(8):1110-1116.
[14] 包木太, 赵东维, 陆金仁, 等. 芽孢杆菌Lz-2在碱性环境下产糖脂类表面活性剂的研究及增溶作用初b探[J] . 中国海洋大学学报, 2013, 43(10):76-82.
[15] Youssef NH, Duncan KE, Nagle DR, et al. Comparison of methods to detect biosurfactant production by diverse micro-organisms[J] .Jounal of Microbiological Methods, 2004, 56(3):339-347.
[16] 高小朋, 姜钊, 高秀梅, 等. 石油降解菌产表面活性剂的条件优化[J] . 环境工程学报, 2013, 7(8):3244-3248.
[17] 刘程, 米裕民.表面活性剂性质理论与应用[M] .北京:化学工业出版社, 2003:45-52.
[18] 刘畅, 赵伟, 刘涛, 等. 一株产表面活性剂低温细菌的筛选与鉴定[J] . 生态学杂志, 2013, 32(4):1075-1082.

