解脂耶氏酵母诱变育种及发酵产α-酮戊二酸条件优化
巩健
(1. 淄博职业学院制药与生物工程系,淄博 255314;2. 山东省曲霉应用工程技术研究中心,淄博 255314)
α-酮戊二酸是一种重要的有机酸,在代谢中起着重要的作用,是三羧酸循环的重要中间产物之一,也是合成多种氨基酸、蛋白质的前体物质[1]。作为营养强化剂,能有效降低术后患者和病人的机体损耗,在脑部可以作为酪氨酸和谷氨酸的前体,且能够用于治疗黄褐斑,清除自由基、延缓衰老[2],在医药[3]、食品[4]、化工和化妆品行业有广泛的应用。随着对α-酮戊二酸应用价值的研究加深,市场对于其需求量在不断增大。但是由于传统的化学法合成α-酮戊二酸过程复杂,且在原料来源和生产过程中存在严重的安全问题,无法直接用于食品和药品中[5]。因此,微生物发酵法生产α-酮戊二酸逐渐成为新的研究方向。解脂耶氏酵母(Yarrowia lipolytica)具有过量合成α-酮戊二酸的能力,并被美国食品药品管理局认为是安全的生产微生物,因此逐渐成为国内外发酵法生产α-酮戊二酸的研究热点[6]。尤其是近年来,江南大学的陈坚教授及其研究团队在发酵产α-酮戊二酸的研究取得了重大的突破。2010年,在炼油厂附近的土壤中筛选出一株硫胺素营养缺陷型的解脂耶氏酵母(Yarrowia lipolytica)WSH-Z06,保藏编号CCTCC NO:M207143,该菌株在以甘油为碳源发酵条件下能够产生39.2 g/L的α-酮戊二酸[7]。随后,通过采用在该菌株内过量表达丙酮酸羧化酶(Pyruvate carboxylase)的方法,改变碳代谢流,降低了副产物丙酮酸,同时提高了α-酮戊二酸的产量[8]。另外,又通过发酵条件的控制优化,补加甘油和碳酸钙,实现了66.2 g/L的α-酮戊二酸高产量[9]。
获得具有优良生产性能的菌种,是发酵工业的核心资源。而诱变育种是进行菌种选育的重要方法,发酵工业中正在使用的绝大部分高产优良菌株都是采用诱变育种得到的。然而到目前为止,对于具有发酵产α-酮戊二酸能力的解脂耶氏酵母(Yarrowia lipolytica)诱变育种工作仍未见报道。因此,本研究以实验室的一株解脂耶氏酵母ZY-4作为出发菌株,通过紫外线诱变和NTG化学诱变方法,筛选得到α-酮戊二酸产量提高的突变株,并对突变株的发酵培养基成分进行优化。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基 解脂耶氏酵母(Yarrowia lipolytica)硫胺素营养缺陷型菌株ZY-4,本实验室保存。
种子培养基:酵母膏 10 g/L,蛋白胨 20 g/L,葡萄糖 20 g/L,若制固体培养基,加入20 g/L琼脂粉。
初筛培养基:葡萄糖 20 g/L,磷酸二氢钾1.0 g/L,七水硫酸镁 0.5 g/L,氯化铵 3.0 g/L,青霉素 0.05 g/L,制霉菌素 0.08 g/L, 硫胺素 10 μg/L,溴甲酚绿 1.0 g/L,琼脂 20 g/L。
发酵培养基:葡萄糖 100 g/L,磷酸二氢钾 1.0 g/L,七水硫酸镁 0.5 g/L,氯化铵 3.0 g/L,硫胺素5.0 μg/L。
1.1.2 仪器与设备 BS-1E型振荡培养箱,SWCJ-2D型超净工作台,TU-I901型紫外可见分光光度计,LDZX-50KBS型立式压力蒸汽灭菌锅,HC-3018R型高速冷冻离心机,SHIMADZU LC-2010AHT型高效液相色谱。
1.2 方法
1.2.1 紫外线诱变处理 挑取一环保藏的Yarrowia lipolyticaZY-4接种至种子培养基,在30℃ 条件下200 r/min的恒温摇床上培养48 h,进行种子的活化。再以5%的接种量转接后,每隔2 h测定菌液OD600值。取对数生长期菌液,4 500 r/min离心10 min收集菌体,并用生理盐水洗涤两次,取5 mL菌悬液(105CFU/mL)加入直径9 cm的无菌培养皿中,开启15 W紫外灯预热30 min后距离30 cm进行紫外照射,照射时间分别为10 s、20 s、30 s、40 s、50 s、60 s、70 s。在红灯下,取照射后的菌液,用生理盐水梯度稀释后涂布种子培养基固体平板,同时以未照射的菌液为对照,置30℃避光培养48 h后,计算致死率。1.2.2 NTG诱变处理 将经过紫外诱变筛选出的突变株培养到对数期,收集菌体并用pH6.0磷酸缓冲液洗涤两次,取一定量的菌悬液(105CFU/mL),加入亚硝基胍溶液,使其终浓度为0.2、0.4、0.6、0.8以及1.0 mg/mL,30℃下振荡培养20 min后,4 500 r/min离心10 min终止反应,用pH6.0磷酸缓冲液洗涤3次并制成合适的稀释度涂布种子培养基固体平板,30℃恒温培养48 h后,计算致死率。
1.2.3 突变菌株筛选 初筛:诱变后的菌液经适当稀释后,涂布于初筛培养基固体平板,30℃恒温培养后,产α-酮戊二酸菌落周围形成黄色变色圈,挑选生长旺盛、产酸快且变色圈与菌落直径之比较大者作为初筛菌株。
复筛:挑取初筛产量较高的菌落,转接至发酵培养基,30℃条件下200 r/min摇床恒温培养3-5 d,每个菌落做3次平行,用HPLC测定发酵液中的α-酮戊二酸含量。
1.2.4 发酵培养基优化 碳源优化:将筛选到的突变株培养到对数生长中期,以5%的接种量分别接种至含有不同浓度葡萄糖(100、130、160及200 g/L)和甘油(2%、5%、8%、10%)为碳源的摇瓶,摇瓶中其他培养基成分与发酵培养基相同。
氮源浓度优化:以甘油浓度8%为碳源,氯化铵浓度分别为(1.0、3.0、5.0、7.0 及10 g/L),其他成分与发酵培养基相同。
硫胺素浓度优化:以甘油浓度8%为碳源,5.0 g/L氯化铵为氮源,硫胺素浓度分别为(1.0、3.0、5.0、7.0及9.0 μg/L),其他成分与发酵培养基相同。
发酵条件:30℃条件下200 r/min摇床恒温培养3-5 d,期间根据pH变化流加CaCO3。
1.2.5 分析方法 将待测发酵液于10 000 r/min条件下离心5 min后,取上清液进行分析检测。葡萄糖的测定使用3,5-二硝基水杨酸法[10]。甘油的测定使用改进的滴定法[11]。α-酮戊二酸的测定采用高效液相色谱法(HPLC)[12]。
2 结果
2.1 紫外线诱变
2.1.1 诱变时间的确定 将解脂耶氏酵母Yarrowia lipolyticaZY-4分别紫外线照射10 s、20 s、30 s、40 s、50 s、60 s、70 s后,30℃避光培养48 h计算致死率,结果如图1所示。

图1 解脂耶氏酵母Yarrowia lipolytica ZY-4紫外线诱变致死率
由图1可知,紫外线对解脂耶氏酵母Yarrowia lipolyticaZY-4的致死效果在前20 s内不明显,20 s时仅达到 37.79%。30 s后致死率随照射时间的延长而显著增加,在50 s时达到91.29%,在60 s和70 s时紫外线的致死率分别为96.28% 和99.06%,致死效果十分明显。本试验紫外线对解脂耶氏酵母Yarrowia lipolyticaZY-4菌悬液照射40 s时致死率为76.38%,易于发生提高产量的正向突变,因此,紫外线诱变的照射时间确定为40 s。
2.1.2 突变菌株筛选 紫外诱变菌株初筛:解脂耶氏酵母Yarrowia lipolyticaZY-4菌悬液经过紫外照射40 s后,稀释并涂布于初筛平板培养,经过观察挑选出7株生长较快且变色圈与菌落直径之比较大的突变菌株,进行复筛试验。
紫外诱变菌株复筛:对初筛得到的7株突变株分别进行摇瓶发酵试验,通过HPLC测定发酵液中α-酮戊二酸产量,结果见表1。由表1可知,突变株7号的α-酮戊二酸产量较高,达到了18.1g/L,比原始出发菌株产量提高了67.8%。

表1 紫外诱变菌株摇瓶发酵α-酮戊二酸产量
2.2 NTG诱变
2.2.1 诱变剂量的确定 为了进一步提高菌株的α-酮戊二酸产量,同时减少单一诱变剂产生的疲劳效应,对经过紫外诱变选育得到的突变株7号又进行了NTG诱变。加入亚硝基胍浓度分别为 0.2、0.4、0.6、0.8及1.0 mg/mL,30℃条件下诱变20 min,去除诱变剂并培养48 h后计算致死率,结果如图2所示。
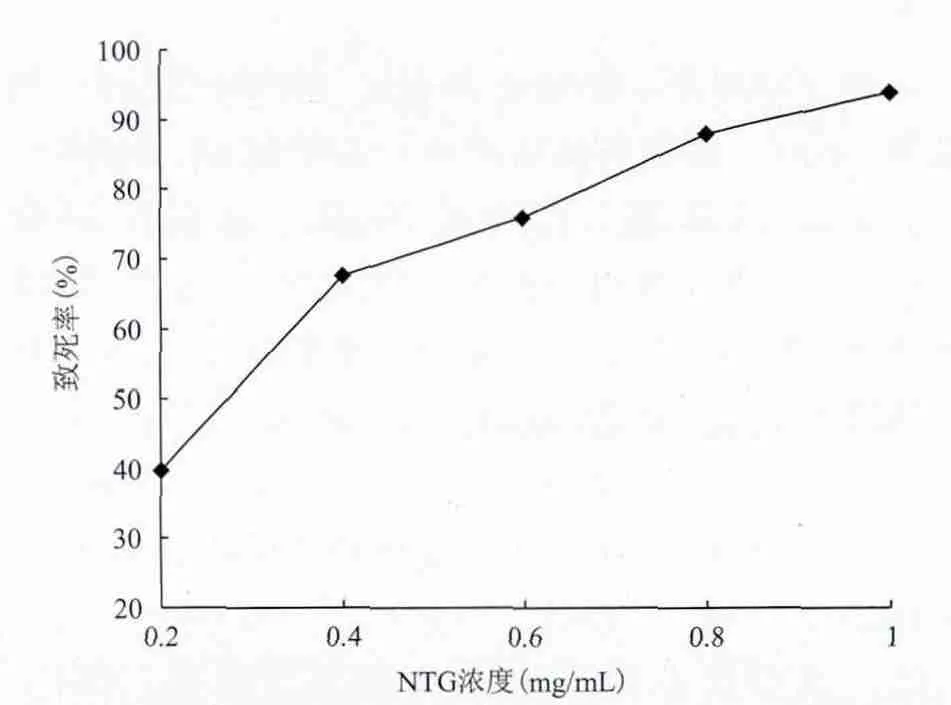
图2 解脂耶氏酵母ZY-4紫外线诱变突变株7号经亚硝基胍诱变致死率
由图2可知,在亚硝基胍诱变过程中,随着诱变剂量的增大,解脂耶氏酵母的死亡率明显提高,NTG浓度为0.4 mg/mL时就达到67.48%,诱变剂量为1.0 mg/mL时致死率达到了93.77%。为了提高筛选效率,本研究采用1.0 mg/mL作为诱变剂NTG的最终浓度。
2.2.2 突变菌株筛选 NTG诱变菌株初筛:经过紫外诱变后的突变株7号菌悬液使用浓度为1.0 mg/mL的NTG处理20 min,去除诱变剂后,稀释并涂布于初筛平板培养,经过观察挑选出4株变色圈与菌落直径之比较大的突变菌株,进行复筛试验。
NTG诱变菌株复筛:对初筛得到的4株突变株分别进行摇瓶发酵试验,通过HPLC测定发酵液中α-酮戊二酸产量,结果见表2。由表2可知,经过亚硝基胍诱变育种后得到的4株突变株α-酮戊二酸产量均有提高,其中突 变株2号的α-酮戊二酸产量较高,达到了22.7g/L,比经过紫外诱变得到的7号突变株产量提高了25.4%,比原始出发菌株ZY-4产量提高了110%。将经过亚硝基胍诱变育种后得到的2号菌株,命名为解脂耶氏酵母YB-2。
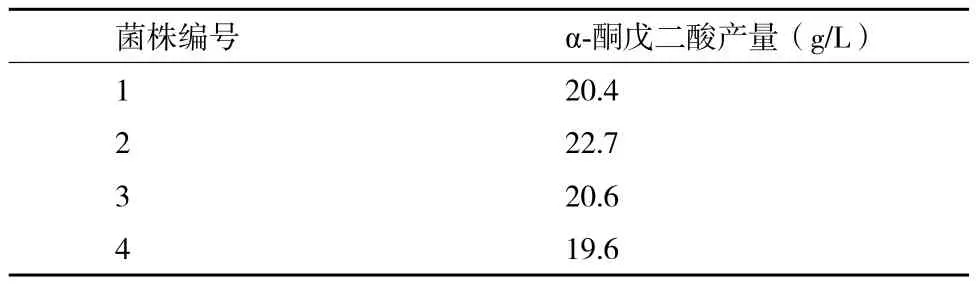
表2 NTG诱变菌株摇瓶发酵α-酮戊二酸产量
2.3 发酵培养基优化
2.3.1 碳源优化结果 分别以不同浓度葡萄糖(100、130、160以及200 g/L)和甘油(2%、5%、8%、10%)为碳源进行摇瓶发酵,比较不同碳源对解脂耶氏酵母突变株YB-2的α-酮戊二酸产量影响,结果如图3所示。
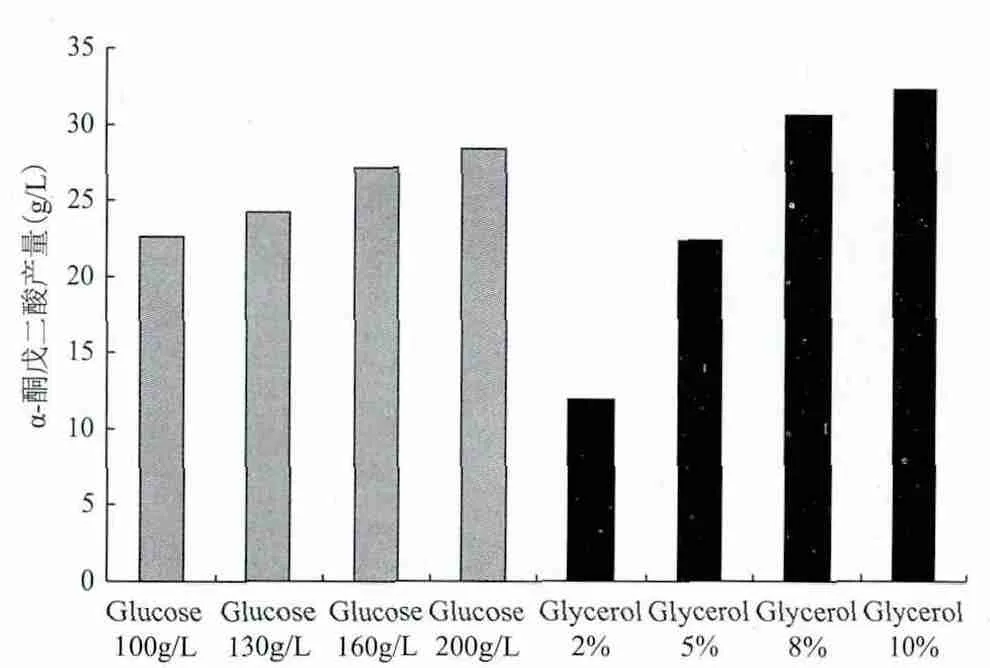
图3 碳源对解脂耶氏酵母突变株YB-2的α-酮戊二酸产量影响
由图3可知,不同浓度的葡萄糖和甘油作为碳源对解脂耶氏酵母的α-酮戊二酸产量均有影响。其中,以葡萄糖作为碳源时,葡萄糖浓度的增大对发酵液中α-酮戊二酸的积累影响较小。培养基中葡萄糖浓度由100 g/L增大一倍至200 g/L时,α-酮戊二酸的产量仅由22.6 g/L提高至28.4 g/L,提高了25.7%。相比之下使用甘油作为碳源,发酵液中积累的α-酮戊二酸随着甘油浓度的增大变化明显。当甘油浓度为2%时,α-酮戊二酸产量为11.9 g/L。甘油浓度增大至5%和8%时,α-酮戊二酸产量分别达到22.4 g/L和30.6 g/L。继续增大甘油浓度至10%,虽然α-酮戊二酸产量提高到32.3 g/L,但解脂耶氏酵母生长较慢,发酵周期延长。因此,本试验最终确定使用8%浓度的甘油作为培养基碳源。
2.3.2 氮源优化结果 α-酮戊二酸位于细胞碳—氮代谢的关键节点,培养基中氮源浓度会对α-酮戊二酸的积累产生影响。以8%浓度的甘油作为碳源,分别以不同浓度氯化铵(1.0、3.0、5.0、7.0 及10 g/L)为氮源进行摇瓶发酵,得到的α-酮戊二酸产量结果如图4所示。

图4 氮源氯化铵浓度对解脂耶氏酵母突变株YB-2的α-酮戊二酸产量影响
由图4可知,培养基中过低(1.0 g/L)或过高(10 g/L)的NH4Cl均不利于α-酮戊二酸的积累,氮源的添加最佳浓度为5.0 g/L。当低于5.0 g/L时,α-酮戊二酸浓度随培养基中NH4Cl浓度的增加而不断增加,当NH4Cl浓度为5.0 g/L时,α-酮戊二酸浓度达到最大值(32.9 g/L)。但继续增加NH4Cl浓度并不能继续提高产生的α-酮戊二酸浓度,当NH4Cl浓度高于5.0 g/L时,产生的α-酮戊二酸反而减少。
2.3.3 硫胺素优化结果 由于解脂耶氏酵母突变株YB-2仍然是硫胺素营 养缺陷型,硫胺素作为限制性因素对α-酮戊二酸的积累有较大影响。以8%浓度的甘油作为碳源,5.0 g/L NH4Cl为氮源,比较不同硫胺素浓度(1.0、3.0、5.0、7.0及9.0 μg/L)条件下α-酮戊二酸产量影响,结果如图5所示。

图5 硫胺素浓度对解脂耶氏酵母突变株YB-2的α-酮戊二酸产量影响
由图5可知,硫胺素浓度为1.0 μg/L时最有利于α-酮戊二酸的积累。随着硫胺素浓度的增加,α-酮戊二酸的积累量逐渐减少。硫胺素浓度为1.0 μg/L时,能够积累35.9 g/L的α-酮戊二酸,而当培养基中添加的硫胺素浓度达到9.0 μg/L时,产生的α-酮戊二酸为30.5 g/L,仅是添加1.0 μg/L硫胺素时的85%。
3 讨论
多年来,大量的研究者从许多方面对微生物发酵法生产α-酮戊二酸进行了探索,例如,优化培养基成分、优化发酵条件、控制辅因子浓度,或者通过分子生物学方法过量表达参与代谢的酶等方法,尝试提高发酵法合成α-酮戊二酸的产量[5]。这些方法从根本上来说分为两类,一类是优化发酵条件,另一类是选育具有更好生产性能的微生物菌种。菌种选育的方法主要是自然选育、诱变选育、原生质体融合以及基因工程育种等方法。本研究采用了紫外线以及亚硝基胍诱变选育的方法,获得了α-酮戊二酸的产量提高的解脂耶氏酵母YB-2,这是目前首次成功对产α-酮戊二酸的解脂耶氏酵母进行诱变育种的报道。
本研究进而对突变株YB-2的发酵培养基进行了初步优化。使用甘油为碳源能够得到比使用葡萄糖为碳源更高的α-酮戊二酸产量,最佳碳源确定为8%浓度的甘油,继续提高甘油浓度会使得突变株YB-2生长速度减慢,积累α-酮戊二酸的时间延后。氮源NH4Cl浓度为5.0 g/L时最有利于α-酮戊二酸的的积累,这可能是由于当NH4Cl浓度较低时,氮源成为解脂耶氏酵母生长代谢的限制性因素,此时增加氮源可以提高α-酮戊二酸的产量。但当NH4Cl浓度较高时,过量的NH4+被用来进行氨基酸合成,因此TCA循环中间代谢产物α-酮戊二酸被用来进行谷氨酸合成代谢,从而降低了α-酮戊二酸的产量。较低的硫胺素浓度有利于α-酮戊二酸的积累,由于培养基中硫胺素浓度较低时,以硫胺素为辅因子的α-酮戊二酸脱氢酶KGDH和丙酮酸脱氢酶PDH活力大幅下降[1],甘油经过代谢后只能被氧化为丙酮酸和α-酮戊二酸,从而实现积累。
4 结论
(1)对解脂耶氏酵母进行了紫外诱变选育,筛选到α-酮戊二酸产量提高的正突变株,达到了18.1 g/L,比原始出发菌株ZY-4产量提高了67.8%。
(2)对紫外诱变获得的突变株又进行了亚硝基胍诱变育种,并筛选到产量继续提高的突变株YB-2,α-酮戊二酸产量达到了22.7 g/L,比原始出发菌株ZY-4产量提高了110%。
(3)优化了突变株YB-2的培养基成分,优化后的培养基碳源使用8%的甘油,5.0 g/L NH4Cl为氮源,硫胺素浓度为1.0 μg/L,上述条件最有利于α-酮戊二酸的积累,优化后α-酮戊二酸比原始出发菌株ZY-4产量提高了232.4%。
[1] 郭洪伟, 堵国成, 周景文, 陈坚. 微生物发酵生产α-酮戊二酸研究进展[J] . 生物工程学报, 2013(2):141-152.
[2] 许晓鹏, 刘立明, 陈坚. 营养条件对光滑球拟酵母积累α-酮戊二酸的影响[J] . 工业微生物, 2009(6):6-10.
[3] Matzi V, Lindenmann J, Muench A, et al. The impact of preoperative micronutrient supplementation in lung surgery. A prospective randomized trial of oral supplementation of combined α-ketoglutaric acid and 5-hydroxymethylfurfural[J] . Eur J Cardio-Thorac Surg,2007, 32(5):776-782.
[4] Ur-Rehman S, Fox PF. Effect of added α-ketoglutaric acid, pyruvic acid or pyridoxal phosphate on proteolyis and quality of Cheddar cheese[J] . Food Chem, 2002, 76(1):21-26.
[5] 张群. 发酵法生产α-酮戊二酸技术的研究[J] . 食品与生物技术学报, 2012(2):224.
[6] Chernyavskaya OG, Shishkanova NV, Il’chenko AP, et al. Synthesis of α-ketoglutaric acid byYarrowia lipolyticayeast grown on ethanol[J] . Appl Microbiol Biotechnol, 2000, 53:152-158.
[7] Zhou J, Zhou H, Du G, et al. Screening of a thiamine-auxotrophic yeast for alpha-ketoglutaric acid overproduction[J] . Lett Appl Microbiol, 2010, 51(3):264-71.
[8] Yin X, Madzak C, Du G, et al. Enhanced alpha-ketoglutaric acid production inYarrowia lipolyticaWSH-Z06 by regulation of the pyruvate carboxylation pathway[J] . Appl Microbiol Biotechnol,2012, 96(6):1527-37.
[9] Yu Z, Du G, Zhou J, Chen J. Enhanced α-ketoglutaric acid production inYarrowia lipolyticaWSH-Z06 by an improved integrated fedbatch strategy[J] . Bioresour Technol, 2012, 114:597-602.
[10] Miller GL. Use of Dinitrosalicylic acid reagent for determination of reducing sugar[J] . Anal Chem, 1959, 31(3):426-428.
[11] 王剑锋, 修志龙, 范圣第. 甘油转化生产1, 3-丙二醇发酵液中甘油含量的测定[J] . 工业微生物. 2001(2):33-35.
[12] Liu LM, Li Y, Du GC, et al. Breeding of high-pyruvate-producing Torulopsis glabrata with acetate as supplement catbon source[J] .Ind Microbiol, 2002, 32(3):21-26.

