人参皂苷Rg3对H2O2导致海马神经元损伤的保护作用研究
胡炜彦, 于浩飞, 张荣平*
(1. 昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;2.昆明医科大学分子临床研究院,云南 昆明 650500)
神经细胞氧化应激损伤是大脑衰老、疾病的病理学特征之一,因此保护神经细胞,抵抗氧化损伤有着重要的意义。海马是中枢神经系统的重要组成部分,在学习记忆环节中起着十分重要的作用。在神经退行性疾病患者中,脑组织萎缩和脑实质内神经细胞数量的减少程度比正常老年人更为明显,海马也是最早受累的部位之一[1-2]。人参皂苷Rg3(Ginsenoside Rg3),为五加科植物人参或三七中提取分离出的微量皂苷类成分,目前,大部分的研究集中在人参皂苷Rg3抗肿瘤方面的作用[3-6],也有文献报道人参皂苷Rg3对脑缺血大鼠脑线粒体损伤具有明显的保护作用,该作用可能与清除氧自由基、抑制脂质过氧化、拮抗Ca2+有关[7]。有研究证实人参及人参或三七中提取分离出的皂苷类成分(如人参皂苷Rb1、Rg1等)具有保护神经损伤的作用,能够改善认知和学习记忆功能[8-10]。但关于人参皂苷Rg3在神经元保护方面报道较少,因此,本实验以原代培养的小鼠海马神经元为研究对象,以H2O2制备氧化应激损伤模型,研究人参皂苷Rg3预处理对H2O2所致海马神经元损伤的保护作用。
1 材料
1.1 动物 孕18 d C57小鼠,购于昆明医学院实验动物中心,合格证号:SCXK(滇)-2011004。
1.2 试剂与仪器 神经元培养基(Neurobasal medium)、DMEM培养基、胰蛋白酶(Typsine)、杜氏磷酸缓冲液(DPBS)、磷酸盐缓冲液(PBS)、聚乙二醇辛基苯基醚100(Triton-X 100)、Hank′s平衡盐溶液(HBSS)、青霉素-链霉素(P/S)、胎牛血清(FBS)、B27、CCK-8试剂盒,L-多聚赖氨酸(PLL)等均购自Invitrogen公司。人参皂苷Rg3(云南中医学院周志宏教授提供)。H2O2(购自Sigma公司)。
核糖核酸(RNA)提取试剂盒、实时荧光定量聚合酶链式反应(RT-PCR)试剂盒(购自宝生物工程(大连)有限公司);乳酸脱氢酶(LDH)检测试剂盒(上海酶联生物科技有限公司);丙二醛(MDA)、超氧化物歧化酶(SOD)活性检测试剂盒(北京博迈斯生物科技有限公司)。GAPDH及Caspase-3基因引物均由Invitrogen公司(上海)合成。GAPDH,上游引物F:TGACGTGCCGCCTGGAG AAA,下游引物R:AGTGTAGCCCAAGATGCC CTTCAG;Caspase-3,上游引物F:ACCGATGTCGAT GCAGCTAA,下游引物R:GGTGCGGTAGAGT AAGCATA。
2 方法
2.1 小鼠海马神经元的分离和培养 取孕龄为18 d的C57小鼠,脱臼处死后无菌操作取出胎鼠的海马,剪碎,0.125% Typsine 37 ℃消化15 min,用含10% FBS 的DMEM终止消化后,75 μm筛网滤过,滤液1 000 r/min离心5 min,弃上清。再次加Neurobasal medium 混悬,1 000 r/min离心5 min,弃上清。加Neurobasal medium 混悬,测细胞密度,调整细胞密度为5.2 × 105个/mL,接种于用PLL(0.01% solution) 包被过的96孔板和6孔板中。培养至72 h后加入终质量浓度为2.5 mg/L阿糖胞苷纯化神经元。于第7天用于实验。
2.2 神经元总RNA 提取 原代培养的海马神经元于培养第7天,加入设定浓度的人参皂苷Rg3预处理30 min,加入终浓度50.0 μmol/L的H2O2损伤神经元,人参皂苷Rg3用DMSO溶解,加入相同体积二甲基亚砜(DMSO)作试剂空白对照组。6 h后,加入Trizol裂解液,按RNA 提取试剂盒说明书操作,提取总RNA。
2.3 RT-PCR反应 RT-PCR 操作按照RT-PCR试剂盒说明书进行。反应体系及扩增条件如下:逆转录体系包括标本总RNA 500 ng,缓冲液 5 μL,逆转录酶1.25 μL, 寡核苷酸1.25 μL, 6核苷酸的随机引物5 μL,不含RNase 的水补齐至25 μL。37℃反应15 min,85 ℃反应5 s,cDNA置4 ℃保存。
PCR反应体系包括PCR缓冲液5 μL,上游引物0.20 μL,下游引物0.20 μL,cDNA产物1 μL加荧光定量PCR参比染料 0.20 μL,不含RNase 的水 2.8 μL至总体系为10 μL。反应程序为:95 ℃ 30 s, 95 ℃ 20 s,55 ℃ 20 s, 72 ℃ 30 s,72 ℃ 10 s,共40个循环。
2.4 神经元形态观察 原代培养的海马神经元于培养第7天,加入设定浓度的人参皂苷Rg3预处理30 min,加入终浓度50.0 μmol/L的H2O2损伤神经元,人参皂苷Rg3用DMSO溶解,相同体积DMSO作试剂空白对照组。6 h后,置倒置显微镜下观察其形态变化。
2.5 神经元细胞活力测定 原代培养的海马神经元于培养第7天,加入设定浓度的人参皂苷Rg3预处理30 min,人参皂苷Rg3用DMSO溶解,加入相同体积DMSO作溶剂空白对照组,加入终浓度50.0 μmol/L的H2O2损伤神经元。6 h后,加入每孔加入20 μL CCK-8溶液,设定加入相应量细胞培养液、药物和CCK-8溶液但没有加入细胞的孔作为试剂空白对照。在细胞培养箱内继续孵育1 h。在450 nm测定吸光度。
各组细胞活力=(各组吸光度/溶剂空白对照组吸光度)×100%
2.6 培养液中LDH 测定 原代培养的海马神经元于培养第7天,分别用试药处理后,收集细胞培养上清液,参照试剂盒说明书测定培养液中LDH漏出量。
2.7 细胞内SOD 活性和MDA 测定 原代培养的海马神经元于培养第7天,分别用试药处理后,去除原培养液,细胞用PBS洗2遍,每孔加入0.1 mol/L的PBS和0.05 mmol/L的EDTA(pH 8.0)1 mL,再加入1%的Triton-X 100 50 μL,将培养板置振荡器振荡1 min 使之溶解,加入25%的H3PO4100 μL,10 000×g于4 ℃离心1 h,取上清液,按说明书测定SOD 活性和MDA水平。
3 结果
3.1 人参皂苷Rg3对H2O2损伤神经元caspase-3 mRNA表达的影响 RT-PCR检测结果显示,50.0 μmol/L的H2O2作用于神经元6 h后,可显著上调海马神经元caspase-3 mRNA的表达;与模型组相比,人参皂苷Rg3预处理(10,50 μmol/L )组,caspase-3 mRNA 表达明显下降,结果提示人参皂苷Rg3能够逆转H2O2引起的海马神经元caspase-3 mRNA的表达,见表1。
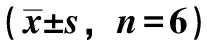
表1 人参皂苷Rg3对Caspase-3 mRNA 表达的影响
3.2 人参皂苷Rg3对H2O2损伤神经元形态的影响 在倒置显微镜下观察结果显示,50.0 μmol/L的H2O2作用于神经元6 h后,神经元形态出现萎缩,轴突断裂,细胞碎片较多。与模型组相比,人参皂苷Rg3预处理(10,50 μmol/L)组,神经元形态完好,轴突未见断裂,细胞碎片较少,见图1。
3.3 人参皂苷Rg3对H2O2损伤神经元细胞活力及LDH漏出的影响 CCK-8 检测结果表明,50.0 μmol/L的H2O2作用于神经元6 h后,可显著降低小鼠海马神经元的活力,细胞膜通透性增大,培养液中LDH的水平显著增加。与模型组相比,人参皂苷Rg3预处理(10,50 μmol/L)组,小鼠海马神经元活力明显增强,细胞培养液中LDH 的漏出量明显降低。结果提示人参皂苷Rg3能够逆转H2O2引起的海马神经元活力下降,减少LDH的漏出。见表2。

图1 人参皂苷Rg3对神经元形态的影响

表2 人参皂苷Rg3对H2O2 损伤海马神经元细胞活力的影响
3.4 人参皂苷Rg3对MDA水平和SOD活性的影响 与试剂空白对照组相比,小鼠海马神经元经50.0 μmol/L的H2O2处理6 h后,培养液中MDA水平显著增加,SOD活性显著降低;预先给予人参皂苷Rg3(10,50 μmol/L) 预处理30 min,可明显降低培养液中MDA水平,升高SOD活性,结果见表3。
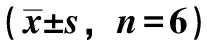
表3 人参皂苷Rg3对H2O2损伤海马神经元MDA水平和SOD活性的影响
4 讨论
近年来随着我国人口的迅速老龄化,中枢神经系统退行性疾病日益增多,给社会和家庭带来沉重的负担。氧化应激(oxidative stress)和凋亡在衰老中的作用越来越受到人们的重视,氧化应激导致细胞老化、死亡等氧化损伤,直接参与了多种神经退行性疾病的病理过程,氧化损伤早于病理特征性改变[11-12]。H2O2是一种较强的氧化剂,极易进入细胞内,形成高活性的氧自由基或羟基自由基,造成细胞损伤[13]。存在于细胞浆和线粒体里的一种金属蛋白酶使神经元发生脂质过氧化反应生成MDA、SOD,能够清除代谢产生的超氧阴离子,是体内抗氧化系统的重要组成部分。因此,测定MDA、SOD活性既可以反映细胞损伤程度又可以判断细胞损伤原因[14-15]。
细胞活性的高低可以反映细胞的代谢与增殖。Cell Counting Kit-8简称CCK-8试剂盒,是一种基于WST-8的广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂盒。WST-8是一种类似于MTT的化合物,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的formazan。细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。对于同样的细胞,颜色的深浅和细胞数目呈线性关系。
研究结果显示H2O2(50 μmol/L)诱导海马神经元6 h,神经元出现萎缩,轴突断裂,细胞碎片较多,CCK-8检测结果显示细胞活力下降,与对照组相比细胞内MDA水平明显升高而胞内SOD活性显著降低,提示H2O2(50 μmol/L)所致海马神经元损伤与脂质过氧化损伤有关,人参皂苷Rg3可提高神经元内SOD活性并显著降低胞内MDA的水平,提高海马神经元细胞活性,表明人参皂苷Rg3可明显地减弱H2O2所造成的海马神经元氧化应激损伤,其作用机制可能与增强SOD活性,抑制LDH漏出,降低MAD、cospuse-3水平有关。
参考文献:
[1] Coleman P D,Flood D G. Neuron numbers and dendritic extent in normal aging and Alzheimer’s disease[J].NeurobiolAging,1987,8(6):521-545.
[2] Ball M J,Fisman M,Hachinski V.etal. A new definition of Alzheimer’s disease:a hippocampal dementia[J].Lancet,1985,325(8419):14-16.
[3] 陈 曦,陈 鲁,人参皂苷Rg3的抗肿瘤作用研究进展[J].中国当代医药,2011,18(36):17-18.
[4] 简 捷,胡志方,黄 缘,人参皂苷Rg3对人胰腺癌细胞Pim-3及Bad凋亡蛋白表达的影响[J].癌症,2009,28(5):461-465.
[5] 王金良,孔佩艳,徐 葳,等.人参皂苷Rg3抑制急性白血病骨髓基质细胞HIF-1A及VEGF的表达及其机制探讨[J].第三军医大学学报,2010,32(7):621-624.
[6] 安 宁,朱 文,冯志华,等.人参皂苷Rg3对肺癌细胞蛋白表达的影响研究[J].中国肺癌杂志,2008,11(3):311-320.
[7] 田京伟,傅风华,杨建雄,20(S)-人参皂苷Rg3对脑缺血大鼠脑线粒体损伤的保护作用[J].中国药理学通报,2006,22(2):216-220.
[8] Wen T C,Yoshimura H,Matsuda S,etal.Ginseng root prevents learning disability and neuronal loss in gerbils with 5-minute forebrain ischemia[J].ActaNeuropathol,1996,91(1):15-22.
[9] 陈志勇,杜天明,陈善成,人参皂甙Rg1对海马电损伤大鼠的学习记忆功能和海马神经细胞形态的影响[J].南方医科大学学报,2011,31(6):1039-42.
[10] Rudakewich M,Ba F,Benishin C G. Neurotrophic and neuroprotective actions of ginsenosides Rb(1) and Rg(1)[J].PlantaMed,2001,67(6):533-537.
[11] Aliev G,Obrenovich M E,Reddy VP,etal. Antioxidant therapy in Alzheimer’s disease:theory and practice[J].MiniRevMedChem,2008,8(13): 1395-1406.
[12] Shi Q,Gibson G E.Oxidative stress and transcriptional regulation in Alzheimer disease[J].AlzheimerDisAssocDisord,2007,21(4):276-291.
[13] Li W G,Miller F J J,Zhang H J,etal. H2O2-induced O2-production by a non-phagocytic NAD(P)H oxidase causes oxidant injury[J].JBiolChem,2001,276(31):29251-29256.
[14] Kinnula V L,Everitt J I,Whorton A R,etal. Hydrogen peroxide production by alveolar type II cells,alveolar macrophages,and endothelial cells[J].AmJPhysiol,1991,261(2Pt1):L84-L91.
[15] Mügge A,Elwell J H,Peterson T E,etal. Release of intact endothelium-derived relaxing factor depends on endothelial superoxide dismutase activity[J].AmJPhysiol,1991,260(2Pt1):C219-C225.