黄芪多糖对异丙肾上腺素诱导大鼠心肌肥厚中TLR4/NF-κB信号通路的影响
李胜陶, 王洪新, 杨 娟, 鲁美丽, 张 静
(辽宁医学院心脑血管药物研究重点实验室,辽宁 锦州 121001)
黄芪多糖(Polysaccharide fromAstragaliRadix)是中药黄芪中的主要活性成分之一,也是目前临床和药理研究较为深入的中药成分之一,具有广泛的免疫调节作用并能改善心脏功能及炎症抑制作用[1]。最近,关于炎症信号通路及炎症因子在心肌肥厚的发生发展过程中的作用越来越受到重视。有研究表明,炎症因子在促进左心室重构中起到重要作用,包括导致心肌细胞肥大、胚胎基因表达、促进心肌细胞凋亡等[2-3]。Toll样受体(Toll-like receptors)最突出的生物学功能是促进细胞因子的合成与释放,引发炎症反应[4]。Toll 样受体是心血管疾病发展与免疫系统之间的桥梁,其中TLR4被认为与人类心血管疾病关系最为密切[5-6],TLR4是介导心肌肥厚炎症信号的重要受体,TLR4的活化可使NF-κB的表达增加,进而引起一系列炎性因子的表达,相反NF-κB的活性对TLR4也具有调节作用[7]。Serra等[8]研究发现,异丙肾上腺素(Isoprenaline,ISO)诱导心肌肥厚可使心肌组织中TNF-α和IL-6的基因表达增加,同时也使NF-κB表达增加。但异丙肾上腺素诱导心肌肥厚的过程中,TLR4表达是否增加目前尚无报道。已有研究证实黄芪多糖对异丙肾上腺素诱导乳鼠心肌细胞肥大有保护作用[9]。然而黄芪多糖对异丙肾上腺素诱导心肌肥厚的保护作用是否通过阻断TLR4/NF-κB通路这一途径,目前尚无报道。本实验运用异丙肾上腺素制作心肌肥厚模型,探讨TLR4/NF-κB通路在黄芪多糖保护心脏过程中的作用机制。
1 材料与方法
1.1 实验动物、药品和试剂 健康Sprague-Dawley(SD)大鼠,雌雄不限,4~6 周龄,体质量180~200 g,由辽宁医学院实验动物中心提供,动物合格证号:SCXK(辽)20030007。黄芪多糖购自陕西森弗生物技术有限公司(批号HQ090312),纯度为98%;异丙肾上腺素、普萘洛尔(美国 Sigma 公司),TNF-α和IL-6 ELISA 试剂盒均购自 R&D 公司;TLR4一抗、IκBα一抗(北京博奥森生物技术有限公司)和p65一抗(美国Proteintech Group公司);Trizol试剂、RT-PCR 试剂盒购自大连宝生物公司。其他试剂均为国产分析纯。
1.2 动物模型制备、实验分组和给药方法 SD大鼠60只,随机分为6组(每组10只):对照组,异丙肾上腺素组,异丙肾上腺素+黄芪多糖200 mg/(kg·d)组,异丙肾上腺素400 mg/(kg·d)组,异丙肾上腺素800 mg/(kg·d)组,异丙肾上腺素+普萘洛尔40 mg/(kg·d)组。给药组连续腹腔注射3周,并于给药1 d后腹腔注射异丙肾上腺素 5 mg/(kg·d)2周;正常对照组和异丙肾上腺素组大鼠都给予相同体积的生理盐水。
1.3 心脏质量参数测定 麻醉后迅速开胸,去血清置于-20 ℃ 冰箱保存。抽取血标本后取出心脏,修剪周围组织和血管,称量全心质量(Heart weight,HW)和左心室质量(Left ventricle weight,LVW)。计算全心质量指数(Heart mass index,HMI=HW/BW)和左室质量指数(Left ventricle mass index ,LVMI=LVW/BW)。
1.4 HE染色检测心肌组织改变 横向取甲醛固定好的左心室心肌部分约0.5 cm,常规石蜡包埋、切片(5 μm),HE染色后,光镜下观察心肌组织形态学变化。
1.5 RT-PCR法检测心肌组织 ANP 和 TLR4 mRNA的表达 取约100 mg心肌组织,用TRIzol 法提取心肌组织总 RNA,取约1 μg总 RNA,进行逆转录。逆转录条件:30 ℃ 10 min,42 ℃ 30 min,95 ℃ 5 min。ANP引物:上游引物GGG CTC CTT CTC CAT CAC,下游引物CCC TCA GTT TGC TTT TCA(344 bp)。TLR4引物:上游引物CTA TCA TCA GTG TAT CGG TG, 下游引物CAG TCC TCA TTC TGG CTC(186 bp)。内参GAPDH的引物序列上游引物AAT GCA TCC TGC CAC CAC CAA CTG C, 下游引物GGA GGC CAT GTA GTA GGC CAT GAG GTC(550 bp)。PCR反应条件:94 ℃ 45 s,55 ℃ 50 s,72 ℃ 1 min 15 s。电泳结束后,取置于凝胶成像系统进行观察,用凝胶图像分析系统软件对 RT-PCR 产物电泳条带进行密度分析,以 GAPDH 为内参,根据心钠素(ANP)、TLR4和GAPDH密度分析结果比值,计算得到ANP、TLR4的相对表达量。
1.6 Western Blot 法测定心肌组织TLR4、p65和IκBα蛋白表达 选取心肌组织放于无菌EP管中,加入裂解缓冲液(RIPA),提取总蛋白。蛋白定量(BCA) 法进行蛋白浓度测定,灌胶上样进行SDS-聚丙烯酰胺凝胶电泳,观察标记移动情况,根据所需适时终止电泳。取出电泳凝胶进行转膜,然后将得到的PVDF膜浸入封闭液置于摇床上缓慢摇1 h以上,洗膜,切割后分别按照对应分子量置于稀释过的TLR4、p65和IκBα一抗溶液中,4 ℃ 杂交过夜,用洗膜液漂洗后加入稀释的二抗,摇床上杂交 1 h,然后取出用洗膜液冲洗,然后加ECL显色,上机检测。
1.7 ELISA 法检测大鼠血清 TNF-α、IL-6水平 备好“1.3”项步骤中的血清标本,采用酶联免疫吸附试验(ELISA) 法检测大鼠血清TNF-α、IL-6蛋白浓度。在无菌条件下按照ELISA试剂盒说明书进行操作。

2 结果
2.1 不同处理因素对大鼠心脏指数的影响 表1结果显示,与对照组相比较,异丙肾上腺素组大鼠的HMI和LVMI分别增加了37.40%、35.35%(P<0.01),表明大鼠心肌肥厚模型成功,心脏整体形态发生改变。同异丙肾上腺素组相比较,黄芪多糖400、800 mg/(kg·d)和普萘洛尔40 mg/(kg·d)组大鼠HMI和LVMI明显降低(P<0.05,P<0.01),说明黄芪多糖可有效减轻异丙肾上腺素所致的心肌肥厚。

表1 不同处理因素对大鼠HMI和LVMI的影响
2.2 不同处理因素对大鼠心肌病理变化的影响 HE染色切片在显微镜下观察,对照组心肌细胞形态均匀,心肌纤维排列整齐(图1A)。异丙肾上腺素组心肌细胞较宽大,肌束纤维排列紊乱且疏松水肿,界限不清,且有局灶性坏死,肌束内可见局灶性纤维组织增生,间质可见炎症细胞浸润(图1B)。与异丙肾上腺素组相比较,黄芪多糖 200 mg/(kg·d)组心肌纤维未见恢复(图1C);黄芪多糖400 mg/(kg·d)组心肌纤维部分恢复,但仍见少部分区域心肌纤维肿胀,肌纤维紊乱程度减轻,间质中炎症细胞浸润减少(图1D);黄芪多糖800 mg/(kg·d)组和普萘洛尔40 mg/(kg·d)组心肌纤维恢复良好,排列恢复整齐,形态基本保持一致(图1E、1F)。
2.3 心肌组织ANP、TLR4 mRNA的表达 心钠素(Atrial natriuretic peptide,ANP)是心肌肥大的标志性基因之一,通常肥大的心肌组织较正常心肌组织中ANP mRNA表达增加。 图2所示为各组大鼠心肌组织ANP、TLR4 mRNA的表达水平。同对照组相比,异丙肾上腺素组大鼠心肌组织ANP、TLR4mRNA表达分别增加了44.27%、60.12%(P<0.01)。与异丙肾上腺素组相比,黄芪多糖各剂量组和普萘洛尔40 mg/(kg·d)组ANP、 TLR4 mRNA的表达减少,差别有统计学意义(P<0.05,P<0.01)。表明黄芪多糖对异丙肾上腺素诱导的心肌肥厚有保护作用,其可能是通过抑制TLR4 mRNA 的表达。
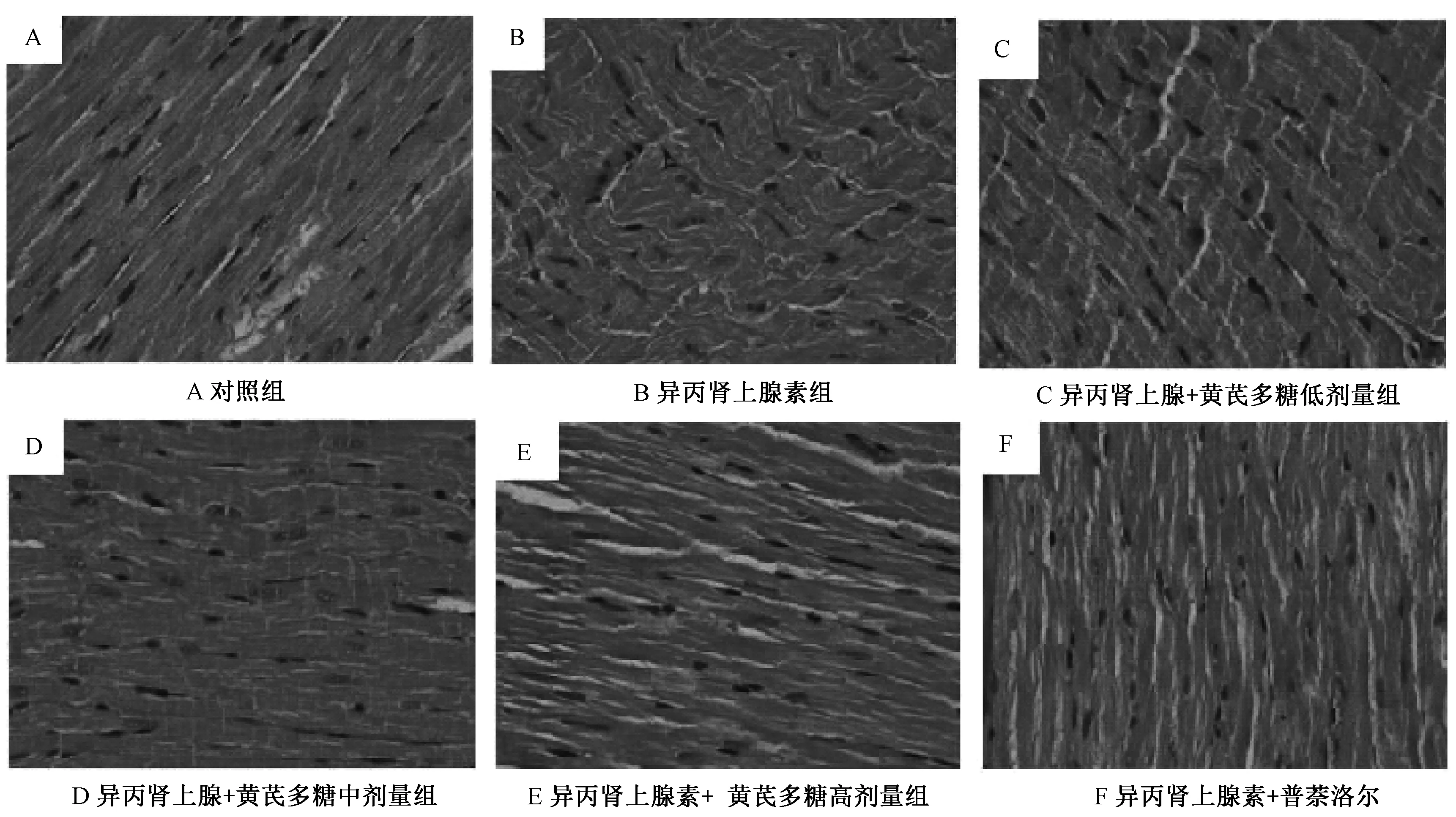
图1 不同处理因素对大鼠心肌病理变化的影响(HE×400)
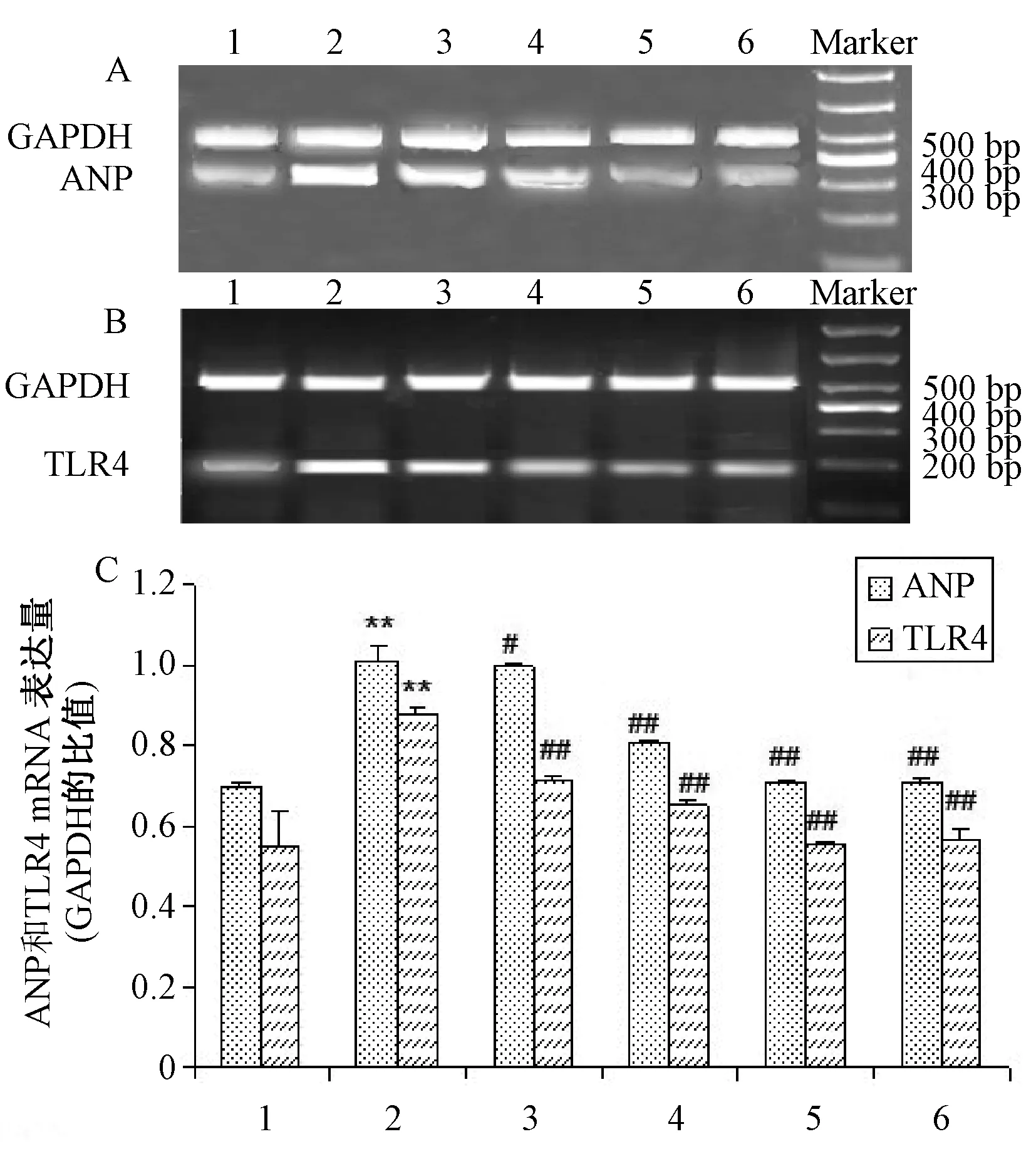
注:与对照组比较,**P<0.01;与异丙肾上腺素组相比较,#P<0.05,##P<0.01 1.对照组 2.异丙肾上腺素组 3.异丙肾上腺素+黄芪多糖 200 mg/(kg·d) 4.异丙肾上腺素+黄芪多糖400 mg/(kg·d)组5. 异丙肾上腺素+黄芪多糖800 mg/(kg·d)组 6.异丙肾上腺素+普萘洛尔40 mg/(kg·d)组
2.4 心肌组织TLR4、p65和IκBα蛋白的表达 图3所示为各组大鼠心肌组织TLR4、p65和IκBα蛋白的表达水平。与对照组相比,异丙肾上腺素组TLR4、p65表达水平分别增加,IκBα 表达水平减少(P<0.01)。与异丙肾上腺素组相比,黄芪多糖各剂量组和普萘洛尔40 mg/(kg·d)组TLR4、P65表达水平分别减少,IκBα 表达水平升高(P<0.05,P<0.01)。表明黄芪多糖可能通过抑制IκBα 降解,抑制TLR4、 p65 的表达而保护心脏。
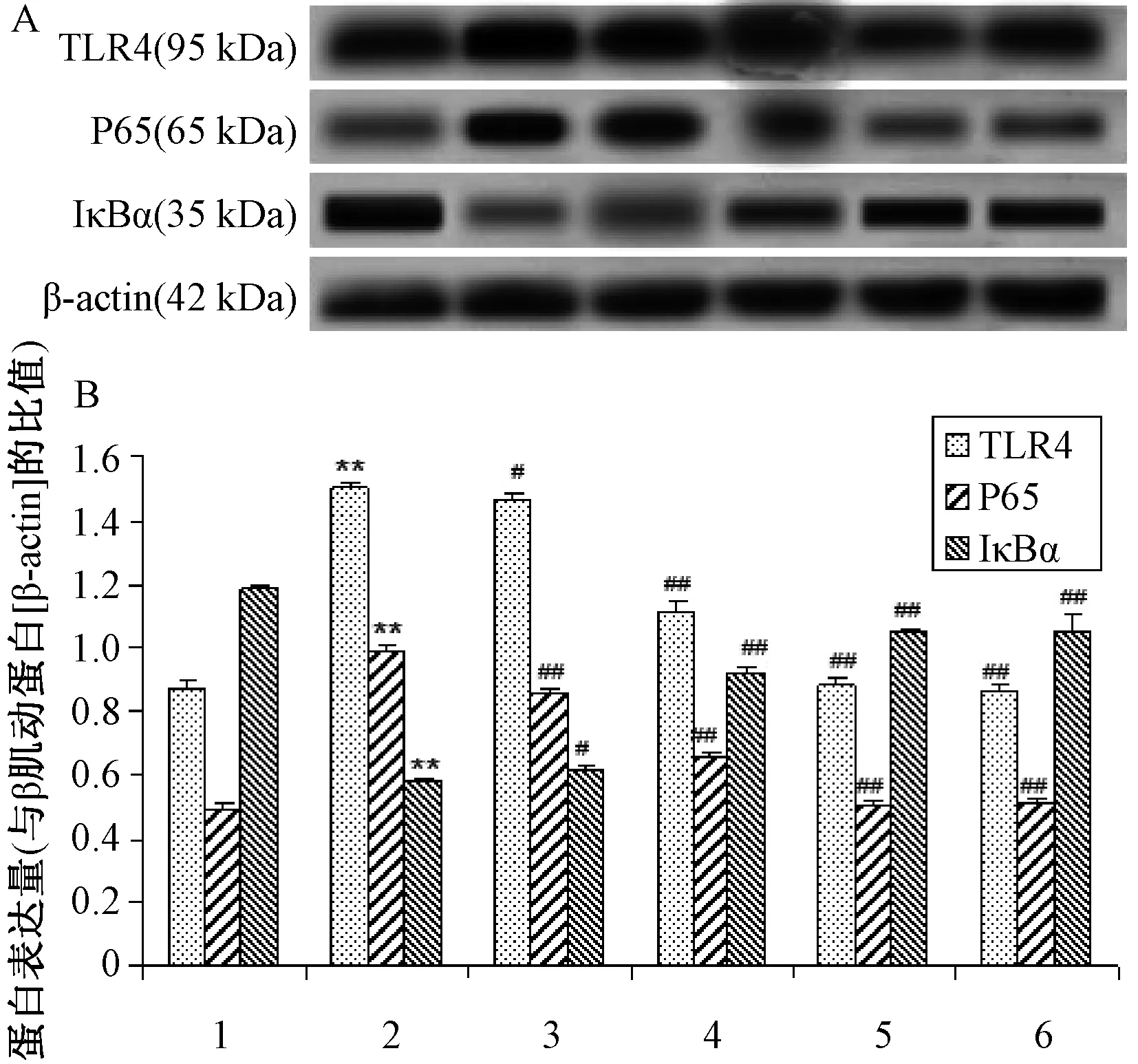
注:与对照组比较,**P<0.01;与异丙肾上腺素组相比较,#P<0.05,##P<0.01 1.对照组 2.异丙肾上腺素组 3.异丙肾上腺素+ 黄芪多糖 200 mg/(kg·d) 4.异丙肾上腺素+ 黄芪多糖400 mg/(kg·d) 5.异丙肾上腺素+ 黄芪多糖800 mg/(kg·d) 6.异丙肾上腺素+普萘洛尔40 mg/(kg·d)
2.5 大鼠血清中TNF-α、IL-6 的表达 表2为大鼠血清中炎症因子TNF-α、IL-6表达的情况。同对照组相比较,异丙肾上腺素组大鼠血清中炎症因子TNF-α、IL-6水平明显增加(P<0.01)。与异丙肾上腺素组相比,黄芪多糖 400 mg/(kg·d)组、黄芪多糖800 mg/(kg·d)组和普萘洛尔组 40 mg/(kg·d) 组能够明显减少大鼠血清中炎症因子TNF-α、IL-6的水平(P<0.01);黄芪多糖200 mg/(kg·d)组能够减少血清中炎症因子TNF-α的水平(P<0.05)。与黄芪多糖200 mg/(kg·d)组相比较,黄芪多糖400、800和普萘洛尔40 mg/(kg·d)组TNF-α、IL-6的水平明显降低(P<0.01),并且炎症因子TNF-α、IL-6的水平随着黄芪多糖的剂量递增而呈递减趋势,即黄芪多糖对炎症因子的抑制作用呈剂量依赖性,表明黄芪多糖可以通过抑制炎症因子TNF-α、IL-6的表达来保护心肌。

表2 不同处理因素对大鼠血清中TNF-α和IL-6 表达的影响
3 讨论
心肌肥厚是众多心血管疾病共同的病理过程,研究发现肥厚的心肌中存在严重的炎症反应,而一系列的炎症应答会加重心肌损害,从而引起心肌收缩功能障碍及心肌重构,最终会导致心力衰竭[10]。有研究表明抑制心脏的炎症反应可以有效防止心肌肥厚并减缓心衰的发展[11]。导致心肌肥厚的信号通路[12]如MAPK通路、Ca2+及其依赖的信号通路、JAK/STAT信号通路等,目前针对这些信号通路的药物及治疗策略对心脏疾病的疗效与对死亡率的控制已经不能再进一步改善与提高。而有离体实验[13-14]针对TLR4/NF-κB这一炎症信号通路的研究发现,黄芪多糖可以减缓TNF-α、脂多糖(LPS)诱导心肌细胞肥大中的炎症因子的表达。有动物实验研究表明[15],阻断NF-κB后,TLR4在肾性高血压大鼠肥厚心肌中表达减少。所以研究黄芪多糖对异丙肾上腺素诱导大鼠心肌肥厚中TLR4/NF-κB的影响具有重要意义。
本实验结果显示,黄芪多糖可以抑制异丙肾上腺素诱导的心肌肥厚,并且黄芪多糖800 mg/(kg·d)组与普萘洛尔组对心肌肥厚的保护作用相似。心脏质量参数测定结果显示异丙肾上腺素组大鼠全心质量指数和左心室质量指数分别增加了37.40%、35.35%;在400倍显微镜下观察心肌组织HE染色,发现异丙肾上腺素组心肌细胞增粗,肌束纤维排列紊乱且疏松水肿,界限不清,间质可见炎症细胞浸润;心肌肥厚基因ANP mRNA的表达显著增加,说明大鼠心肌肥厚模型成功。而黄芪多糖800 mg/(kg·d)组能有效对抗这些改变。从RT-PCR对心肌组织TLR4 mRNA检测水平来看,异丙肾上腺素组较对照组的表达水平明显增加,而在黄芪多糖和普萘洛尔组TLR4 mRNA的水平降低。通过Western Blot检测心肌组织TLR4、p65和IκBα蛋白水平结果来看,异丙肾上腺素组大鼠心肌组织TLR4、p65蛋白表达增加,而IκBα蛋白表达降低,黄芪多糖和普萘洛尔组的结果与之相反。ELISA 的结果显示,异丙肾上腺素能引起大鼠血清中炎症因子TNF-α、IL-6增多,黄芪多糖 800 mg/(kg·d)组和普萘洛尔组抑制炎症因子的作用相似,并且炎症因子TNF-α、IL-6的水平随着黄芪多糖的剂量递增而呈递减趋势,即黄芪多糖对炎症因子的抑制作用呈剂量依赖性,表明黄芪多糖可以通过抑制炎症因子TNF-α、IL-6的表达来保护心肌组织。
综合以上实验结果,说明黄芪多糖能抑制异丙肾上腺素诱导的心肌肥厚,能抑制TLR4、p65的表达和IκBα的降解,即黄芪多糖可能是通过抑制TLR4/NF-κB这一信号通路的激活来减缓组织中的炎症因子的分泌,从而保护心脏。但其具体机制还有待进一步证实,黄芪多糖用于临床心血管疾病的治疗以及与普萘洛尔对照的疗效都需进一步实验探讨。
参考文献:
[1] Li S G, Zhang Y Q, Zhao J X. Preparation and suppressive effect of astragalus polysaccharide in glomerulonephritis rats[J].IntImmunopharmaco, 2007, 7(1): 23-28.
[2] Hedayat M, Mahammadi M J, Hedayat M,etal. Proinflammatory cytokines in heart failure: double edged swords[J].HeartFailRev,2010,15(6):543-562.
[3] Kleinbongard P, Schulz R, Heusch G. TNF-α in myocardial ischemia/reperfusion, remodeling and heartfailure[J].HeartFailRev,2011, 16(1):49-69.
[4] Akira S,Uemalsu S,Takeuchi O. Pathogen recognition and innate immunity[J].Cell,2006, 124(4):783-801.
[5] 朱文敏. Toll样受体与心血管疾病[J].国际心血管杂志,2008,35(6):377-379.
[6] Ding G, Cheng L, Qin Q,etal. PPARalpha modulates lipopolysaccharide induced TNF-α inflammation signaling in cultured cardiomyocytes[J].MolCellCardiol,2006, 40(6):821-828.
[7] Frantz S , kobzik L, Kim Y,etal. TLR4 expression in cardiac myocytes in normal and failing myocardium [J].JClinInvest,1999, 104(3): 271-280.
[8] Serra A J, Santos M H, Bocalini D S,etal. Exercise training inhibits inflammatory cytokines and more than prevents myocardial dysfunction in rats with sustained β-adrenergic hyperactivity [ J ].Physiol, 2010,588(Pt 13):2431-2442.
[9] 赵素玲,王洪新,周振华. 黄芪多糖对异丙肾上腺素诱导的乳大鼠心肌细胞肥大的保护作用[ J ].中国药理学通报, 2011,27(12):1682-1686.
[10] Rohini A, Agrawal N, Koyani C N,etal.Molecular targets and regulators of cardiac hypertrophy[J].PharmacolRes,2010 ,61(4):269-280.
[11] Gupta S, Young D, Maitra R K,etal. Prevention of cardiac hypertrophy and heart failure by silencing of NF-kappaB[J].JMolBiol,2008,375(3):637-649.
[12] 刘丽娜,李法琦.心肌肥厚相关信号通路的研究进展[J]. 重庆医学,2010,39(20): 2805-2808.
[13] 梁灵君,王洪新,孙雪芳,等. Toll样受体4/NF-κB信号通路参与黄芪多糖对肿瘤坏死因子-α诱导的乳大鼠心肌细胞肥大的抑制作用[J]. 中国药理学与毒理学杂志,2013,27(2):44-49.
[14] 孙雪芳,王洪新,粱灵君.黄芪多糖通过TLR4/NF-κB信号通路抑制脂多糖诱导的大鼠心肌细胞肥大[J].中国药理学通报 ,2013,29(2):208-211.
[15] 王季文,曲 鹏,姜 华.抑制NF-κB对Toll样受体4在Goldblatt鼠左室心肌中表达的影响[J].高血压杂志,2005, 13(7): 427-431.