六味地黄丸对2型糖尿病伴胰岛素抵抗并发周围神经病变大鼠的抗氧化作用
胡明财, 何建华, 刘 剑, 秦超超, 李晓冰*
(1.泸州医学院附属医院药剂科,四川 泸州 646000; 2.泸州医学院附属医院内分泌科,四川 泸州 646000; 3.泸州医学院药理教研室,四川 泸州 646000)
糖尿病(diabetes mellitus,DM)是由遗传因素、免疫功能紊乱、微生物感染及其毒素、自由基毒素、精神因素等各种致病因子作用于机体导致胰岛功能减退、胰岛素抵抗等而引发的一系列代谢紊乱综合征。2型糖尿病是糖尿病中最常见类型,目前大量的研究发现2型糖尿病病因是复杂的遗传因素和环境因素共同作用的结果,由于糖脂代谢紊乱造成的“葡萄糖毒性”和“脂毒性”造成机体严重的氧化应激损伤引发各种并发症,其中以周围神经病变最常见[1-2]。六味地黄丸是治疗肾阴不足的基本方,目前对六味地黄丸药理作用研究取得了许多新的进展,发现其具有降血压、降血脂、降血糖等多种药理作用[3]。本实验以2型糖尿病伴胰岛素抵抗大鼠模型作为主要研究对象,观察六味地黄丸是否具有抗氧化作用,以此探讨六味地黄丸防治糖尿病及周围神经病变的可能机制及途径。
1 材料
1.1 药物与试剂 链脲佐菌(STZ),批号为120112(美国Sigma公司);六味地黄丸,批号120142(宛西制药股份有限公司);糖末宁颗粒,批号20120903(辽宁奥达制药有限公司);胆固醇,批号120920;胆酸钠,批号120920(上海蓝季科技发展有限公司);SOD生化试剂盒,批号121016(南京建成生物工程研究所);MDA生化试剂盒,批号121016(南京建成生物工程研究所);放射免疫法胰岛素分析药盒,批号201207(由北京普尔伟业生物科技有限公司)。
1.2 仪器 FA1604N电子天平,0.1 mg,上海民桥精密科学仪器有限公司生产。罗氏活力型血糖仪(ACCU-CHEK® Active)Ⅰ型(德国罗氏);ACCU-CHEK®公司血糖测试条,条码编号20110205。
1.3 动物 SD大鼠,雄性,体质量130~150 g,SPF级,购自重庆滕鑫比尔实验动物研究所,许可证号为SCXK(渝)2007-0006。
2 方法
2.1 模型的建立与分组给药
2.1.1 2型糖尿病伴胰岛素抵抗大鼠模型的建立 大鼠80只适应喂养7 d后,随机分为空白对照组和造模组。对照组喂养普通饲料,用高脂高糖饲料饲喂造模组(2.5%胆固醇、10%猪油、20%蔗糖、1%胆酸钠,其余66.5%为基础饲料)饲养8周;8周后空腹12 h,按照剂量20 mg/kg腹腔注射链脲佐菌素(STZ,临用前配制,溶于0.1 mol/L、pH 4.2的无菌柠檬酸缓冲液),对照组注入等容量柠檬酸缓冲液。72 h后检测所有大鼠的空腹血糖值(Fasting blood glucose,FBG)与空腹胰岛素值(fasting insulin,FINS),计算每只大鼠的胰岛素抵抗指数(IRI=FBG×FINS/22.5)。
2.1.2 动物的分组及给药 造模成功的大鼠,按完全随机原则分为2型糖尿病模型组、糖末宁对照组、六味地黄丸中剂量(LWD Middle-dose,为人体等效剂量)、六味地黄丸低剂量(LWD low-dose,1/2倍等效剂量)、六味地黄丸高剂量(LWD high-dose,2倍等效剂量)组5组,并设空白对照组,每组大鼠10只。成模大鼠稳定一周后开始灌胃给药。称取大鼠体质量并标记后按人体与大鼠体表面积比值表换算出大鼠的等效剂量[4]:(A g/70 kg)×[0.09×(X)2/3/1.722](A为临床人体剂量,X为大鼠体质量)。各干预组灌胃相应药物,空白对照组及模型组灌胃等容积生理盐水。每日1次,连续8周。
2.2 指标的测定
2.2.1 大鼠空腹血糖及空腹胰岛素的测定 给药8周后空腹12 h,称定质量,尾静脉取血后罗氏血糖仪测空腹血糖。空腹胰岛素按试剂盒说明的程序采用放免法测定。
2.2.2 大鼠血SOD活力及MDA水平的测定 按照剂量20 mg/kg腹腔注射1%戊巴比妥钠麻醉大鼠,固定大鼠于手术台上,剪开腹正中皮肤,暴露腹主动脉,采血并分离血清,检测血总SOD、血MDA。具体操作按试剂盒说明进行。
2.2.3 大鼠坐骨神经组织病理检查 采血后固定大鼠并切取左腿坐骨神经标本,组织固定采用10%甲醛,之后再常规脱水并用石蜡包埋切片,切片厚度5 μm,光学显微镜观察HE染色之后的大鼠坐骨神经结构及髓鞘细胞形态。
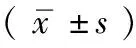
3 结果
3.1 2型糖尿病伴胰岛素抵抗大鼠造模结果 各造模组大鼠空腹血糖明显高于空白对照组(P<0.01),各造模组大鼠与空白对照组相比,胰岛素抵抗指数明显升高,有统计学差异(P<0.01),见表1。

表1 造模组与空白对照组大鼠空腹血糖、胰岛素及胰岛素抵抗指数
3.2 药物干预后大鼠空腹血糖、空腹胰岛素、胰岛素抵抗指数的影响 药物干预后,六味地黄丸高剂量组和糖末宁组与模型组相比,大鼠FBG以及IRI明显降低(P<0.01),见表2。

表2 药物干预后大鼠空腹血糖、胰岛素及胰岛素抵抗指数
3.3 药物对大鼠血SOD及MDA的影响 模型组大鼠与空白对照组相比血总SOD明显降低(P<0.01)。六味地黄丸高、中剂量组与模型组相比血总SOD明显升高(P<0.01),模型组大鼠与空白对照组相比血MDA明显升高(P<0.01)。六味地黄丸高剂量组与模型组相比血MDA明显降低(P<0.01),六味地黄丸作用与糖末宁组相比无明显差异(P>0.05),见表3。

表3 药物对大鼠血总SOD、血MDA作用的影响
3.4 坐骨神经组织病理检查 大鼠坐骨神经组织病理观察结果显示:空白对照组神经纤维形态规整,纤维密度分布较密,神经髓鞘细胞形态正常,神经纤维无脱髓鞘现象;模型组神经纤维数量减少,纤维分布稀疏,神经髓鞘细胞有变性肿胀、坏死缺失,髓鞘板层与神经纤维分离现象显著,有脱髓鞘现象。糖末宁组与六味地黄丸高剂量组神经纤维形态较规整,多数纤维分布较密,髓鞘细胞形态基本正常,脱髓鞘现象较少;六味地黄丸中剂量组、低剂量组神经纤维数量显著减少,神经髓鞘细胞有变性肿胀、坏死缺失严重,髓鞘板层与神经纤维分离现象显著,有显著脱髓鞘现象。
4 讨论
糖尿病是一种严重危害人类健康的常见慢性病,是由遗传和环境因素互相作用引起的血糖水平增高为特征的代谢性疾病。2型糖尿病是最常见的一类,主要特点是血糖高、肥胖和胰岛素抵抗[5]。本实验采用高脂高糖饲料饲喂,再低剂量注射STZ诱导2型糖尿病大鼠模型的早期生理和生化特点与人类2型糖尿病高度相似,是研究药物对2型糖尿病干预疗效较理想的动物模型。机体在高糖、高脂等代谢异常情况下,通过酶或非酶反应系统导致线粒体内糖氧化、脂肪氧化、体内蛋白质糖基化修饰反应、醛糖还原反应等生化反应生成大量的自由基产物,这些氧自由基会导致机体产生一系列的氧化应激反应[6],氧化、损伤各种细胞和组织代谢分子。当SOD被氧化或者糖基化,可导致SOD活性下降,机体抗氧化能力减弱,而氧化应激产物如脂质过氧化终末产物MDA的水平则会明显升高[7],导致线粒体活性氧的增加,进而激活细胞代谢的多元醇通路,增加蛋白质的非酶糖化,启动PKC信号传导通路,激活己糖胺代谢途径,这些代谢通路或信号通路的激活,能直接损伤血管内皮细胞导致血管病变,损伤神经髓鞘细胞引起中枢或者周围神经纤维脱髓鞘病变,因此氧化应激导致的线粒体内活性氧的增加可能是包括周围神经病变在内的各种糖尿病并发症的发生的始动环节[8-10]。被誉为“补阴方药之祖”的六味地黄丸,由熟地黄、山茱萸、山药、泽泻、丹皮、茯苓 6味中药组成,其治疗糖尿病及糖尿病并发症的临床应用已有悠久的历史。随着人们对六味地黄丸药理作用研究的不断深入,发现其具有一定治疗糖尿病的效果。
本实验结果表明模型组大鼠空腹血糖、胰岛素抵抗指数明显高于对照组;提示2型糖尿病大鼠伴胰岛素抵抗大鼠模型复制成功,而神经组织病理检查结果也提示模型大鼠并发神经病变。六味地黄丸高剂量组能降低大鼠血糖水平和减轻胰岛素抵抗从而改善糖尿病症状。同时六味地黄丸尚可增加血液SOD活力,减少MDA的生成从而减轻机体的氧化应激损伤,保护神经组织。因此,六味地黄丸防治糖尿病及周围神经病变的可能机制之一与其具有的抗氧化作用有关。
参考文献:
[1] 石 敏,李剑波.糖尿病神经病变发病机制研究新进展[J].中华临床医师杂志(电子版),2011,5(1):186-188.
[2] 刘冬恋.六味地黄丸治疗糖尿病及其并发症的研究进展[J].四川生理科学杂志,2009,31(1):31-34.
[3] 李 元,刘 垣,谢雁鸣,等.六味地黄丸治疗糖尿病临床研究文献评价[C]//世界中联第三届中医、中西医结合老年医学学术大会论文集.2010:206-209.
[4] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[5] 朱旅云,任青娟,胡丽叶,等. 肥胖2型糖尿病发病相关危险因素调查[J]. 中国现代医学杂志,2009,19(15):2371-2374.
[6] 中华中医药学会糖尿病分会.糖尿病中医诊疗标准[J].世界中西医结合杂志,2011,6(6):540-547.
[7] Bandeira Sde M, Guedes Gda S, da Fonseca LJ,elal.Characterization of blood oxidative stress in type 2 diabetes mellitus patients: increase in lipid peroxidation and SOD activity[J].OxidMedCellLongev,2012,11(8):10-15.
[8] 张苏皖,李素梅. 糖尿病肾病与线粒体氧化应激[J]. 国际病理科学与临床杂志,2011,31(6):535-538.
[9] 王巍巍. 高脂高糖饮食所致体重正常代谢性肥胖大鼠的炎症因子改变及氧化应激状态[D].大连:大连医科大学,2010.
[10] 吴建宇,王淑秋,王柏欣,等. 实验性2型糖尿病大鼠心肌线粒体的氧自由基损伤[J]. 中国病理生理杂志,2010,26(2):233-237.