年龄与性别对异硫氰酸萘酯中毒小鼠急性肝损伤的影响*
陈高峰 周振华 李 曼 孙学华 高月求,4 金树根△
1.上海中医药大学附属曙光医院肝病研究所(上海,201203) 2.上海市中医临床重点实验室 3.上海中医药大学附属曙光医院细胞免疫室 4.上海中医药大学附属曙光医院肝病科
在进行中药抗肝损伤的防治研究中,不可避免要用到异硫氰酸萘酯(α-naphthylisothiocyanate,ANIT)染毒造模制作的肝内胆汁淤积这一动物模型。我们在采用ANIT 制作小鼠肝内胆汁淤积这一动物模型时发现,不同年龄的动物染毒后其血清胆红素上升情况不一,同时同一年龄不同性别的动物染毒后其血清胆红素上升情况也不一致。鉴此我们拟研究年龄与性别对ANIT 中毒所致小鼠急性肝损伤的影响。
1 材料与方法
1.1 动物 健康昆明小鼠64 只(雌34 只,雄30 只),其中5 周龄20 只(雌雄各10 只),10 周龄24 只(雌14 只,雄10只,其中怀孕2 周母鼠4 只),20 周龄20 只(雌雄各10 只)。试验动物饲养环境保持室温18℃~24℃,光照12h,自由摄食与水,于试验收集血和肝组织样本前12h 禁食而不禁水。
1.2 试剂仪器设备 ANIT,化学纯,北京通县育才精细化工厂提供。血清ALT、AST、DBil 检测试剂盒,由上海华东菱产品提供。主要设备:全自动生化分析仪(卓越330 型,上海科华),莱卡脱水机(ASP 300S)、莱卡包埋机(EG1150H),莱卡切片机(RM2235)及奥林巴斯显微镜(DP71)。
1.3 造模 除各年龄雌雄小鼠各5 只作为正常对照组外,各年龄雌雄小鼠其他小鼠采用溶于适量植物油中配制成14 mg/ml 浓度的ANIT 按70mg/Kg (0.1ml/20g)剂量经口灌胃造模,染毒48h 后收集血清并切取肝组织样本供检查用。
1.4 观测指标 ①小鼠一般情况 包括小鼠的活动、毛色、饮水、摄食及死亡率。②血清生化ALT、AST、DBil 检测。③肝组织病理学检测,采用常规固定脱水包理切片和HE 染色。
1.5 统计学方法 采用SPSS 软件,ANOVA 处理组间差别,P <0.05 为差异有统计学意义。
2 结果
2.1 小鼠一般情况变化 油剂(正常与ANIT 造模)经口灌胃1、2h 后致小鼠毛皱,ANIT 造模组小鼠活动、摄水与食均有所减少,在预实验中ANIT 100mg/Kg 造模致部分雄性大鼠死亡。
2.2 肝组织病理学改变 正常雄性与雌性小鼠肝组织切面图见插页图1 与图2 所示。ANIT 中毒48h 后可见胆管上皮细胞肿胀变性坏死与增生,胆管周边肝细胞点状、灶状坏死,炎性细胞浸润。ANIT 中毒后,与5 周龄雌性小鼠相比,5 周龄雄性小鼠肝组织变性坏死明显加重,参见插页图3、图4。ANIT 中毒10 周龄雄性小鼠比雌性小鼠肝组织病变更加明显,而10 周龄怀孕雌性小鼠较同龄ANIT 中毒的雄性小鼠相比,其肝组织病变稍轻,但较非孕雌性小鼠相比似显加重,参见插页图5~图7。随着年龄增加,ANIT 中毒20 周龄小鼠肝组织病变加重,仍以雄性小鼠肝组织病变最为明显,参见插页图8、图9。
2.3 不同年龄及不同性别小鼠血清生化指标检测情况见表1。
表1 不同年龄及不同性别小鼠血清生化指标检测比较(±s)
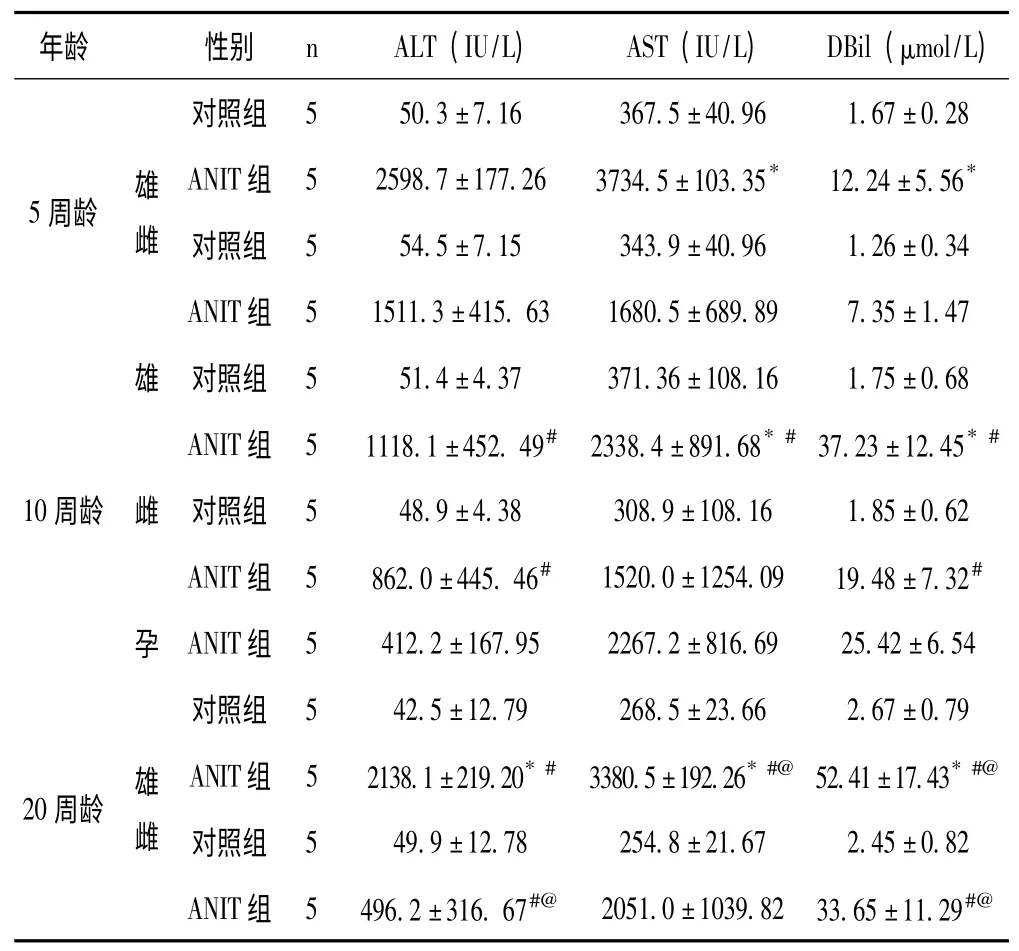
表1 不同年龄及不同性别小鼠血清生化指标检测比较(±s)
与ANIT 中毒同龄雌性小鼠相比,* P <0.05;与5 周龄同性别ANIT中毒小鼠相比,#P <0.05;与10 周龄同性别ANIT 中毒小鼠相比,@P <0.05
3 讨论
一直以来,作为胆管上皮细胞毒的ANIT 被广泛用于制作以肝内胆汁淤积为特征的急性肝损伤的动物造模。因ANIT 中毒致肝内胆管炎甚至胆管消失,有研究采用ANIT 慢性饲食染毒造模,用于制作肝内胆汁淤积为特征的慢性肝病动物模型,该动物模型采用的ANIT 无致癌原性,而且因其含有抗癌药效团——异硫氰酸而通过影响P-糖蛋白和多药耐药相关蛋白(Multidrug resistance-associated protein MRP)1 的药物外排而介导其抗癌活性,免疫学上表现为肝内Th1 细胞因子谱改变[1~6]。
作为胆管上皮细胞毒,ANIT 进入体内后,先在肝细胞内与谷胱甘肽(GSH)结合形成ANIT-GSH 复合物 (结合型ANIT)并分泌到胆汁中,结合型ANIT 不稳定,在胆汁中很快发生分离而直接损伤胆管上皮细胞,引起胆管上皮细胞明显增生,胆管周围发生肝细胞点状、灶状坏死并有大量的中性粒细胞浸润,血清生化以高胆红素血症为特征。因此研究ANIT 中毒防治方法,首先需要了解ANIT 在体内特别是肝内代谢及致病机制。ANIT 与胆红素等大多数有机阴离子一样,首先由肝细胞的肝窦面细胞膜上的转运蛋白如有机阴离子转运多肽(Organic anion transporting polypeptides,OATPs,如人OATP;大鼠oatp1、oatp2、oatp3),肝特异性转运蛋白(Liverspecific transporter,Rlst/HLST)和/或有机阴离子转运蛋白(Organic anion transporters,OATs,如OAT2、OAT3)带入肝细胞内,之后在肝细胞内与GSH 结合,形成结合型ANIT,并为肝细胞的毛细胆管面细胞膜上的MRP2 介导分泌入胆汁,另外已知在胆汁分泌不畅时由位于肝细胞横向的细胞膜上的MRP3 介导结合型胆红素返流入血,经肾脏排泄。结合型ANIT 也可能通过MRP3 返流入血,经肾脏排泄。考虑ANIT毒性与胆汁内ANIT 浓度密切相关,因此抗ANIT 中毒最佳治疗应是降低胆汁中的ANIT 浓度,而降低胆汁中的ANIT 浓度的方法有下调肝窦面细胞膜上的转运蛋白以减少肝细胞的ANIT 摄取、减少ANIT 代谢和通过下调MRP2 而减少ANIT 胆汁排泄或通过上调MRP3 而促进ANIT 返流入血经肾脏排泄。当然,增加胆汁水分分泌以降低胆汁中ANIT 浓度亦可减少ANIT 的毒性,另外胆汁水分分泌的促进与肝细胞ANIT 摄取、代谢和结合型ANIT 分泌入胆汁的促进同时联用,在降低胆汁中ANIT 浓度同时,通过快速体内(特别是肝内ANIT 从胆汁中)排泄也可减少ANIT 的毒性。事实上,ANIT 中毒致有机阴离子转运蛋白Oat1 和Oat3 表达下调而MRP2 表达上调,有机阴离子转运蛋白Oat1 和Oat3 底物JBP485 处理后被ANIT 中毒下调了的Oat1 得以上调和上调了的MRP2 进一步上调,通过增加胆汁流而减轻ANIT 肝损伤[7]。
本研究发现,ANIT 75mg/Kg 经口灌胃染毒可致5 周龄小鼠血清ALT、AST 和DBil 明显上升,肝组织学呈明显淤胆改变。随着年龄增加,ANIT 中毒所致小鼠上述改变更加明显。雄性小鼠明显重于雌性小鼠,雄性老年小鼠出现大量死亡,雌性小鼠怀孕后肝损伤不显明显变化(转氨酶下调而胆红素上调)。ANIT 造模中关于年龄与性别因素的影响,目前研究较少,有研究认为雌性小鼠肝内Oatpla1 表达明显低下(雄性小鼠的0.1 倍)、MRP2 表达稍低(0.9 倍)、MRP3 表达上调(2.1 倍),高脂饮食通过减少雌性小鼠肝内MRP2 表达而致肝内ANIT 蓄积,胆汁中ANIT 减少而减轻ANIT 肝损伤[8],说明雌激素抑制肝细胞摄取不明显、明显抑制ANIT 的胆汁分泌和促进ANIT 返流入血从肾排泄,这也解释了我们实验结果雌性小鼠肝损伤相对为轻。
本研究发现,ANIT 所致的以肝内胆汁淤积为特征的肝损伤自成年后开始呈增龄性改变,同一年龄雄性鼠肝损伤重于雌性鼠,类似于人类PSC 改变,因此我们认为不失为一PSC的动物模型。事实上,具有雄性激素作用的中药淫羊藿水煎液及其有效成分淫羊藿苷虽然有效拮抗四氯化碳中毒性肝损伤,但其治疗性给药却加重ANIT 中毒小鼠肝损伤[9],进一步表明小鼠ANIT 中毒所致肝内胆汁淤积性肝损伤更类似于人类PSC,适于PSC 防治药物的实验研究。
ANIT 染毒导致体内淋巴细胞糖皮质激素受体下调而体内糖皮质激素上调[10],国内多采用这类动物模型预防性给药进行研究,有研究发现外源性糖皮质激素虽预防性给药有减轻ANIT 中毒所致肝损伤作用,而治疗性给药则加重ANIT 中毒所致肝损伤[11]。但考虑临床用药多为治疗性用药,因此药物干预的实验方案设计上,应多采用或结合防治性或治疗性给药较为合适。
采用熊去氧胆酸(UDCA)干预ANIT 染毒所致的肝内胆汁淤积的实验研究报导结果不一[12,13],临床上UDCA 治疗PSC 虽然能改善肝功能,但对死亡率和肝组织学的影响不明显[14]。最近,有研究发现对于早期PSC,UDCA 高剂量治疗反而促进病情进展[15],也有研究发现常规和高剂量UDCA 对PSC 进展没有作用[16],还发现伴有结肠炎的患者采用UDCA治疗绝大多数在治疗第一年内出现肠癌[17],另一研究也发现伴有溃疡性结肠炎的PSC 患者采用高剂量UDCA 治疗与结直肠肿瘤发展有关[18]。因此有必要采用此一模型寻找新的抗肝内胆管病变、肝内胆汁淤积的药物,以便更好地治疗PSC 等自身免疫性肝脏疾病。
[1]Kroes R,Williams GM,Weisburger JH.Early appearance of serum -fetoprotein during hepatocarcinogenesis as a function of age of rats and extent of treatment with 3'-methyl-4-dimethylaminoazobenzene[J].Cancer Res,1972,32 (7):1526 -1532.
[2]Zhang Y,Talalay P.Anticarcinogenic activities of organic isothiocyanates:chemistry and mechanisms [J].Cancer Res,1994,54 (7 Suppl):1976s-1981s.
[3]Tseng E,Kamath A,Morris ME.Effect of organic isothiocyanates on the P-glycoprotein-and MRP1-mediated transport of daunomycin and vinblastine [J].Pharm Res,2002,19 (10):1509 -1515.
[4]Tseng E,Scott-Ramsay EA,Morris ME.Dietary organic isothiocyanates are cytotoxic in human breast cancer MCF-7 and mammary epithelial MCF-12A cell lines [J].Exp Biol Med (Maywood),2004,229 (8):835 -842.
[5]Sugie S,Ohnishi M,Ushida J et al..Effect of alpha-naphthyl isothiocyanate on 2-amino-3-methylimidazo [4,5-b]pyridine (PhIP)-induced mammary carcinogenesis in rats [J].Int J Cancer,2005,115 (3):346 -350.
[6]Tjandra K,Sharkey KA,Swain MG.Progressive development of a Th1-type hepatic cytokine profile in rats with experimental cholangitis[J].Hepatology,2000,31 (2):280 -290.
[7]Kamisako T,Kobayashi Y,Takeuchi K et al.Recent advances in bilirubin metabolism research:the molecular mechanism of hepatocyte bilirubin transport and its clinical relevance [J].J Gastroenterol,2000,35 (9):659 -264.
[8]Kong B,Csanaky IL,Aleksunes LM et al.Gender-specific reduction of hepatic Mrp2 expression by high-fat diet protects female mice from ANIT toxicity [J].Toxicol Appl Pharmacol,2012,261 (2):189-195.
[9]聂红明,汪蓉,胡锦辉,等.淫羊藿水煎液和淫羊藿甙的保肝利胆实验研究[J].实用中医内科杂志,2006,20 (4):370-372.
[10]Tjandra K,Le T,Swain MG.Glucocorticoid receptors are downregulated in hepatic T lymphocytes in rats with experimental cholangitis[J].Gut,2003,52 (9):1363 -1370.
[11]郭继强,丁宇,廖娜,等.甘草酸对实验性肝内胆汁郁积大鼠的预防和治疗作用[J].中国临床药理学与治疗学,2006,11(11):1248 -1252.
[12]Hillstrom J,Duane WC,Eckfeldt JH,et al.Lack of benefit of ursodeoxycholic acid in drug-induced cholestasis in the rat [J].Proc Soc Exp Biol Med,1992,200 (1):122 -126.
[13]佟欣,王喜军,孙晖.茵陈四逆汤对阴黄证模型大鼠的治疗作用研究[J].世界科学技术(中医药现代化),2011,13 (1):87 -92.
[14]Barnabas A,Chapman RW.Primary sclerosing cholangitis:is any treatment worthwhile [J].Curr Gastroenterol Rep,2012,14 (1):17 -24.
[15]Imam MH,Sinakos E,Gossard AA.High,et al.-dose ursodeoxycholic acid increases risk of adverse outcomes in patients with early stage primary sclerosing cholangitis [J].Aliment Pharmacol Ther,2011,34 (10):1185 -1192.
[16]Triantos CK,Koukias NM,Nikolopoulou VN,et al.Meta-analysis:ursodeoxycholic acid for primary sclerosing cholangitis [J].Aliment Pharmacol Ther,2011,34 (8):901 -910.
[17]Rudolph G,Gotthardt DN,Kloeters-Plachky P,et al.In PSC with colitis treated with UDCA,most colonic carcinomas develop in the first years after the start of treatment [J].Dig Dis Sci,2011,56(12):3624 -3630.
[18]Eaton JE,Silveira MG,Pardi DS et al.High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis[J].Am J Gastroenterol,2011,106 (9):1638 -1645.

