1株素食者产雌马酚肠道菌的分离与鉴定
李笑梅,贾冰心
(哈尔滨商业大学 黑龙江省高校食品科学与工程重点实验室,黑龙江 哈尔滨 150076)
1株素食者产雌马酚肠道菌的分离与鉴定
李笑梅,贾冰心
(哈尔滨商业大学 黑龙江省高校食品科学与工程重点实验室,黑龙江 哈尔滨 150076)
以素食者粪便为样品,大豆异黄酮为底物,对产雌马酚的肠道菌进行分离培养及鉴定。采用紫外光谱法对雌马酚定性、定量测定,用肉眼观察、扫描电镜、生理生化、16S rDNA全序测序方法对分离得到的LJ-G1肠道菌进行菌株鉴定。结果表明:麦康凯和BHI培养基、厌氧平板划线培养法更适于产雌马酚肠道菌的分离筛选。采取10 g粪样稀释到10-5接种,在pH 7.3、温度37 ℃、厌氧培养36 h的条件下,培养基中雌马酚产出量达到10 μg/mL以上。经鉴定分离得到的LJ-G1菌株为G-杆菌;根据生理生化反应结果,查阅《常见细菌系统鉴定手册》,确定LJ-G1为河生肠杆菌;16S rDNA全序测序显示与肠杆菌同源性达99%。
素食者;肠道菌;雌马酚;分离;鉴定
雌马酚(equol)是大豆异黄酮在人肠道菌作用下的代谢终产物,具有雌激素活性,大豆异黄酮的植物雌激素生物活性,更多是由雌马酚来实现的[1-2]。人体内能否将大豆异黄酮代谢产生马雌酚,主要取决于肠道微生物菌群的组成及代谢能力[3-4]。宿主基因和膳食结构会影响肠道菌群而使个体菌株产雌马酚的能力有差异[5-6]。不同人种间、素食者和非素食者产雌马酚的能力差异明显,素食者比非素食者更容易降解大豆异黄酮,产雌马酚比例高于非素食者[7]。近5年来,多株产雌马酚菌株从人类和动物的消化道内被分离出来[8-12],但是以素食人群为对象的相关研究报道较少。本研究是从素食者粪样中分离出高产雌马酚肠道菌,并进行菌株鉴定,旨在深入了解产雌马酚相关细菌的种类和分离培养条件、生长特性,为雌马酚生物合成应用技术的研究提供参考。
1 材料与方法
1.1 材料与方法
1.1.1 材料与试剂
粪样采自哈尔滨某寺庙素食者。
大豆异黄酮(纯度80%) 西安市天园生物制药厂;大豆异黄酮保健品(每片异黄酮含量>6 mg) 哈高科大豆食品有限责任公司;雌马酚标准品(纯度98%) 合肥兰旭生物有限公司;活性炭 天津市天新精细化工开发中心;聚酰胺 吉林省宏久科技公司;无水乙醇、葡萄糖、乳糖 天津市化学试剂一厂;吐温-80 上海山浦化工有限公司;琼脂粉 上海医学化验所试剂厂;厌氧产气袋 日本三菱公司。
1.1.2 仪器与设备
TU-1900型双光束紫外分光光度计 北京普析通用仪器有限公司;R-205型旋转蒸发仪 上海申胜生物技术有限公司;YQX-II型厌氧培养箱 上海新苗医疗机械有限公司;肠杆菌生理生化编码鉴定管 杭州天和微生物试剂有限公司;H-7650 透射电子显微镜 日立株式会社制作所。
1.2 方法
1.2.1 雌马酚定量测定
用TU-1900型双光束紫外分光光度计,在190~400 nm波长下扫描雌马酚标准溶液,确定最大吸收波长205 nm,回归方程y=0.1026x+0.0343(R2=0.999 9)。采用紫外光谱法对素食者的尿液和培养基中的雌马酚含量进行测定[13-14],根据下式计算培养基中雌马酚含量。

式中:ρ1为培养基中雌马酚质量浓度/(μg/mL);V1为培养基体积数/mL;V2为定容后体积数/mL;ρ2为在标准曲线上测得的定容液中雌马酚质量浓度/(μg/mL)。
1.2.2 供试者筛选
在寺庙中招募18~30岁的6名女性素食者,分别取她们正常饮食、禁食大豆制品7 d和连续服用大豆异黄酮保健品7 d后的尿液,测定雌马酚含量,选择尿样雌马酚含量较高者为粪样供试者。
1.2.3 粪样处理及适宜稀释度选择
用无菌棉签取供试者晨便,迅速装入密闭容器加并入厌氧产气袋。称取10 g粪样,加入90 mL的无菌水10-1稀释制得样液,依次进行倍比稀释,制成10-1~10-10稀释液。选用划线法将10个稀释液分别接种于营养琼脂培养基上,在36.5 ℃厌氧条件下培养36 h,根据菌落数量适宜(100~200 CFU)、无重叠、边缘清楚及雌马酚含量确定最佳稀释度,作为下面1.2.4节接种浓度。
1.2.4 培养方法及培养基的选择
肠道菌大多数为厌氧菌[15],分别采用平板培养法、滚管培养法、厌氧管培养法,在厌氧条件下培养(n=3)。视菌落的形态、雌马酚含量及操作难易综合考虑,选定培养方法。
根据已有报道[16-17],适宜肠道菌生长的培养基包括:MRS培养基、IRIE培养基、麦康凯琼脂、青春双歧杆菌培养基、BHI培养基。在每种培养基中加入质量浓度为4.0 mg/mL的大豆异黄酮底物1.5 mL(含大豆异黄酮6 mg),然后接种10-5样液(n=3),对培养基中雌马酚定性定量筛选适宜培养基。同时每种培养基作底物空白对照组和粪样空白对照组。
1.2.5 产雌马酚肠道菌的分离
将10-5样液接种于选定的培养基(含大豆异黄酮6 mg)上,置于36.5 ℃厌氧培养箱中培养36 h。再将不同的菌落分别接种在培养基上,反复培养纯化,筛选具有产雌马酚能力的肠道菌。
1.2.6 产雌马酚肠道菌的鉴定
形态观察:首先观察3代纯培养平板上的菌落形态,然后进行革兰氏染色观察菌体形态,再在电镜下观察菌体形态。
生理生化反应:用接种环将菌液接至肠道菌生理生化鉴定管内,进行生理生化反应观察其结果,对照《常见细菌系统鉴定手册》进行属种鉴定。
16S rDNA[17]全序测定:提取菌株的基因组DNA进行电泳检测,在DNA完整的条件下,用正引物27f(5’-AGAGTTTGATCCTGGCTCAG-3’)、反引物1492r(5’-TACGGCTACCTTGTTACGACTT-3’)对此菌株的16S rDNA进行PCR扩增,在相应的反应体系和条件下,将得到有效测序数据进行拼接。将测序结果利用NCBI提供的BLASTn工具等相关软件与已登录的16S rDNA序列进行同源性比较。
2 结果与分析
2.1 培养方式的比较
不同培养方式的培养基中雌马酚含量的测定结果见表1。除IRIE外不同培养方式下的各种培养基中,大豆异黄酮添加组的雌马酚含量均高于未添加组;在大豆异黄酮添加组中,平板培养法的雌马酚含量高于其他各组,最终选择平板法作为后续实验的培养方式。此外,麦康凯和BHI培养基中雌马酚含量高于其他培养基,未添加组也有少量雌马酚产生。
表1 不同培养方式的培养基中雌马酚含量Table 1 Equol content in media for different culture methods μg/mL
2.2 最适培养基的筛选
不同培养基中雌马酚含量的测定结果见表2。空白对照组各培养基均未生长菌落。在样品+底物组的5种培养基中,麦康凯和BHI培养基雌马酚含量较高,均达到10 μg/mL,且菌落生长形态好于其他组,此结果与表1结果一致,可互为验证。因此确定麦康凯和BHI培养基作为后续研究的工作培养基。无底物空白对照组也检测到雌马酚,但含量明显低于样品+底物组,含量水平在1.00~1.90 μg/mL,原因可能是在培养基成分中还含有可参与代谢产雌马酚的其他物质,有待进一步分析。

表2 不同培养基各组雌马酚含量Table 2 Equol contents in different media μg/mL
2.3 产雌马酚肠道菌的分离结果
通过最适培养基及培养方法的筛选,麦康凯培养基平板划线分离得到菌株LJ-G1产雌马酚量相对较高可达10.033 μg/mL,结果见图1。在麦康凯培养基分离得到的LJ-G1菌落呈白色、圆形隆起、边缘整齐,并且菌落会深入到培养基内,可能此菌种是运动的。
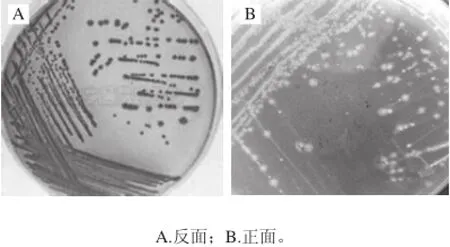
图1 麦康凯培养基上的LJ-G1菌株Fig.1 LJ-G1strain in Makanke medium
2.4 产雌马酚肠道菌的鉴定
2.4.1 革兰氏染色及电镜扫描

图2 LJ-G1革兰氏染色Fig.2 Gram staining of LG-G1
图3 LJ-G1扫描电镜(×1 500)Fig.3 Scanning electron micrograph of LJ-G1 (×1 500)
菌株LJ-G1革兰氏染色及扫描电镜观察结果分别见图2、3。菌株LJ-G1为革兰氏阴性,单个或成排,呈条棒状,为杆菌。有报道产雌马酚菌株多为革兰氏阳性杆菌属,如蔡莉[9]、孙逊[18]、Tamura[19]等的报道,革兰氏阴性菌株的报道较少,Wang Xiuling等[20]从一个健康女性粪样中分离出1株革兰氏阴性杆状厌氧细菌Julong732。
由图3A可知,菌株大小(0.6~0.9)μm×(2.0~20.0)μm,单个或成对,菌体呈棒状,顶端圆或尖,能形成短链,偶见长链,不产芽孢,鞭毛周生(图3B)。
2.4.2 菌株的生理生化反应
菌株LJ-G1生理生化反应结果见表3。LJ-G1不产生吲哚,不能利用柠檬酸盐、赖氨酸、苯丙氨酸及尿素,不能水解淀粉,硫化氢实验阴性;此菌株可利用鸟氨酸,并发酵葡萄糖及乳糖产生气体,能液化明胶。

表3 菌株LJ-G1生理生化反应结果Table 3 Physiological and biochemical characterization of strain LJ-G1
2.4.3 16S rDNA测序结果

图4 DNA提取胶Fig.4 Electrophoretic analysis ofextracted DNA
提取菌株总DNA及PCR产物结果如图4、5所示。菌株LJ-G1的基因组提取完整、未降解,可用做PCR扩增的模版。且PCR扩增得到大小约1 500 bp的产物,与细菌16S rDNA大小相符,进一步测序验证,将菌株的16S rDNA序列与NCBI数据库中已有数据在线比对,结果显示菌株LJ-G1的16S rDNA与Enterobacter sp.、Bacterium fjat-scr-2、Enterobacter amnigenus、Bacterium hswx111、Uncultured gamma proteobacterium的同源性达到99%,由16S rDNA核苷酸序列构建系统发育树结果如图6所示。

图5 PCR产物鉴定Fig.5 Identification of PCR products
图6 基于16SrDNA序列同源性的细菌系统发育树Fig.6 Phylogenetic tree of strains based on the 16S rDNA sequences
根据16S rDNA测定结果,菌株LJ-G1与肠杆菌属(Enterobacter Hormaeche and Edwards)同源性达99%,结合LJ-G1的形态特征及生理生化反应鉴定结果,再查阅《常见细菌系统鉴定手册》得出:LJ-G1菌株属于河生肠杆菌(Enterobacter amnigenus)。
3 结 论
从素食者粪便中分离出能利用大豆异黄酮产雌马酚的肠道菌LJ-G1,更适于采用麦康凯培养基、厌氧平板划线培养法分离筛选。培养条件pH 7.3、温度37 ℃、厌氧培养36 h,在此条件下培养基中雌马酚产出量较高达10 μg/mL以上。菌株革兰氏染色呈阴性,根据16S rDNA测序结果,LJ-G1与肠杆菌属(Enterobacter Hormaeche and Edwards) 同源性达99%,依据形态学及生理生化反应,结合《常见细菌系统鉴定手册》得出LJ-G1菌株为河生肠杆菌(E. amnigenus)。素食者产雌马酚肠道菌其他菌株的分离、鉴定及生长特性研究有待后续工作的进一步研究。
此外在研究过程中发现,未添加底物的空白组雌马酚检出呈阳性,但检出量较低,说明粪样中或培养基成分中含有大豆异黄酮以外的其他底物,还有待探讨。
[1] 黄娜, 尤春玲. 大豆异黄酮代谢产物: 雌马酚的功能作用研究[J]. 农产品加工: 学刊, 2008(3): 50-53.
[2] 冯晓慧, 蔡东联. 雌马酚的生物活性和临床应用[J]. 氨基酸和生物资源, 2009, 31(2): 72-75.
[3] NAGATA C, UENO T, UCHIYAMA S, et al. Dietary and lifestyle correlates of urinary excretion status of equol in Japanese women[J]. Nutricion Hospitalaria, 2008, 60: 49-54.
[4] RAFII F, DAVIS C, PARK M, et al. Variations in metabolism of the soy isoflavonoid daidzein by human intestinal microfloras from different individuals[J]. Archives of Microbiology, 2003, 180: 11-16.
[5] van de MERWE J P, STEGEMAN J H, HAZENBERG M P. The resident faecal flora is determined by genetic characteristics of the host: implications for Crohn’s disease? [J]. Antonie Van Leeuwenhoek, 1983, 49: 119-124.
[6] 金迪. 172名上海居民尿中大豆异黄酮及其代谢产物雌马酚的调查研究[D]. 上海: 第二军医大学, 2009.
[7] SETCHELL K D, COLE S J. Method of defining equolproducer status and its frequency among vegetarians[J]. Journal of Nutrition, 2006, 136: 2188-2193.
[8] MATTHIES A, BLAUT M, BRAUNE A. Isolation of a human intestinal bacterium capable of daidzein and genistein conversion[J]. Appllied and Environmental Microbiology, 2009, 75(6): 1740-1744.
[9] 蔡莉, 张玉梅. 雌马酚产出相关细菌研究进展[J]. 世界华人消化杂志, 2010, 18(13): 1360-1365.
[10] YU Z T, YAE W, ZHU W Y. Isolation and identification of equolproducing bacterial strains from cultures of pig faeces[J]. FEMS Microbiology Letters, 2008, 282(1): 73-80.
[11] YOKOYAMA S, SUZUKI T. Isolation and characterization of a noel equol-producing bacterium from human feces[J]. Bioscience Biotechnology and Biochemistry, 2008, 72(10): 2660-2666.
[12] 孙小燕, 张逊, 姚文. 产雌马酚菌株发酵豆粕及产物提取工艺研究[J]. 畜牧与兽医, 2010, 42(6): 31-36.
[13] 李笑梅, 张娜, 贾冰心. 测定雌马酚的紫外法建立与应用[J]. 食品工业科技, 2012, 33(24): 52-54.
[14] 李笑梅, 安静. 大豆异黄酮降解液中雌马酚纯化工艺[J]. 食品科学, 2010, 31(14): 135-138.
[15] MINAMIDA K, OTA K, NISHIMUKAI M, et al. Asaccharobacter celatus gen nov., sp nov. isolated from rat caecum[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58: 1238-1240.
[16] 李岩. 人体肠道内产雌马酚菌的分离及其性质的研究[D]. 哈尔滨:东北农业大学, 2012.
[17] 雷正瑜. 16S rDNA序列分析技术在微生物分类鉴定中的应用[D].武汉: 湖北生态工程职业技术学院, 2006.
[18] 孙逊. 猪肠道大豆苷原降解菌分离及其性质研究[D]. 南京: 南京农业大学, 2007.
[19] TAMURA M, TSUSHIDA T, SHINOHARA K. Isolation of an isoflavone-metabolizing, Clostridium-like bacterium, strain TM-40, from human faeces[J]. Anaerobe, 2007, 13: 32-35.
[20] WANG Xiuling, HUR H G, LEE J H, et al. Enantioselective synthesis of S-equol from dihydrodaidzein by a newly isolated anaerobic human intestinal bacterium[J]. Applied and Environmental Microbiology, 2005, 71: 214-219.
Isolation and Identification of An Equol-Producing Bacterial Strain from Vegetarian Intestinal Tract
LI Xiao-mei, JIA Bing-xin
(Key Laboratory of Food Science and Engineering, Harbin University of Commerce, Harbin 150076, China)
An intestinal bacterial strain with the ability to metabolize soy isofl avone to equol was isolated from vegetarian feces. Qualitative and quantitative analysis of equol was performed by ultraviolet spectrophotometry. The isolated strain was identifi ed through naked-eye observation, scanning electron microscope, physiological and biochemical characterization and 16S rDNA full-length sequencing. The results showed that Makanke medium, BHI medium and anaerobic plate streaking cultivation method were suitable for isolating intestinal bacteria producing equol. The optimal culture conditions for enhanced equol production were 10 g of fecal sample diluted in advance to 10-5inoculated into 6 mg of substrate at an initial medium pH of 7.3, followed by anaerobic culture at pH 7.3 for 36 h. The strain was identifi ed as LJ-G1, a Gam-negative bacillus. According to physiological and biochemical properties and referring the Common Bacterial System Identifi cation Manual, LJ-G1 belonged to Enterobacter amnigenus. The results of 16S rDNA full-length sequencing showed 99% homology with the intestinal bacterium.
vegetarian; intestinal bacteria; equol; isolation; identifi cation
TS201.3
A
1002-6630(2014)03-0153-04
10.7506/spkx1002-6630-201403031
2013-09-29
黑龙江省自然科学基金项目(C201201);黑龙江省高校科技创新团队建设计划项目(2010td04)
李笑梅(1960—),女,教授,本科,研究方向为食品科学。 E-mail:lixm0451@163.com

