光照对鲜青花椒干燥过程中叶绿素降解的影响
汪 洋,阚建全*
(西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400715)
光照对鲜青花椒干燥过程中叶绿素降解的影响
汪 洋,阚建全*
(西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400715)
以鲜青花椒为原材料,研究在3种单色光黄光、蓝光、紫外光以及日光(复合光)对鲜青花椒干燥过程中色泽和叶绿素及其衍生物含量的变化,以确定光照对鲜青花椒干燥过程中叶绿素降解的影响。结果表明:在整个干燥过程中,鲜青花椒果皮的绿色逐渐褪去,并逐渐变暗;其中,紫外光作用最显著,能使鲜青花椒由绿色转变为褐色;同时,鲜青花椒的叶绿素均有不同程度的降解,其中紫外光干燥能使叶绿素a和叶绿素b降解57.94%;光照会引起叶绿素衍生物的代谢紊乱,包括脱镁叶绿素a、脱镁叶绿酸a和焦脱镁叶绿酸a,在紫外光和日光照射的干燥中,还会产生少量焦脱植基叶绿素a、焦脱镁叶绿素a以及C132-OH脱镁叶绿酸a等褐色衍生物,这些衍生物的积累可能是造成青花椒色泽劣变的主要原因。
鲜青花椒;光照;叶绿素降解;色泽
青花椒(Zanthoxylum schinifolium Sieb.et Zucc)属芸香科(Rrutaceae)花椒属(Zanthoxylum L.)落叶香料植物。花椒果皮中挥发油的含量为0.7%~9.0%,主要为烯烃类、醇类、酮类、环氧化合物类及酯类[1],构成了花椒特有的香气。花椒在全国大部分地区均有种植,其种植面积和产量均较大[2]。
青花椒果实成熟采收时是绿色的,其色泽是衡量青花椒品质最重要的指标之一,但鲜青花椒采后在干燥过程中要很好的保持青花椒所特有的青绿色是很困难的。青花椒果皮中存在的叶绿素是青花椒果皮呈绿色的主要原因,而叶绿素却易发生降解。叶绿素的降解是内因和外部环境因素共 同作用的结果,内因主要包括体内相关酶,以及外部环境因素主要包括光、温度、氧、湿度等因素,分为叶绿素酶降解和光降解两条途径。国内外对于果蔬采后叶绿素酶降解方面[3-5]的研究已较深入,而在光降解方面的研究却较少。光降解途径,又称氧化漂白途径或光漂白途径[6],光对叶绿素的漂白作用普遍存在于高等植物体内。研究表明紫外线对离体叶绿素的破坏作用最大,其次是可见光中的蓝光、红光、红外线的破坏作用较小[7]。对于叶绿素光降解的研究主要集中在自由基和活性氧上,认为过量的光能使叶绿素成为三线态,通过电子传递,产生单线态氧、超氧自由基等活性氧破坏DNA、蛋白质及膜脂等的分子结构,引起叶绿素分子的降解[8-10]。但目前,光照对于鲜青花椒干燥过程中叶绿素降解的影响,国内外都还没有相关的研究报道。因此,本实验拟开展光照对鲜青花椒干燥过程中色泽和叶绿素降解影响的研究,对于提高干青花椒的品质和阐明叶绿素光降解途径具有较重要的作用。
1 材料与方法
1.1 材料与试剂
九叶鲜青花椒,产自重庆北碚区静观镇素心村,于7月上旬采摘。
N,N-二甲基甲酰胺、正己烷、乙醚、四丁基溴化铵、醋酸铵等(均为分析纯)、丙酮、甲醇(均为色谱纯) 成都科龙化工试剂厂;叶绿素标准品 美国Sigma公司。
1.2 仪器与设备
自制单色光照箱(内置单色滤光片黄A012J、蓝A0823) 意大利ODL公司;测光计 深圳华盛昌机械实业有限公司;Ultrascan PRO测色仪 美国Hunter Lab公司;分析型液相色谱仪 日本岛津公司;FSH-Ⅱ型匀浆机 江苏金坛市环宇科学仪器厂。
1.3 方法
1.3.1 实验设计
实验设计了黄光、蓝光、紫外光和日光分别照射青花椒至干燥,同等条件下暗处理至干燥作为对照。在光照箱内(图1)选用150 W的溴钨灯作为光源,采用单色光滤光片过滤得不同波长的单色光;将鲜青花椒样品(每份样品鲜质量5.0 g)置于单色光滤光片下方,调整距离,使得黄色光和蓝色光照射鲜青花椒的光照强度为4 000 lx。紫外光的获得采用20 W紫外灯,强度是2 500 lx。环境相对湿度60%,温度40 ℃左右。每3 h取样5.0 g,各3份,连续15 h取样,直至干燥。日光照射条件下,每2 h取样5.0 g,各3份,连续10 h取样至干燥,光照强度、温度和相对湿度每2 h测定1次并记录如表1所示。

图1 光照箱示意图Fig.1 Schematic diagram of illumination box

表1 日光照射的环境条件记录Table 1 Records of environmental conditions with sunlight
1.3.2 青花椒样品色差值的测定[11]
采用Ultroscan PRO测色仪进行测定。选用RSIN-包括镜面反射模式,观察面积4.826 mm,滤光片位置:微量的。实验指标为国际CIE Lab色度空间中的L*、a*、b*值。每个样品中选取20颗青花椒样品进行测量,每颗测一次。
1.3.3 水分含量的测定[12]
参考GB 5009.3—2010《食品安全国家标准 食品中水分的测定》方法。
1.3.4 叶绿素及其衍生物含量的测定
1.3.4.1 标准曲线的绘制[13-14]
色谱条件:色谱柱,GL Sciences column(ODSSP,4.6 mm×250 mm,5 øm);检测器:SPDM20A型二极管阵列(photo-diode array,PDA);RF-10AXL型荧光检测器,激发波长为440 nm,发射波长为660 nm,与PDA一同使用;洗脱液:A相为甲醇-水-离子对(8∶1∶1,V/V),其中,离子对为含有0.05 mol/L四丁基溴化铵和1.0 mol/L醋酸铵的水溶液;B相为甲醇-丙酮(1∶1,V/V);洗脱程序:0~35 min,B相由0%线性增加到100%,35~50 min,100% B,50~60 min,100% A;洗脱液流速:0~30 min,1 mL/min,30~50 min,0.6 mL/min,50~60 min,1 mL/min;柱温35 ℃,进样量10 øL。
通过实验,叶绿素a的标准曲线方程为Y=0.140 27+2.590 28×10-5X(R2=0.999 7);叶绿素b:Y=0.012 27+6.698 9×10-5X(R2=0.999 4);脱植基叶绿素a、焦脱植基叶绿素a:Y=-0.052 85+1.715 06×10-5X(R2=0.998 5);脱植基叶绿素b:Y=0.067 91+3.764 64× 10-5X(R2=0.998 1);脱镁叶绿酸a、焦脱镁叶绿酸a、C132-OH-脱镁叶绿酸a:Y=6.280 37×10-16+1.249 24×10-5X(R2=0.997 9);脱镁叶绿素a、焦脱镁叶绿素a:Y= 0.11+2.39×10-5X(R2=0.9964);式中:Y为叶绿素浓度/(mol/L),X为峰面积。
1.3.4.2 青花椒样品叶绿素类的提取[15]
青花椒样品5.0 g,加入用MgCO3饱和过的N,N-二甲基甲酰胺(N,N-dimethyl-formamide,DMF)40 mL,匀浆后抽滤。置滤液于分液漏斗中,加入50 mL正己烷洗涤3次后,在DMF相中加入其2倍体积的预冷(0 ℃)的饱和食盐水,再加入40 mL乙醚-正己烷(1∶1,V/V)的提取叶绿素。提取液用30 mL蒸馏水洗涤3次,然后加入3 g无水硫酸钠干燥5 min。然后在低于30 ℃条件下蒸干有机溶剂,溶残余物于丙酮中并定容至5 mL,即得叶绿素类待测样品。
1.3.4.3 叶绿素含量测定
采用液相色谱法定量分析,方法同1.3.4.1节。计算公式如下。

式中:Y为标准曲线查得的溶液中叶绿素或其衍生物的浓度/(mol/L);V为样品提取液体积/mL;M为叶绿素或其衍生物的分子质量/(g/mol);m表示样品质量/g。
1.4 数据处理
实验均重复3次(颜色指标重复20次),实验数据处理和分析在Excel(2003)和Origin 8.0软件中进行处理与分析。
2 结果与分析
2.1 青花椒干燥过程中水分含量随时间的变化

图2 青花椒在避光(暗光)、单色光以及复合光(日光)干燥条件下其水分含量随时间的变化Fig.2 Change in water content of green prickleyash during drying in darkness, monochromatic light and sunshine
由图2可知,新鲜青花椒和干青花椒的水分含量(湿基含水量)分别为59.6%和6.05%。
2.2 青花椒干燥过程中颜色变化

图3 青花椒干燥过程中L*值的变化Fig.3 Change in L* value of green prickleyash during drying
由图3可知,鲜青花椒在干燥过程中,其L*值呈下降趋势,表明其色泽越来越暗。其中,紫外光照射下L*值下降最为明显(从57.61降至30.69),其次为黄色光(从57.61降至33.83)。日光照射干燥模式中,L*值从57.61仅降至42.49,与遮光(暗)干燥青花椒差别不大(L*值从57.61降至41.85)。由此可知,紫外波段和黄光波段的光对干燥过程中青花椒的亮度影响较大。

图4 青花椒干燥过程中a*值的变化Fig.4 Change in a* value of green prickleyash during drying
由图4可知,在鲜青花椒的光照干燥过程中,其a*值均呈增加趋势,表明青花椒的绿色渐渐褪去。紫外光照射对青花椒色泽影响最大,干燥完成后,其a*值从-8.35增大至1.96,此时青花椒已无明显绿色。其次是复合光,使a*值从-8.35增大至-0.87,青花椒颜色依然为绿色。黄光照射干燥的青花椒颜色最绿。

图5 青花椒干燥过程中b*值的变化Fig.5 Change in b* value of green prickleyash during drying
由图5可知,在青花椒的干燥过程中,b*值逐渐减小,表明青花椒的颜色逐渐由蓝色向黄色过渡。紫外光照射干燥完成后,其b*值从34.17减小至15.4。遮光干燥完成后,其b*值从34.17减小至23.18。
2.3 青花椒干燥过程中叶绿素及其衍生物的变化
2.3.1 青花椒干燥过程中叶绿素的变化
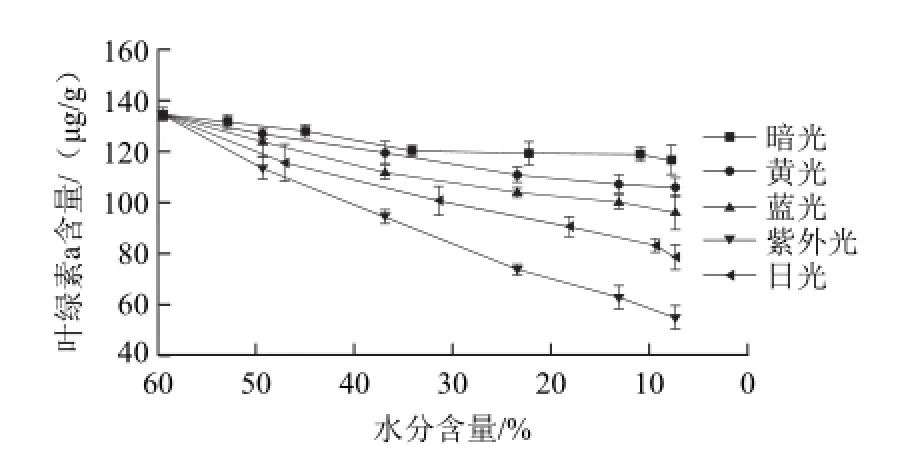
图6 青花椒干燥过程中叶绿素a含量的变化Fig.6 Change in chlorophyll a content of green prickleyash during drying
由图6可知,紫外光干燥模式使鲜青花椒叶绿素a降解得最多,其含量从134.65 øg/g降至55.04 øg/g。其次日光干燥模式中,其含量从134.65 øg/g降至78.62 øg/g。遮光干燥条件下,其含量从134.65 øg/g仅降至 116.67 øg/g。由图7可知,紫外光干燥模式使鲜青花椒叶绿素b降解得最多,其含量从50.18 μg/g降至22.7 øg/g。其次黄光干燥模式中,其含量从50.18 øg/g降至31.6 øg/g。遮光干燥条件下,其含量从50.18 øg/g仅降至41.64 øg/g。

图7 青花椒干燥过程中叶绿素b含量的变化Fig.7 Change in chlorophyll b content of green prickleyash during drying
由图6、7可知,遮光以及不同光照条件都会引起青花椒干燥过程中叶绿素a、b的降解。黄光波段的光更易使青花椒体内叶绿素b降解,而日光(复合光)更易作用于青花椒体内的叶绿素a。但是由于青花椒体内叶绿素a的含量是叶绿素b的2倍以上,所以对于叶绿素a和叶绿素b总量降解作用大小依次为紫外光、复合光、蓝光和黄光。

图8 青花椒干燥过程中叶绿素含量的变化Fig.8 Change in chlorophyll content of green prickleyash during drying
图8 显示了不同干燥条件下青花椒在干燥过程中体内叶绿素a和叶绿素b降解的情况。在遮光干燥条件下,青花椒体内的叶绿素a和叶绿素b总量降解得最少,从184.83 øg/g降至158.31 øg/g,紫外光照射干燥条件下,青花椒体内的叶绿素a和叶绿素b总量降解得最多,从184.83 øg/g降至77.74 øg/g。
2.3.2 青花椒干燥过程中叶绿素衍生物的变化
脱植基叶绿素a和脱植基叶绿素b是叶绿素脱去植基后的产物[16],颜色分别为蓝绿色和黄绿色,其在青花椒干燥过程中的含量变化分别如图9、10所示。在所有的干燥条件下,脱植基叶绿素a和脱植基叶绿素b的含量均在不断减小,除了避光干燥条件下脱植基叶绿素b含量有1.27 øg/g,其他条件下均只有微量残留或无法检测出。另外,在光照(包括单色光和复合光)条件下与避光条件下,脱植基叶绿素a和脱植基叶绿素b含量的减少趋势以及减少量差异不大,表明光照对于脱植基叶绿素a和脱植基叶绿素b的代谢没有显著影响。
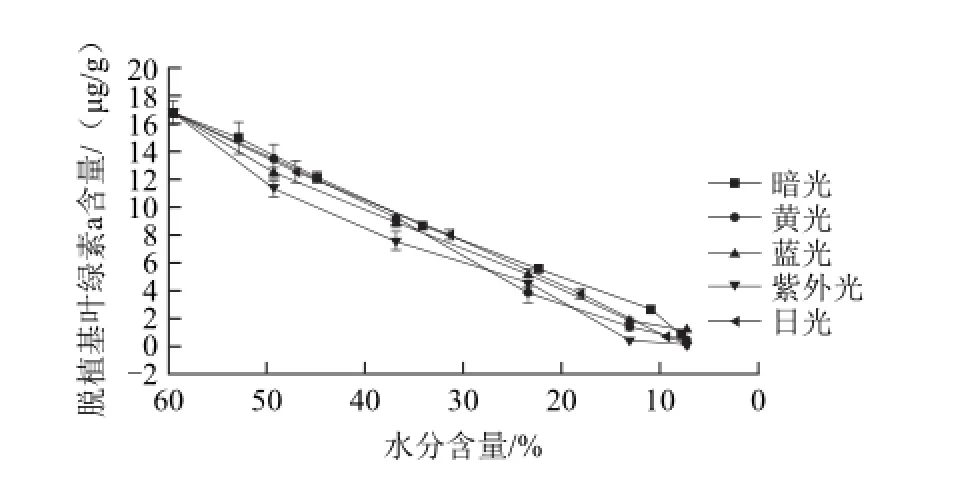
图9 青花椒干燥过程中脱植基叶绿素a含量的变化Fig.9 Change in chlorophyllide a of green prickleyash during drying

图10 青花椒干燥过程中脱植基叶绿素b含量的变化Fig.10 Change in chlorophyllide b of green prickleyash during drying
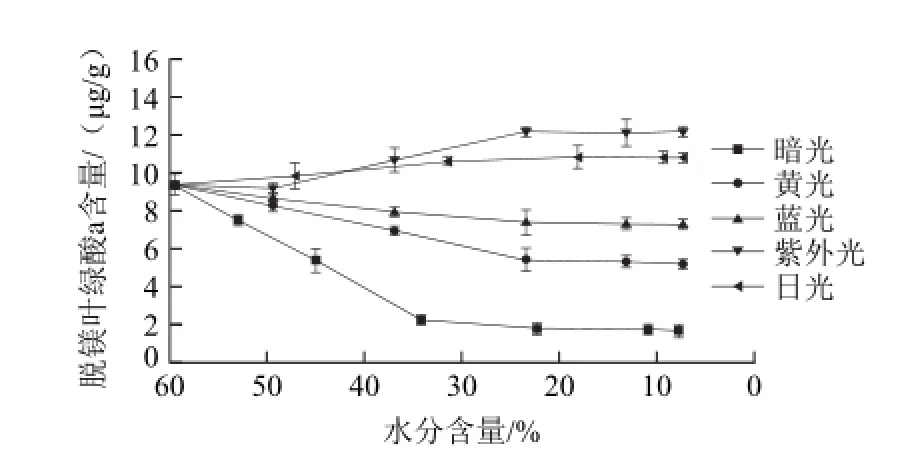
图11 青花椒干燥过程中脱镁叶绿酸a含量的变化Fig.11 Change in pheophorbide a of green prickleyash during drying
由图11可知,脱镁叶绿酸a是脱植基叶绿素a脱去镁之后的产物。在避光干燥过程中,脱镁叶绿酸a含量从9.42 øg/g下降到1.66 øg/g。在光照干燥过程中,蓝光和黄光光照引起脱镁叶绿酸a含量的下降趋势减缓,而紫外光和日光光照引起脱镁叶绿酸a含量的增大,尤其是紫外光,使青花椒体内脱镁叶绿酸a含量从9.42 øg/g增加到12.21 øg/g。由此可知,光照会引起青花椒体内脱镁叶绿酸a不同程度的代谢障碍,使其产生一定的积累。由于脱镁叶绿酸a呈黄褐色,脱镁叶绿酸a的积累会影响青花椒的色泽。
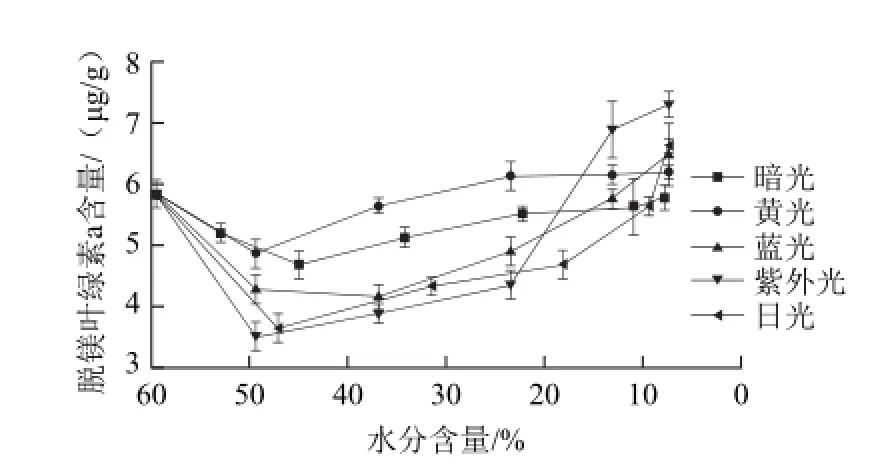
图12 青花椒干燥过程中脱镁叶绿素a含量的变化Fig.12 Change in pheophytin a content of green prickleyash during drying
由图12可知,在不同的干燥模式中,其变化大体上都呈现先减后增的趋势。避光干燥模式中,在干燥后的青花椒体内脱镁叶绿素a的含量与鲜青花椒的含量几乎没有变化。而在光照干燥模式中,脱镁叶绿素a的含量均有不同程度的增大,其中,紫外光干燥过程中,脱镁叶绿素a的含量从5.84 øg/g增加到7.3 øg/g。由于脱镁叶绿素a也呈现黄褐色,也会对青花椒的颜色产生一定的影响。脱镁叶绿素a广泛的存在于植物细胞的各个生长阶段。

图13 青花椒干燥过程中焦脱植基叶绿素a含量的变化Fig.13 Change in pyrochlorophyllide a content of green prickleyash during drying process
由图13可知,脱植基叶绿素a脱去甲酯基就形成焦脱植基叶绿素a。在鲜青花椒体内未检测出焦脱植基叶绿素a,避光干燥以及黄光和蓝光干燥条件下也未检出。且在复合光及紫外光干燥过程中,焦脱植基叶绿素a的产生也只是少量的,含量均不到3 øg/g。由于不含紫外线的单色光照射并未使青花椒体内产生焦脱植基叶绿素a,所以其产生与紫外线有关,并与可能日光中的环境温度高有关,致使日光干燥的青花椒体内积累的焦脱植基叶绿素a最多[17]。
由图14可知,脱镁叶绿酸a脱去甲酯基即形成焦脱镁叶绿酸a。在鲜青花椒体内,焦脱镁叶绿 酸a的含量不到1 øg/g,遮光干燥过程中,其含量变化不大。而在紫外光干燥模式中,其含量增加到7.46 øg/g。而其他光照条件也能使焦脱镁叶绿酸a的含量有不同条件的增加。

图14 青花椒干燥过程中焦脱镁叶绿酸a含量的变化Fig.14 Change in pyropheophorbide a content of green prickleyash during drying
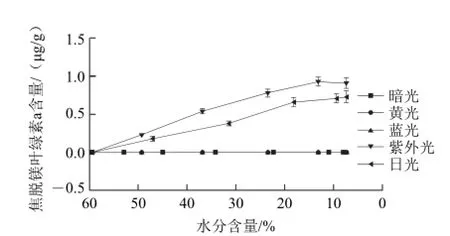
图15 青花椒干燥过程中焦脱镁叶绿素a含量的变化Fig.15 Change in pyropheophytin a content of green prickleyash during drying
由图15可知,脱镁叶绿素a脱去甲酯基即形成焦脱镁叶绿素a。在鲜青花椒体内未检测出焦脱镁叶绿素a,避光干燥条件以及黄光和蓝光干燥下也未检出。在紫外光和日光干燥条件下,会产生少量的焦脱镁叶绿素a。

图16 青花椒干燥过程中C13 -OH-脱镁叶绿酸a含量的变化Fig.16 Change in C132-OH-pheophytin a content of green prickleyash during drying
由图16可知,脱镁叶绿酸a 13号2位碳原子上的-H被氧化为-OH,即生成C132-OH脱镁叶绿酸a。在鲜青花椒体内未检测出C132-OH脱镁叶绿酸a,避光干燥条件以及黄光和蓝光干燥下也未检出。在紫外光和日光干燥条件下,会产生少量的C132-OH脱镁叶绿酸a。
由以上分析可知,在光照干燥模式中,脱植基叶绿素a和脱植基叶绿素b的代谢几乎未受到影响,而脱镁叶绿酸a出现了一定的积累现象,说明光照会使脱镁叶绿酸a的代谢出现异常,可能是生成量增多或是后续反应受到抑制,特别是在紫外光干燥和复合光干燥过程中,脱镁叶绿酸a的含量有少量的增加。同时,在光照干燥中,青花椒体内焦脱镁叶绿酸a的含量也有不同程度的增加,而在避光干燥过程中,焦脱镁叶绿酸a的含量变化不大,说明在光照影响下,部分脱镁叶绿酸a转化为焦脱镁叶绿酸a。另外,在日光和紫外光干燥条件下,产生了少量焦脱植基叶绿素a、焦脱镁叶绿素a以及C132-OH脱镁叶绿酸a等一些褐色叶绿素衍生物。这与紫外光干燥条件下,青花椒果皮颜色转为褐色的现象相符。其次是在日光干燥中,褐色叶绿素衍生物也有一些积累,可能是由于其中有较强的紫外光,也可能同时受该条件下干燥环境温度较高以及光照强度大的影响。
3 结 论
在青花椒干燥过程中,其体内的叶绿素逐渐降解,紫外光干燥模式下变化最大,在干燥结束后,其色泽从绿色变为褐色,叶绿素a和叶绿素b总共降解了57.94%,而避光干燥中仅降解了14.35%。其他干燥模式中,干燥后的青花椒色泽仍为绿色,复合光(日光)干燥条件下,叶绿素a和叶绿素b总共降解了37.86%,蓝光干燥中降解了29.43%,黄光干燥中降解了25.56%。表明紫外光在青花椒干燥过程中对于其叶绿素降解起着重要作用。
另外,在光照干燥模式中,青花椒体内一些叶绿素的衍生物的代谢也受到了不同程度的影响。其中,脱植基叶绿素a和脱植基叶绿素b的代谢几乎未受到影响,而脱镁叶绿酸a出现了一定的积累现象,焦脱镁叶绿酸a的含量也有不同程度的增加。另外,在日光和紫外光干燥条件下,产生了少量焦脱植基叶绿素a、焦脱镁叶绿素a以及C132-OH脱镁叶绿酸a等一些褐色叶绿素衍生物。
[1] 王宇, 巨勇, 王钊. 花椒属植物中生物活性成分研究近况[J]. 中草药, 2002, 33(7): 666-670.
[2] 毕君, 赵京献, 王春荣, 等. 国内外花椒研究概况[J]. 经济林研究, 2002, 20(1): 46-48.
[3] HÖRTENSTEINER S, KRÄUTLER B. Chlorophyll breakdown in higher plants[J]. Biochimica et Biophysica Acta, 2011, 1807: 977-988.
[4] BARRY C S. The stay-green revolution: recent progress in deciphering the mechanisms of chlorophyll degradation in higher plants[J]. Plant Science, 2009, 176: 325-333.
[5] ROCA M, JAMES C, PRUŽ INSK˘ A, et al. Analysis of the chlorophyll catabolism pathway in leaves of an introgression senescence mutant of Lolium temulentum[J]. Phytochemistry, 2004, 65: 1231-1238.
[6] NI Xinzhi, QUISENBERRY S S, MARKWELL J, et al. in vitro enzymatic chlorophyll catabolism in wheat elicited by cereal aphid feeding[J]. Entomologia Experimentalis et Applicata, 2001, 101: 159-166.
[7] 黄持都, 陈计峦, 胡小松, 等. 光对采后果蔬叶绿素降解动力学研究[J]. 农业工程学报, 2008, 24(10): 233-238.
[8] RONTANI J F. Visibile light-dependent degradation of lipidic phytoplandtonic components during senescence: a review[J]. Phytochemistry, 2001, 58(2): 187-202.
[9] WADE N L. Membrane lipid composition and tissue leakage of preand early-climacteric banana fruit[J]. Postharvest Biology Technology, 1995, 5: 139-147.
[10] RONTANI J F, CUNY P, GROSSI V. Identification of a “pool” of lipid Phytoproducts in senescent phytoplandtonic cells[J]. Organic Geochemistry, 1998, 29: 1215-1225.
[11] CHEN Kewei, ZHANG Fusheng, KAN Jianquan. Characterization of chlorophyll breakdown in green prickleyashes (Zanthoxylum schinifolium Sieb.et Zucc) during slow drying[J]. European Food Research and Technology, 2012, 234: 1023-1031.
[12] GB 5009.3—2010 食品安全国家标准 食品中水分的测定[S].
[13] ARKUS K A J, CAHOON E B, JEZ J M. Mechanistic analysis of wheat chlorophyllase[J]. Archives of Biochemistry and Biophysics, 2005, 438: 146-155.
[14] FRASER M S, FRANKL G. Detection of chlorophyll derivatives in soybean oil by HPLC[J]. Journal of the American Oil Chemists’Society (JAOCS), 1985, 62: 113-121.
[15] ROCA M, GANDUL-ROJAS B, MINGUEZ-MOSQUERA M I. Varietal differences in catabolic intermediates of chlorophylls in Olea europaea (L.) fruit cvs. Arbequina and Blanqueta[J]. Postharvest Biology and Technology, 2007, 44: 150-156.
[16] SUZUKI T, KUNIEDA T, MURAI F, et al. Mg-dechelation activity in radish cotyledons with artificial and native substrates, Mg-chlorophyllin a and chlorophyllide a[J]. Plant Physiology Biochemistry, 2005, 43: 459-464.
[17] HORNERO-MÉNDEZ D, GANDUL-ROJAS B, M¸NGUEZMOSQUERA M I. Routine and sensitive SPE-HPLC method for quantitative determination of pheophytin a and pyropheophytin a in olive oils[J]. Food Research International, 2005, 38: 1067-1072.
Chlorophyll Breakdown in Green Prickleyash with Illumination during Drying
WANG Yang, KAN Jian-quan*
(Chongqing Key Laboratory of Produce Processing and Storage, College of Food Science, Southwest University, Chongqing 400715, China)
The effect of light on chlorophyll breakdown in green prickleyash during drying was investigated by examining changes in peel color and the contents of chlorophylls and their derivatives. The results showed the green color of the peel faded and chlorophylls underwent degradation. The peel color changed from brilliant green to brown and the content of chlorophylls decreased by 57.94% after UV illumination. The metabolism of some derivatives such as pheophorbide a, pheophytin a and pyropheophorbide a was disordered because of the illumination. In addition, the contents of pyropheophytin a, pyrochlorophyllide a and C132-OH-pheophytin a increased slightly, and the browning might contribute to the deterioration of peel color.
green prickleyashes; illumination; chlorophyll; color
TS202.1
A
1002-6630(2014)03-0010-06
10.7506/spkx1002-6630-201403003
2012-11-19
国家自然科学基金面上项目(31071599)
汪洋(1987—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:beast2009@163.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品化学与营养学、食品生物技术。E-mail:ganjq1965@163.com

