山楂果胶的抗氧化活性
董银萍,李拖平*
(1.辽宁大学生命科学院,辽宁 沈阳 110036;2.辽宁大学食品科学系,辽宁 沈阳 110036)
山楂果胶的抗氧化活性
董银萍1,2,李拖平2,*
(1.辽宁大学生命科学院,辽宁 沈阳 110036;2.辽宁大学食品科学系,辽宁 沈阳 110036)
目的:研究山楂果胶的体内外抗氧化活性。方法:离体条件测定山楂果胶对O2-·、DPPH自由基和·OH的清除能力;利用高脂小鼠模型考察山楂果胶在生物体内的总抗氧化能力。结果:山楂果胶离体条件对O2-·、DPPH自由基和·OH表现出显著的清除作用。山楂果胶能显著提高小鼠肝脏谷胱甘肽(glutathione,GSH)的含量和抗氧化酶类谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)的活性,并可显著降低小鼠肝脏丙二醛(malondialdehyde,MDA)的含量。结论:山楂果胶具有显著的体内外抗氧化活性,在功能食品等领域具有良好的应用前景。
山楂果胶;抗氧化;脂质过氧化
山楂(Crataegus)属蔷薇科山楂属,全世界约有280多个种[1]。在我国山楂是药果兼用树种,按地理位置、气候特点和栽培利用等情况,大致可分为吉辽、京津冀、鲁苏、中原、云贵高原5个山楂产区。山楂中果胶含量达6.4%,居所有水果之首[2]。果胶是一种多聚半乳糖醛酸,相对分子质量约为50 000~300 000。果胶的独特化学性质与化学构造[3]使其作为胶凝剂、增稠剂、稳定剂和乳化剂等,广泛应用于食品和化妆品行业。此外,果胶还具有较好的抗腹泻[4]、抗癌[5]、减肥降脂[6]作用,在医药领域用于防止有毒阳离子中毒,防止血液凝固以及治疗便秘[7]。
正常情况下,生物体内处于氧化与抗氧化的动态平衡状态,使组织免受损伤。机体受到损伤可使活性氧自由基增多,造成脂质过氧化反应的发生[8]。GSH可通过供H+拮抗氧自由基毒性,终止自由基连锁反应,其本身则被GSH-Px氧化成GSSG,同时促进H2O2的分解,保护细胞膜的结构及功能不受过氧化物的干扰及损害,从而起到抗氧化保护肝脏的作用[9-10]。CAT同样可以催化H2O2分解成氧和水,存在于所有已知动物的组织细胞过氧化物体内[11],特别在肝脏中以高浓度存在。SOD是生物体内重要的抗氧化酶,能有效清除超氧阴离子自由基,抑制脂质的过氧化物作用[12]。GSH-Px、SOD和CAT一起共同构成生物体内的活性氧防御系统。
有研究表明苹果果胶具有较强的活性氧消除能力[13]。一种来源于大叶海草(Seagrass Zostera marina)的果胶可以降低小鼠肝脏的过氧化产物丙二醛的水平[14]。但有关山楂果胶抗氧化活性的研究还未见报道。本实验就山楂果胶的体内外抗氧化活性进行研究,以期为山楂果实深加工利用提供新的途径。
1 材料与方法
1.1 材料与试剂
山楂果实,采自沈阳市近郊;动物饲料 北京华阜康生物科技股份有限公司。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl,DPPH) 阿法埃莎(天津)化学有限公司;氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT) 国药集团化学试剂有限公司;GSH测定试剂盒、GSH-Px活性测定试剂盒、SOD活性测定试剂盒、CAT活性测定试剂盒、MDA含量测定试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 动物
雄性昆明种小鼠60只,由北京华阜康生物科技股份有限公司提供;小鼠的饲养环境保持室温(22±1)℃,相对湿度50%~60%,自然采光。适应性喂养1周后开始进食受试物。
1.3 仪器与设备
CP114电子天平 奥豪斯(中国)有限公司;722N可见分光光度计 上海光谱仪器有限公司;TGL-16M高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;DW-FL270超低温冰箱 中科美菱低温科技有限责任公司。
1.4 方法
1.4.1 山楂果胶的制备
参照王娜等[15]的方法,以热水直接搅拌法提取可溶性果胶。即将干燥的山楂粉末用氯仿-甲醇溶液(1∶1,V/V,70℃加热环流),再用乙醚进行脱脂脱色处理数次,直到溶液的红色全部消失为止,后进行干燥。经脱脂后的山楂果粉加入20倍体积的热蒸馏水(95 ℃)充分搅拌提取4 h,提取液经离心(4 000 r/min)后回收上清液。将提取液浓缩,边搅拌边加入2倍体积的95%乙醇,室温下静置4 h,离心,回收沉淀。所得沉淀再加入70%乙醇漂洗数次,回收沉淀经无水乙醇进一步脱水、离心丙酮洗脱、抽滤、滤渣干燥即得白色热水可溶性果胶。用苯酚-硫酸法[16]测得其总糖含量为92.2%,用咔唑比色法[17]测得其半乳糖醛酸含量为70.4%。
1.4.2 动物喂养与取样
实验随机分为5组,每组12只,分别为空白组、高脂对照组和低(50 mg/kg)、中(150 mg/kg)、高(300 mg/kg)3个剂量山楂果胶组。空白组给予普通饲料,其余各组均给予高脂饲料,小鼠自由饮食饮水。低、中、高3个剂量山楂果胶组每天灌胃山楂果胶,空白组和高脂对照组灌胃等量蒸馏水。实验于10周后结束,小鼠提前24 h禁食不禁水,断颈椎处死,迅速解剖取出所需脏器,用预冷生理盐水洗去血渍、滤纸吸干,液氮速冻,置-80 ℃冰箱保存。
1.4.3 山楂果胶离体抗氧化能力的测定
1.4.3.1 山楂果胶对O2-·清除能力的测定
参照杨宁等[18]的方法,向干燥的试管内依次加入0.5 mol/L磷酸盐缓冲液(pH 7.8)、0.13 mol/L蛋氨酸、2.0×10-5mol/L核黄素、7.0×10-4mol/L NBT、不同质量浓度(0.1、1、10 mg/mL)的待测样品各0.4 mL和蒸馏水1.0 mL,混合均匀。以未加蛋氨酸和样品溶液的体系为空白,以未加样品液的体系为对照。将混合液在35 ℃、4 000 lx光照下还原20 min后以黑暗终止反应,在560 nm波长处测定其吸光度。超氧自由基的清除率按式(1)进行计算。
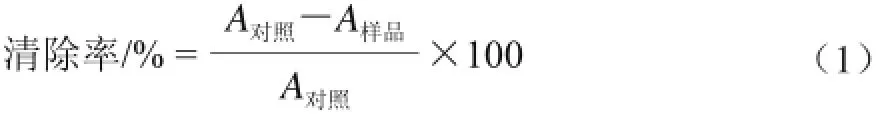
1.4.3.2 山楂果胶对DPPH自由基清除能力的测定
按照杜丽娟等[19]的方法,吸取不同浓度的待测样品0.5 mL,加入2.0 mL 0.2 mmol/L的DPPH-乙醇(60%)溶液中,混合均匀,静置30 min后在517 nm波长处测定其吸光度(A样品)。以相同比例的待测样品与60%乙醇的混合溶液为对照(A对照)、以DPPH溶液与60%乙醇的混合液为空白(A空白)。DPPH自由基的清除率按式(2)进行计算。

1.4.3.3 山楂果胶对·OH清除能力的测定
参考颜军等[20]的方法,分别取不同质量浓度的待测样品1 mL,1.8 mmol/L FeSO4溶液2 mL,1.8 mmol/L水杨酸-乙醇1.5 mL,最后加入H2O2(0.03%)0.1 mL启动反应,振荡混合均匀后在37 ℃保温30 min,以蒸馏水代替样品管为对照(A对照),在510 nm波长处测定其吸光度(A样品)。羟自由基的清除率计算公式同式(1)。
1.4.4 山楂果胶体内抗氧化能力的测定
采用二硫代二硝基苯甲酸法测定GSH、还原型GSH消耗法测定GSH-Px活性、黄嘌呤氧化酶法测定SOD活性、钼酸铵法测定CAT活性、硫代巴比妥酸法测定MDA含量。操作过程严格按照试剂盒说明书进行。
1.5 数据分析
2 结果与分析
2.1 山楂果胶离体条件下的抗氧化能力
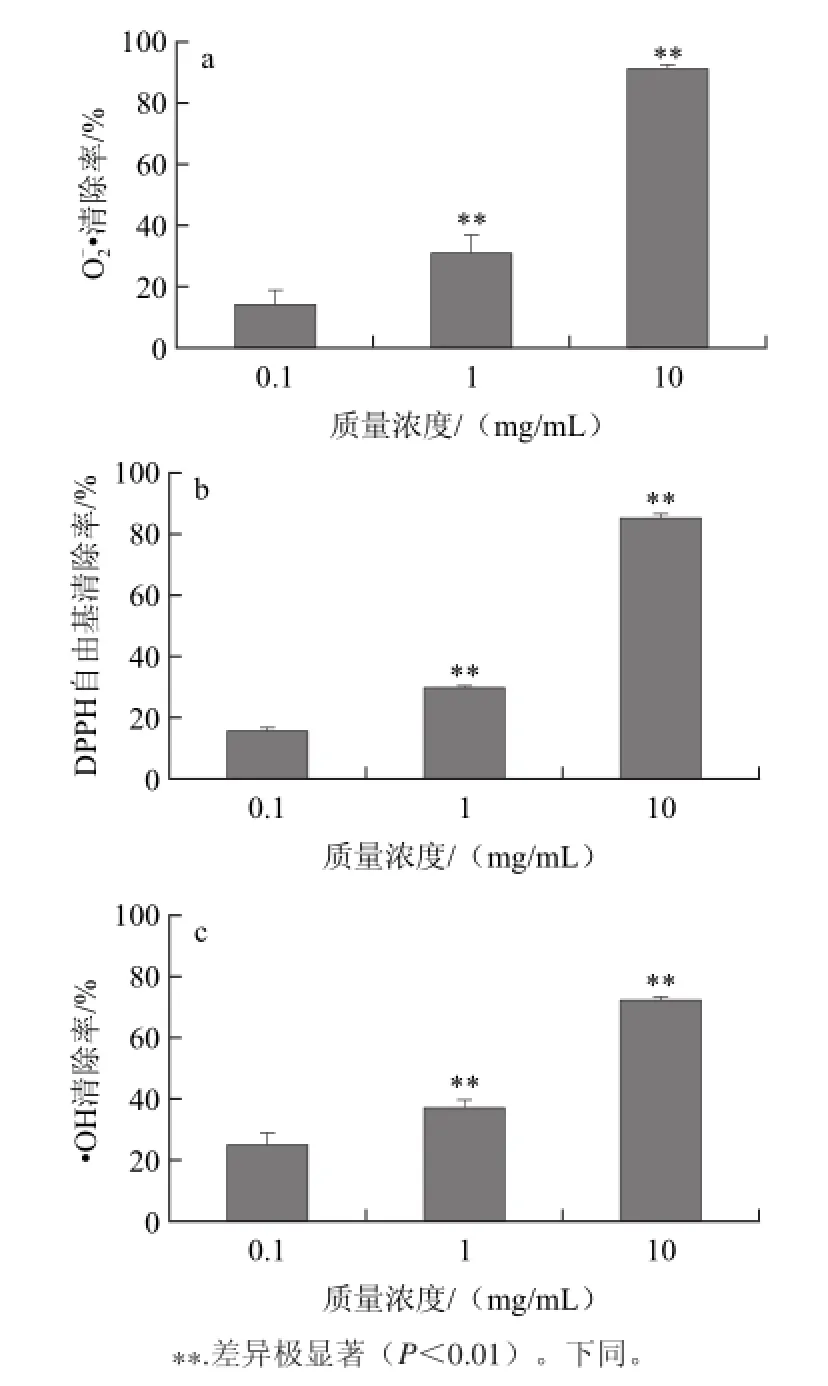
图1 山楂果胶对自由基的清除作用Fig.1 Free radical scavenging activities of haw pectin
由图1a可知,山楂果胶对O2-·清除作用随着质量浓度增加而增强。1 mg/mL山楂果胶对O2-·的清除作用达到30%,与低质量浓度(0.1 mg/mL)相比效果显著(P<0.01);而当质量浓度达到10 mg/mL时,清除率为91%。由图1b可知,与山楂果胶清除O2-·的趋势相同,山楂果胶分解物在高质量浓度(10 mg/mL)条件下能表现出显著的抗氧化活性(P<0.01),而在低质量浓度(0.1 mg/mL)条件下作用并不明显。由图1c可知,山楂果胶对·OH具有明显的清除作用,随着样品质量浓度的增加,清除率明显升高,中质量浓度(1 mg/mL)、高质量浓度(10 mg/mL)与低质量浓度(0.1 mg/mL)相比效果极显著(P<0.01)。高质量浓度山楂果胶(10 mg/mL)对·OH的清除率为72%。
2.2 山楂果胶体内抗氧化能力
2.2.1 山楂果胶对小鼠肝脏GSH含量的影响
由图2可知,高脂对照组小鼠肝脏GSH含量较空白组显著下降。而与高脂对照组相比,山楂果胶3个剂量组的GSH含量均显著增加,但各剂量之间差异并不明显。山楂果胶能将小鼠肝脏内GSH含量提高至210 μg/g,具有有效的抗氧化作用。
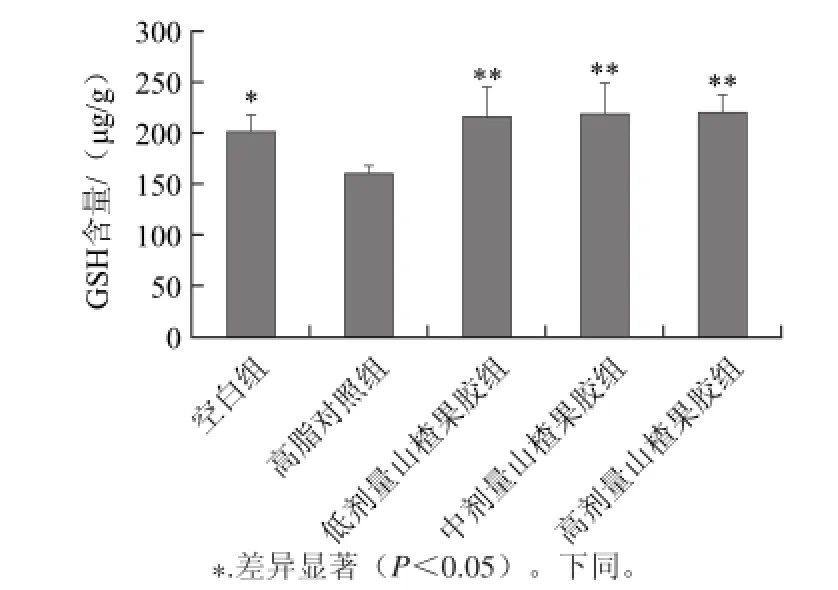
图2 山楂果胶对小鼠肝脏GSH含量的影响Fig.2 Effect of haw pectin on GSH content in the liver of mice
2.2.2 山楂果胶对小鼠肝脏抗氧化酶类活性的影响

图3 山楂果胶对小鼠肝脏抗氧化酶类活性的影响Fig.3 Effect of haw pectin on antioxidant enzyme activities in the liver of mice
由图3a可知,高脂对照组较空白组小鼠肝脏GSH-Px活性显著下降。与上述小鼠肝脏GSH含量趋势相类似,中剂量和高剂量山楂果胶组GSH-Px活性显著增加(P<0.05,P<0.01)。GSH-Px能催化GSH对氢过氧化物的还原反应,使机体免受过氧化物的损伤。由图3b可知,高脂对照组小鼠肝脏CAT活性明显下降;给予山楂果胶后,中剂量(150 mg/kg)山楂果胶组的CAT活性显著提高(P<0.01),但低剂量和高剂量山楂果胶组与高脂模型组相比差异并不显著。由图3c可知,小鼠肝脏SOD活性随山楂果胶灌胃剂量的增加而增加。低、中剂量组SOD活性与高脂对照组相比无显著性差异,而高剂量则显著(P<0.05)地提高了肝脏SOD活性。
2.2.3 山楂果胶对小鼠肝脏MDA含量的影响

图4 山楂果胶对小鼠肝脏MDA含量的影响Fig.4 Effect of haw pectin on MDA content in the liver of mice
由图4可知,高脂对照组小鼠肝脏MDA含量显著高于空白组(P<0.05)。山楂果胶3个剂量组均能显著降低中小鼠肝脏MDA,特别是高剂量果胶组MDA含量低于对照组近50%。
3 讨 论
自由基是游离存在的含有不配对电子的基团,它们在体内有很强的氧化反应能力,易对蛋白质、脂质和核酸等产生伤害,从而引起机体损伤[21]。有研究表明从苹果渣中提取的苹果果胶对DPPH自由基具有显著的清除作用,其抑制作用在一定范围内呈质量浓度依赖关系[22]。本实验中,高质量浓度(10 mg/mL)的山楂果胶对O2-·、DPPH自由基和·OH这3种自由基均表现出显著的清除效果,其清除率分别达到91%、84%和72%,表明山楂果胶具有较强的的抗氧化及清除自由基的活性功能。
脂质过氧化代谢产物如丙二醛,会引起蛋白质、核酸等生命大分子的交联聚合,造成组织细胞膜结构的损伤,引起细胞功能失调甚至破裂、死亡,从而导致组织细胞功能的损伤[23]。当体内抗氧化能力增强,抗氧化酶活性增高时,可阻止脂质过氧化或降低脂质过氧化产物的含量。机体对活性氧O2-·的第一道防线是SOD,它将O2-·转化为H2O2和其他氢过氧化物;第二道防线是CAT和GSH-Px,其中CAT可清除过氧体系中的H2O2,而GSH-Px分布在细胞的胞液和线粒体中,可同时清除H2O2和氢过氧化物,从而有效地保护机体[24]。本研究结果显示,山楂果胶可以显著的提高小鼠肝脏抗氧化酶系统GSH、GSH-Px、CAT和SOD的活性,说明山楂果胶抗氧化活性的机制之一是提高了抗氧化系统的酶活力;同时山楂果胶显著增加了肝脏GSH含量。有研究表明,果胶可显著降低大鼠血清丙二醛水平并且降低其体内的脂质过氧化水平[25]。本研究就山楂果胶对小鼠肝脏中过氧化产物MDA含量的研究也发现了相似的趋势,证明山楂果胶不仅能有效调节小鼠肝脏抗氧化活性,而且表现出一定的剂量效应。
综合本实验结果推测山楂果胶可能是通过提高抗氧化酶活性,增加抗氧化活性物质GSH含量达到体内清除自由基的效果,进而起到增强生物体内抗氧化能力,抑制脂质过氧化的效果。本研究结果为以山楂为原料的食疗保健食品的开发提供了有效的理论基础与科学根据。此外,我国有着丰富的山楂资源,选用山楂为原料,对山楂果胶进行提取开发,无论是鉴于提高山楂的精深加工利用效率与经济转换价值,还是天然抗氧化剂市场的需求,都具有巨大的经济效益和社会效益。
[1] 张培成, 徐绥绪. 山楂叶化学成分研究[J]. 药学学报, 2001, 36(10): 754-757.
[2] 于铭章. 果胶对山楂加工的影响[J]. 河北林果研究, 2009, 24(3): 309-310.
[3] 李拖平, 王娜, 李苏红, 等. 山楂果胶的黏度特性及其与化学构造的关联性[J]. 食品科学, 2008, 29(1): 64-68.
[4] SCHULTZ A A, ASHBY-HUGHES B, TAYLOR R, et al. Effects of pectin on diarrhea in critically ill tube-fed patients receiving antibiotics[J]. American Journal of Critical Care, 2000, 9(6): 403-411.
[5] 黄志良, 刘海鹰. 改良柑橘果胶抑制小鼠结肠癌肝转移的作用研究[C]//全国大肠癌治疗规范高峰论坛暨第九届广东省大肠癌学术研讨会论文汇编. 广州: 中山大学, 2007: 56-59.
[6] KRZYSIK M, GRAJETA H, PRESCHA A, et al. Effect of cellulose, pectin and chromium(III) on lipid and carbohydrate metabolism in rats[J]. Journal of Trace Elements in Medicine and Biology, 2011, 25(2): 97-102.
[7] 林曼斌, 黄传香. 用超声波、盐析法提取仙人掌果胶的研究[J]. 广州食品工业科技, 2003, 19(4): 50-53.
[8] NIKI E. Lipid peroxidation and its inhibition: overview and perspectives[J]. Journal of Oleo Science, 2001, 50(5): 313-320.
[9] LIANG Qingning, SHENG Yuchen, JIANG Ping, et al. The genderdependent difference of liver GSH antioxidant system in mice and its influence on isoline-induced liver injury[J]. Toxicology, 2011, 280(1): 61-69.
[10] SCANDALIOS J G. Oxygen stress and superoxide dismutases[J]. Plant Physiology, 1993, 101(1): 7-12.
[11] 杨小军, 贺喜, 何丽霞, 等. 日粮添加多不饱和脂肪酸对肉仔鸡抗氧化指标的影响[J]. 动物营养学报, 2008, 20(3): 299-304.
[12] 马森. 谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展, 2008, 29(10): 53-56.
[13] 田泽贤次. 苹果果胶的抑癌作用与活性氧抑制作用[J]. 日本医学介绍, 2004, 25(2): 66-68.
[14] KHASINA E I, KOLENCHENKO E A, SGREBNEVA M N, et al. Antioxidant activities of a low etherified pectin from the seagrass Zostera marina[J]. Russian Journal of Marine Biology, 2003, 29(4): 259-261.
[15] 王娜, 张陈云, 戚雨妲, 等. 山楂果胶的提取及其食品化学特性[J].食品工业科技, 2007, 28(11): 87-89, 92.
[16] 李丹. 苯酚-硫酸法测定食品总糖方法的应用和改进[J]. 中国卫生检验杂志, 2003, 13(4): 506-506.
[17] 王文平, 郭祀远, 李琳, 等. 野木瓜多糖中糖醛酸含量测定[J]. 食品科技, 2007, 32(10): 84-86.
[18] 杨宁, 赵谋明, 刘洋, 等. 野生仙人掌多糖抗氧化性研究[J]. 食品科技, 2007, 32(2): 147-150.
[19] 杜丽娟, 李拖平, 王娜, 等. 山楂果胶分解物抗氧化作用研究[J]. 食品研究与开发, 2009, 30(6): 18-20.
[20] 颜军, 苟小军, 邹全付, 等. 分光光度法测定Fenton反应产生的羟基自由基[J]. 成都大学学报: 自然科学版, 2009, 28(2): 91-93.
[21] 李勇, 孔令青, 高洪, 等. 自由基与疾病研究进展[J]. 动物医学进展, 2008, 29(4): 85-88.
[22] RHA H J, BAE I Y, LEE S, et al. Enhancement of anti-radical activity of pectin from apple pomace by hydroxamation[J]. Food Hydrocolloids, 2011, 25(3): 545-548.
[23] 李晓, 冯雷, 胡尊丽, 等. 马齿苋多糖的抗氧化活性研究[J]. 中国生化药物杂志, 2010, 31(4): 244-246.
[24] 张彬, 谭琼, 李丽立, 等. 金属硫蛋白对奶牛血液抗氧化酶GSH-Px和CAT基因表达的影响[J]. 草业学报, 2010, 19(3): 132-138.
[25] 李春明, 管春梅, 郑晶, 等. 果胶对大鼠血脂及抗氧化功能的影响[J].中国公共卫生, 2004, 20(6): 721-723.
Antioxidant Activity of Haw Pectin in vitro and in vivo
DONG Yin-ping1,2, LI Tuo-ping2,*
(1. College of Life Science, Liaoning University, Shenyang 110036, China; 2. Department of Food Science, Liaoning University, Shenyang 110036, China)
Objective: To explore the antioxidant activity of haw pectin in vitro and in vivo. Methods: The free radical scavenging activities of haw pectin on superoxide anion, DPPH and hydroxyl radicals were detected. The in vivo antioxidant activity was investigated in high-fat-diet-fed mouse model. Results: Haw pectin showed significant free radical scavenging activities against all the three radical species. It also significantly increased the content of glutathione (GSH) and the antioxidant enzyme activities of glutathione peroxidase (GSH-Px), superoxide dismutase (SOD) and catalase (CAT). Moreover, it significantly decreased malondialdehyde (MDA) content in the liver of mice. Conclusion: Haw pectin has great potential for the development of functional foods due to its excellent antioxidant activity.
haw pectin; antioxidation; lipid peroxidization
Q539.8
A
1002-6630(2014)03-0029-04
10.7506/spkx1002-6630-201403006
2013-04-20
国家自然科学基金面上项目(C200102/31071521);辽宁省食品生物加工工程中心项目;沈阳市重点实验室项目(F11-235-1-00)
董银萍(1989—),女,硕士研究生,研究方向为食品营养学。E-mail:dyp513829091@gmail.com
*通信作者:李拖平(1967—),男,教授,博士,研究方向为食品化学与营养。E-mail:ltp0401@126.com

