膜醭毕赤酵母与壳聚糖复合处理对柑橘果实防御酶及防御物质的影响
彭 茹,张 璐,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
膜醭毕赤酵母与壳聚糖复合处理对柑橘果实防御酶及防御物质的影响
彭 茹1,张 璐1,曾凯芳1,2,*
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
研究膜醭毕赤酵母与壳聚糖复合处理对柑橘果实防御酶和防御物质的影响。采用损伤接种与无损伤浸泡复合液两种处理方式,分别研究经复合处理后果实防御酶和防御物质在7 d和28 d贮藏期内的变化。结果显示:与对照果实相比,复合液接种处理果实中的苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、几丁质酶、β-1,3葡聚糖酶(GLU)等防御酶在贮藏期内活性增加明显,其中以PAL、POD、GLU 3 种防御酶最为明显,在贮藏第3天时均达到最大值;复合液浸泡处理果实中的PAL、POD、几丁质酶活性和木质素含量的增加较为明显,在贮藏第14天时达到最大值。结果表明,膜醭毕赤酵母与壳聚糖复合处理能够诱导柑橘果实中防御酶活性和防御物质含量的升高,从而起到提高果实抗病性的效果。防御酶在果实贮藏前期发挥较关键的抗病作用,而酚类、木质素等防御类物质则在贮藏后期发挥抗病作用。
诱导抗病性;防御酶;防御物质;柑橘果实
果蔬在受到外界物理因素、化学因素和生物因素等刺激后,启动自身防御系统,产生相关防御酶和防御物质以抵抗外界不利因素对自身的影响,这就是果蔬的诱导抗病性[1]。过氧化物酶(peroxidase,POD)是一类催化很多化学反应发生的氧化还原酶,能够清除果蔬体内的H2O2,减少过量的活性氧对果蔬造成的毒害作用,并且与抗性物质木质素的合成相关[2]。多酚氧化酶(polyphenoloxidase,PPO)能够将果蔬中的游离酚类氧化为对病原菌毒害性更强的醌类物质,增加对病原菌的抵抗性[3]。苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)是苯丙烷代谢途径的第一步关键酶,它能够调控相关抗性物质的合成如木质素、黄烷酮类化合物等[4]。果蔬病程相关蛋白酶(pathogenesisrelated protein,PRP)家族中的PRP-2、PRP-3分别具有β-1,3葡聚糖酶(β-1,3-glucanase,GLU)和几丁质酶的活性,能够单独或者协同降解真菌细胞壁,从而对病害起到控制作用[5-6]。此类防御酶大多已存在于植物体内,但经过外界诱导后,在果蔬体内能够迅速上升并且积累到一定水平,以抵抗病原菌侵害。此外,果蔬受到刺激后还会产生低分子质量的植保素和木质素等防御物质,具有一定的抗病性[2]。
膜醭毕赤酵母(Pichia membranefaciens)是一种生防酵母、最早从桃上分离,目前研究表明,其对桃[7]的软腐病,柑橘[8]和苹果[9]的青绿霉病有防治作用。除了对病原菌的直接作用外,拮抗酵母作为生物激发子,同时能诱导果实防御酶和防御物质,特别是诱导POD、PAL、几丁质酶和GLU活性的增加[8,10-11]。壳聚糖对采后果蔬病害有控制作用,且壳聚糖具有成膜性,它还能诱导果实产生抗病性[12]。提高拮抗酵母菌的生防效力有多种方法,Ge Lingling等[13]添加0.5%壳聚糖到红酵母培养基或者直接添加到草莓上,显著促进了酵母和草莓的GLU合成,从而降低了草莓发病率。Yu Ting等[14]研究的结果表明,采用罗伦隐球酵母结合赤霉素能诱导梨体内POD和PPO活性的增强。Zong Yuanyuan等[15]用42 ℃热水结合拮抗酵母菌处理番茄,发现番茄灰霉病发病率显著降低,果实中PAL、几丁质酶、GLU 3 种酶活性显著增强。本实验室已有研究证明,膜醭毕赤酵母结合水杨酸和壳聚糖皆有协同增效作用,对柑橘青绿霉病害控制作用加强。但膜醭毕赤酵母复合壳聚糖处理诱导柑橘果实防御酶活性方面却鲜有报道,实验以接种和浸泡酵母菌和壳聚糖复合液两种方式,分别测定柑橘在7 d和28 d贮藏期内防御酶活性和防御物质的变化情况,探讨酵母菌结合壳聚糖防治柑橘果实病害的机理。
1 材料与方法
1.1 材料、菌种与试剂
实验所用柑橘为北碚447#锦橙(Citrus sinensis L. Osbeck cv. Jincheng 447#),果实采摘自重庆北碚缙云山。挑选大小均一、成熟度一致、没有机械伤的果实。
膜醭毕赤酵母 中国普通微生物菌种保藏管理中心;壳聚糖 济南海得贝海洋生物工程有限公司;愈创木酚、邻苯二酚、30% H2O2(均为分析纯) 成都科龙化工试剂厂;几丁质、L-苯丙氨酸、脱盐蜗牛酶、昆布多糖、溴乙酰(均为分析纯) 北京拜尔迪生物有限公司。
1.2 方法
1.2.1 膜醭毕赤酵母与壳聚糖复合液的制备
膜醭毕赤酵母的活化:从斜面培养基上接1 环于营养酵母葡萄糖固体-NYDA培养基(含酵母膏、牛肉膏、葡萄糖、琼脂)上,28 ℃条件下振荡培养48 h;从活化后的NYDA培养基上取3~4 环至为不含琼脂的液体培养基(NYDB)培养基中,28 ℃摇床180 r/min振荡培养24 h。于4 ℃条件下,3 000 r/min离心10 min,并用无菌水清洗2 次,血球板计数浓度109CFU/mL。
壳聚糖:脱乙酰度大于85%,黏度为30 cps,溶于0.1%乙酸,再用pH 5.0的乙酸-乙酸钠缓冲液稀释成质量浓度为0.02 g/100 mL的壳聚糖。
复合液:用109CFU/mL酵母和0.02 g/100 mL壳聚糖等比例(1:1)混合,得到最终5×108CFU/mL酵母和0.01 g/100 mL壳聚糖复合液。
1.2.2 处理方法
1.2.2.1 打孔接种处理
参照Droby等[16]的方法,将果实用清水清洗后在2%次氯酸钠中浸泡2 min,再用纯水将次氯酸钠清洗干净,晾干。用70%酒精在赤道周围擦拭1 圈,将提前用酒精擦拭消毒后的打孔器在果实赤道周围打6 个孔,孔径宽度为4 mm,深度为5 mm。分别注入30 μL复合液和无菌水(对照组)。放置2 h待处理液充分吸收,套袋装框,于20℃条件下贮藏。每组取样5 个果实。
1.2.2.2 浸泡处理
将果实用清水清洗后在2%次氯酸钠中浸泡2 min,再用纯水将次氯酸钠清洗干净,晾干。将果实放置于复合液和无菌水中浸泡2 min,自然风干,待处理液充分吸收2 h。套袋装框,于20 ℃条件下贮藏。每组取样5 个果实。
1.2.3 指标测定
1.2.3.1 PAL活性测定
PAL活性测定参考Assis等[17]的方法并做适当修改,以每小时每克柑橘果皮组织(鲜质量)酶促反应体系290 nm波长处吸光度增加0.01为1 个PAL活性单位(U),以鲜质量计。
1.2.3.2 POD活性和PPO活性测定
POD活性测定参照Srivastava等[18]的方法并做适当修改。以每分钟吸光度变化1为一个酶活力单位(U)。PPO活性测定参考Zauberman等[19]的方法,以每分钟吸光度变化1为一个酶活力单位(U)。
1.2.3.3 几丁质酶活性和GLU活性测定
酶提取液制备:称取1.0 g柑橘果皮,加入4 mL200 mmol/L,pH 5.2的醋酸缓冲液。在冰浴条件下研磨匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液用于几丁质酶和GLU活性测定。几丁质酶活性测定参考Boller等[20]方法并修改。以每秒钟每克蛋白分解胶状几丁质产生1×10-9mol Glc-NAc为一个酶活性单位(U)。重复3 次。GLU活性测定参考Abeles等[21]的方法并做修改,以每秒钟每毫克蛋白分解昆布多糖产生1×10-9mol葡萄糖为1个酶活性单位(U)。
1.2.3.4 总酚含量测定
总酚含量的测定参照Pirie等[22]的方法,称取2 g果皮与预冷的50 mL的1% HCl-甲醇溶液充分研磨,在4 ℃、12 000 r/min离心10 min,上清液上分光光度计比色,以A280nm/g为一个单位,以鲜质量计。
1.2.3.5 木质素含量测定
木质素含量测定参照Morrison等[23]的方法,并作修改。以每克鲜质量在280 nm波长处的吸光度表示木质素含量。
1.2.4 数据统计及图形分析
以上所有实验均重复3 次,并用Excel 2003统计分析所有数据,计算标准误并制图;应用SPSS 11.5软件对数据进行方差分析,利用邓肯式多重比较对差异显著性进行分析。P<0.05表示差异显著。
2 结果与分析
2.1 膜醭毕赤酵母与壳聚糖复合处理对柑橘果皮PAL活性的影响

图1 膜醭毕赤酵母与壳聚糖接种处理(A)和浸泡处理(B)对柑橘果皮PAL活性的影响Fig.1 Effect of Pichia membranefaciens in combination with chitosan on PAL activities in citrus fruit peel inoculated (A) or dipped (B)
PAL是苯丙氨酸代谢途径的关键酶,调控次生代谢产物类黄酮植保素和木质素的合成,是植物重要的防御酶之一。如图1所示,膜醭毕赤酵母复合壳聚糖接种处理和浸泡处理的柑橘果实PAL活性均高于对照组,且呈现先上升后下降的趋势;而对照组果实的PAL活性一直处于较低水平。膜醭毕赤酵母复合壳聚糖接种处理贮藏第3天和浸泡处理第14天,果实的PAL活性分别比对照组高7.6 倍和7.3 倍。
2.2 膜醭毕赤酵母与壳聚糖复合处理对柑橘果皮POD活性的影响

图2 膜醭毕赤酵母与壳聚糖接种处理(A)和浸泡处理(B)对柑橘果皮POD活性的影响Fig.2 Effect of Pichia membranefaciens in combination with chitosan on POD activities in citrus fruit peel inoculated (A) or dipped (B)
如图2A所示,柑橘果皮的POD活性经酵母和壳聚糖复合液接种处理后第3天达到高峰,而对照组的POD活性上升趋势较缓慢;如图2B所示,浸泡处理的果实在28 d的贮藏期内,膜醭毕赤酵母复合壳聚糖处理组和对照组果实的POD活性都呈现先上升后下降的趋势,在贮藏7 d后复合处理组果实的POD活性一直显著高于对照果实,在第14天达到高峰时,复合处理组的POD活性比对照组的高64.4%。
2.3 膜醭毕赤酵母与壳聚糖复合处理对柑橘果皮PPO活性的影响
PPO与植物防御体系密切相关,如图3A所示,在7 d的贮藏期内,膜醭毕赤酵母复合壳聚糖接种处理组与对照组的PPO活性均呈现上升的趋势,但是复合处理果实的PPO活性显著高于对照果实(P<0.05),贮藏第3天时,复合处理组的PPO活性比对照组的高1.95 倍。如图3B所示,膜醭毕赤酵母复合壳聚糖处理组果实的PPO呈现逐渐上升的趋势,而对照组果实的PPO活性在贮藏第14天以后开始下降,经过膜醭毕赤酵母与壳聚糖复合液浸泡后的柑橘果实在贮藏后期PPO活性显著高于对照果实。

图3 膜醭毕赤酵母与壳聚糖接种处理(A)和浸泡处理(B)对柑橘果皮PPO活性的影响Fig.3 Effect of Pichia membranefaciens in combination with chitosan on PPO activities in citrus fruit peel inoculated (A) or dipped (B)
2.4 膜醭毕赤酵母与壳聚糖复合处理对柑橘果皮几丁质酶活性的影响

图4 膜醭毕赤酵母与壳聚糖接种处理(A)和浸泡处理(B)对柑橘果皮几丁质酶活性的影响Fig.4 Effect of Pichia membranefaciens in combination with chitosan on CHI activities in citrus fruit peel inoculated (A) or dipped (B)
几丁质为一般真菌病原菌的细胞壁结构成分之一,果实几丁质酶活性的升高对于病原菌的分解效力增加,因此,几丁质酶是衡量果实诱导抗病性的重要指标。膜醭毕赤酵母复合壳聚糖接种处理和浸泡处理对几丁质酶活性的影响如图4所示,在贮藏期间,接种或者浸泡酵母和壳聚糖复合液后,果实的几丁质酶活性均显著高于对照果实(P<0.05)。如图4A所示,膜醭毕赤酵母复合壳聚糖接种处理组果实的几丁质酶活性在贮藏第2天迅速上升至峰值,比对照组高97.8%。几丁质酶在贮藏第2天达到活性高峰点,随后迅速降低,在贮藏前波动较大,可能是因为几丁质酶活性在诱导后几天内受到刺激迅速达到高峰,与对照相比将活性峰值提前,有利于柑橘前期抗病,之后随着时间的延长而降低。这与Luo Yang等[8]在柑橘上和Pombo等[24]在草莓上处理有相似的结论。如图4B所示,膜醭毕赤酵母复合壳聚糖浸泡处理组和对照组果实的几丁质酶活性皆在前7 d迅速上升,之后变化趋于平缓。在贮藏第7天时,复合处理果实的几丁质酶活性比对照高20%。
2.5 膜醭毕赤酵母与壳聚糖复合处理对柑橘果皮GLU活性的影响
膜醭毕赤酵母复合壳聚糖接种处理和浸泡处理后柑橘果实GLU活性的变化情况如图5所示。复合液接种处理后果实的GLU活性在贮藏期间呈现先升高后降低的趋势,在贮藏第3天时达到峰值,此时的GLU活性比对照组的高4.8 倍;而接种对照组果实的GLU活性一直处于较低的水平(图5A所示)。复合液浸泡处理组果实的GLU活性在贮藏期间也呈现先升高后降低的趋势,在贮藏第21天时达到峰值,此时的GLU活性比对照组的高15.6 倍;而浸泡对照组果实的GLU活性只是在贮藏后期略有升高。
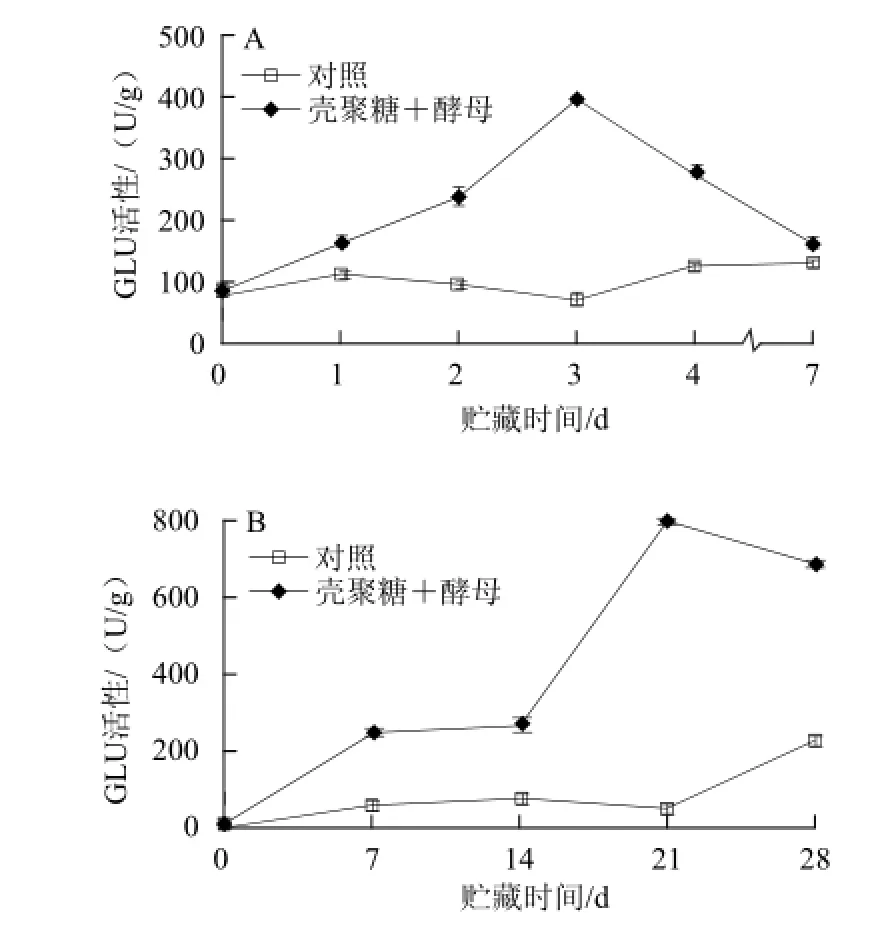
图5 膜醭毕赤酵母与壳聚糖接种处理(A)和浸泡处理(B)对柑橘果皮GLU活性的影响Fig.5 Effect of Pichia membranefaciens in combination with chitosan on GLU activities in citrus fruit peel inoculated (A) or dipped (B)
2.6 膜醭毕赤酵母与壳聚糖复合处理对柑橘果皮总酚含量的影响
果蔬体内的酚类物质是一类具有抑菌活性的低分子质量的抗病化合物。实验结果表明,与对照果实相比,经过膜醭毕赤酵母复合壳聚糖接种处理和浸泡处理后,柑橘果实总酚含量在整个贮藏期间均有明显的上升。如图6A所示,膜醭毕赤酵母复合壳聚糖接种处理果实的总酚含量在贮藏期间处于缓慢波动上升的趋势,到第7天时上升到最大值,比对照高79.2%。总酚的合成受到PAL的调控,总酚亦能在PPO的作用下生成醌类物质,因此,贮藏期间PAL和PPO的合成情况影响着总酚的含量,但总体仍是处于上升的趋势,Luo Yang等[8]在柑橘上得到类似的结论。如图6B所示,膜醭毕赤酵母复合壳聚糖浸泡处理和浸泡对照果实的总酚含量在整个贮藏期间均呈现先升高后降低的趋势,在第14天达到最大值,此时复合处理果实的总酚含量比对照果实的高47.3%。
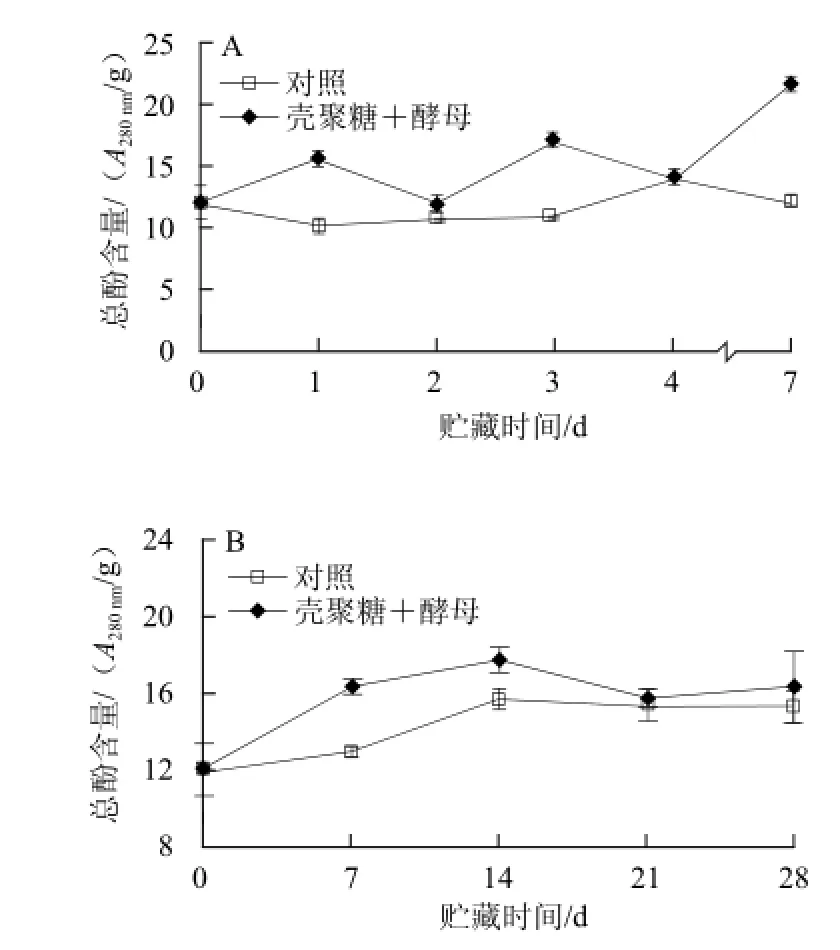
图6 膜醭毕赤酵母与壳聚糖接种处理(A)和浸泡处理(B)对柑橘果皮总酚含量的影响Fig.6 Effect of Pichia membranefaciens in combination with chitosan on total phenolic content in citrus fruit peel inoculated (A) or dipped (B)
2.7 膜醭毕赤酵母与壳聚糖复合处理对柑橘果皮木质素含量的影响
如图7A所示,膜醭毕赤酵母复合壳聚糖接种处理能够诱导贮藏期间柑橘果实木质素的生成,处理组果实的木质素含量呈现逐渐升高的趋势,贮藏第7天时比第0天增加63%;接种对照组果实的木质素含量呈现先升高后降低的趋势,在第3天出现峰值,后迅速降低,在第7天对照组木质素含量下降至比处理组低13%。如图7B所示,膜醭毕赤酵母复合壳聚糖浸泡处理果实的木质素含量在贮藏14 d出现峰值,比对照组高1.23 倍,对照组的木质素含量一直处于较低水平。木质素的合成受到PAL等关键代谢酶的调控,在后期PAL含量降低,导致木质素含量降低,但也有研究[25]认为,木质素的含量可能有两个高峰期,这可能与木质素合成代谢中间产物香豆酸、阿魏酸参与木质素合成的阶段不同有关。
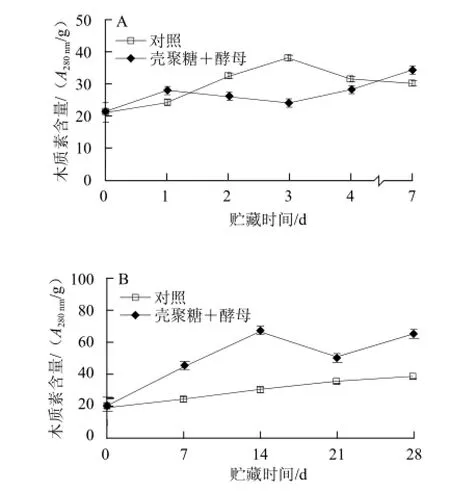
图7 膜醭毕赤酵母与壳聚糖接种处理(A)和浸泡处理(B)对柑橘果皮木质素含量的影响Fig.7 Effect of Pichia membranefaciens in combination with chitosan on lignin content in citrus fruit peel inoculated (A) or dipped (B)
3 讨论与结论
本实验中,复合液损伤接种和浸泡膜醭毕赤酵母的柑橘果实在贮藏期内,PAL、POD、几丁质酶、GLU等防御酶活性及总酚等防御物质都比对照有显著性差异,说明防御系统在柑橘贮藏期发挥了诱导抗病作用。PAL是类黄酮植保素、木质素及多种次生酚类抗病物质代谢途径的关键酶,作为植物抗病性的生化指标,在植物抗逆性、抵御病虫害等方面有重要的作用[5,24]。本实验中复合液接种柑橘果实PAL活性在前3 d达到峰值,后迅速降低,呈现先升高后降低的趋势,此结果与大多数研究相似[8,26],Zong Yuanyuan等[15]用Pichia membranefaciens结合热水处理番茄后果实PAL活性在前几天内出现两个峰值,前期PAL的活性升高能够诱导植保素、木质素等抗性物质的升高。POD能够清除活性氧,同时参与木质素的合成,本实验发现POD在7 d接种诱导中有一个峰值,清除活性氧能力增强,增加抗病性[27],在贮藏后期浸泡处理组也保持较高的水平以诱导木质素的合成;几丁质酶和GLU具有协同抗性作用[8]。实验中,两者活性在贮藏前期有明显升高趋势,以发挥抗病作用,后期下降,这与大多人的研究都相似[28-29]。复合液接种处理后,防御酶变化迅速且明显,但抗性物质总酚和木质素的含量在前期贮藏期中并没有快速达到峰值,但可以看出两者呈上升趋势,这可能与抗性物质自身的合成速度有关,因为次生代谢产物在植物体内的积累是一个缓慢的过程[30]。复合液浸泡处理的果实在贮藏期间,PAL、POD、GLU活性的升高及木质素含量的增加表现明显,贮藏期14 d时,复合液浸泡处理果实的木质素含量开始增加。木质素是复杂的苯丙烷单体聚合物,它的合成是经过苯丙酸途径进行,由苯丙氨酸脱氨开始经过一系列羧基化、甲基化与还原反应等形成几种聚合物单体[25]。因此,木质素含量增加是需要一定合成积累时间,此类聚合物单体相互聚合形成网络结构可以加强果实细胞壁垒,阻碍外界病原菌的侵入,但木质素含量过高则造成果皮木质化,降低果实商品性[31]。复合液浸泡处理果实的总酚含量在贮藏前14 d有明显的升高,随后降低,这可能是总酚在后期被PPO氧化成醌类物质,发挥抗病作用[8]。由此可见,防御酶和防御物质在果实抗病的不同阶段发挥作用,PAL、POD、几丁质酶和GLU活性能够迅速对外界刺激做出反应,在果实贮藏前期发挥较关键的抗病作用,这是因为信号物质将激发子的刺激传递至下游靶酶,并激发相关防御酶基因表达,以合成大量防御酶;而酚类、木质素等防御类物质则在后期才逐渐合成,主要在贮藏后期发挥抗病性。
实验得出以下结论,膜醭毕赤酵母与壳聚糖复合处理能够诱导柑橘果实中防御酶活性和防御物质含量的升高,从而起到提高果实抗病性的效果。防御酶在果实贮藏前期发挥较关键的抗病作用,而酚类、木质素等防御类物质则在贮藏后期发挥抗病作用。
[1] 黄雪梅, 张昭其, 季作梁. 果蔬采后诱导抗病性[J]. 植物学通报, 2002, 19(4): 412-418.
[2] 张继澍. 植物生理学[M]. 北京: 高等教育出版社, 2006: 234.
[3] 王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究进展[J]. 植物学通报, 2005, 22(2): 215-222.
[4] 宋修鹏, 黄杏, 莫凤连, 等. 甘蔗苯丙氨酸解氨酶基因(PAL)的克隆和表达分析[J]. 中国农业科学, 2013, 46(14): 2856-2868.
[5] FAN Qing, TIAN Shiping, LIU Haibo, et al. Production of β-1,3 glucanase and chitinase of two biocontrol agents and their possible modes of action[J]. Chinese Science Bulletin, 2002, 47(4): 292-296.
[6] 赵妍. 拮抗酵母及结合热空气处理对樱桃番茄采后病害的防治及其机理研究[D]. 南京: 南京农业大学, 2010.
[7] FAN Qing, TIAN Shiping. Postharvest biological control of Rhizopus rot of nectarine fruits by Pichia membranefaciens[J]. Plant Disease, 2000, 84(11): 1212-1216.
[8] LUO Yang, ZENG Kaifang, MING Jiang. Control of blue and green mold decay of citrus fruit by Pichia membranefaciens and induction of defense responses[J]. Scientia Horticulturae, 2012, 135: 120-127.
[9] WANG Jie, WANG Hongyan, XIA Xiaoming, et al. Synergistic effect of Lentinula edodes and Pichia membranefaciens on inhibition of Penicillium expansum infections[J]. Postharvest Biology and Technology, 2013, 81: 7-12.
[10] CAO Shifeng, YANG Zhenfeng, HU Zhichao, et al. The effects of the combination of Pichia membranefaciens and BTH on controlling of blue mould decay caused by Penicillium expansum in peach fruit[J]. Food Chemistry, 2011, 124(3): 991-996.
[11] CAO Shifeng, YUAN Yongjun, HU Zhichao, et al Combination of Pichia membranifaciens and ammonium molybdate for controlling blue mould caused by Penicillium expansum in peach fruit[J]. International Journal of Food Microbiology, 2010, 141(3): 173-176.
[12] ZHANG Hongyin, LI Renping, LIU Weimin. Effects of chitin and its derivative chitosan on postharvest decay of fruits: a review[J]. Molecular Sciences, 2011, 12(2): 917-934.
[13] GE Lingling, ZHANG Hongyin, CHEN Keping, et al. Effect of chitin on the antagonistic activity of Rhodotorula glutinis against Botrytis cinerea in strawberries and the possible mechanisms involved[J]. Food Chemistry, 2010, 120(2): 490-495.
[14] YU Ting, WU Pinggu, QI Jiongjiong, et al. Improved control of postharvest blue mold rot in pear fruit by a combination of Cryptococcus laurentii and gibberellic acid[J]. Biological Control, 2006, 39(2): 128-134.
[15] ZONG Yuanyuan, LIU Jia, LI Boqiang, et al. Effects of yeast antagonists in combination with hot water treatment on postharvest diseases of tomato fruit[J]. Biological Control, 2010, 54(3): 316-321.
[16] DROBY S, VINOKU V, WEISS B, et al. Induction of resistance to Penicillium digitatum in grapefruit by the yeast biocontrol agent Candida oleophila[J]. Biological Control, 2002, 92(4): 393-399.
[17] ASSIS J S, MALDONADO R, MUNOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology, 2001, 23(1): 33-39.
[18] SRIVASTAVA M K, DWIVED U N. Delayed ripening of banana fruit by salicylic acid[J]. Plant Science, 2000, 158(l/2): 87-96.
[19] ZAUBERMAN G, FUCHS Y, ROT I, et al. Chilling injury, peroxidase and cellulase activities in the peel of mango fruit at low temperature[J]. Scientia Horticulturae, 1988, 23(4): 732-733.
[20] BOLLER T, GEHRI A, MAUEHS F, et al. Chitinase in bean leaves: induction by ethylene, purification, porperties, and possible function[J]. Planta, 1983, 157(1): 22-31.
[21] ABELES F B, FORRENCE L E. Temporal and hormonal control of β-1,3-glucanase in Phaseolus vulgaris[J]. Plant Physiology, 1970, 45(4): 395-400.
[22] PIRIE A, MULLINS M G. Changes in anthocyanin and phenolic content of grapevine leaf and fruit tissue treated with sucrose, nitrate and abscisic acid[J]. Plant Physiology, 1976, 58(4): 472-486.
[23] MORRISON I M. A semi-micro method for the determination of lignin and its use in predicting the digestibility of forage crops[J]. Journal of the Science of Food and Agriculture, 1972, 23(4): 455-463.
[24] POMBO M A, ROSLI H G, MART¸NEZ G A , et al. UV-C treatment affects the expression and activity of defense genes in strawberry fruit (Fragaria×ananassa, Duch.)[J]. Posthravest Biology and Technology, 2011, 59: 94-102.
[25] 王斌, 张楠, 闫冲冲, 等. 套袋对砀山酥梨果实石细胞发育及木质素代谢的影响[J]. 园艺学报, 2013, 40(3): 531-539.
[26] LU Laifeng, LU Huangping, WU Changqing, et al. Rhodosporidium paludigenum induces resistance and defense-related responses against Penicillium digitatum in citrus fruit[J]. Posthravest Biology and Technology, 2013, 85: 196-202.
[27] 黄艳, 明建, 邓雨燕, 等. 壳寡糖诱导柑橘果实抗病作用中的活性氧变化[J]. 食品科学, 2009, 30(22): 344-349.
[28] COTA I E, TRONCOSOROJAS R, SOTELO-MUNDO R, et al. Chitinase and β-1,3-glucanase enzymatic activities in response to infection by Alternaria alternata evaluated in two stages of development in different tomato fruit varieties[J]. Scientia Horticulturae, 2007, 112: 42-50.
[29] 张红印, 马龙传, 姜松, 等. 臭氧结合拮抗酵母对草莓采后灰霉病的控制[J]. 农业工程学报, 2009, 25(5): 258-263.
[30] 魏建华, 宋艳茹. 木质素生物合成途径及调控的研究进展[J]. 植物学报, 2001, 43(8): 771-779.
[31] 席玙芳, 罗自生, 程度, 等. 竹笋活性氧代谢对木质化的影响[J]. 中国农业科学, 2001, 34(2): 197-199.
Effects of Pichia membranefaciens Combined with Chitosan on Defensive Enzymes and Substances in Citrus Fruits
PENG Ru1, ZHANG Lu1, ZENG Kai-fang1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
The aim of this study was to investigate how combined treatment with Pichia membranefaciens and chitosan could affect defensive enzymes and substances in citrus fruits. The changes of defensive enzymes and substances during 7 and 28 days of storage were examined by inoculating or dipping citrus fruits with Pichia membranefaciens combined with chitosan respectively. The results were reported as follows: compared with the control group, the activities of the defensive enzymes phenylalanine ammonialyase (PAL), peroxidase (POD), polyphenoloxidase (PPO), chitinase, and β-1,3 glucanase in citrus fruits inoculated with Pichia membranefaciens in combination with chitosan were increased significantly during storage. PAL, POD, and β-1,3 glucanase were most evidently increased and reached the maximum on day 3. On the other hand, the activities of PAL, POD and chitinase and lignin content were increased significantly and reached the maximum on day 14 in citrus fruits dipped with Pichia membranefaciens in combination with chitosan. In conclusion, disease resistance in citrus fruits can be enhanced by Pichia membranefaciens combined with chitosan through inducing an increase in defensive enzymes and substances such as phenolics and lignin. Defensive enzymes and substances play a major role in disease resistance in the early and late stages of storage, respectively.
induced defense responses; defensive enzymes; defensive substances; citrus fruit
S609.3;S667.7
A
1002-6630(2014)10-0212-06
10.7506/spkx1002-6630-201410040
2013-10-21
国家自然科学基金面上项目(31271958);重庆市科技攻关(应用技术研发类/重点)项目(cstc2012gg-yyjsB80003);教育部留学回国人员科研启动经费项目(45批)
彭茹(1990—),女,硕士研究生,研究方向为食品科学。E-mail:pengru900715@163.com
*通信作者:曾凯芳(1972—),女,教授,博士,研究方向为农产品加工与贮藏工程。E-mail:zengkaifang@163.com

