富含岩藻糖苹果皮果胶的提取与理化性质
程 洋,张 英,段双艳,黄琳娟,王仲孚
(西北大学生命科学学院,西部资源生物与现代生物技术教育部重点实验室,陕西省生物技术重点实验室,陕西 西安 710069)
富含岩藻糖苹果皮果胶的提取与理化性质
程 洋,张 英,段双艳,黄琳娟,王仲孚*
(西北大学生命科学学院,西部资源生物与现代生物技术教育部重点实验室,陕西省生物技术重点实验室,陕西 西安 710069)
以超声辅助柠檬酸提取法从苹果皮中提取苹果果胶,并对所提取苹果皮果胶进行理化性质测定和分析。在最佳提取条件下(pH 2.5柠檬酸,450 W超声30 min),苹果皮果胶得率为14.6%。理化性质分析表明:所得苹果皮果胶的酯化度为69.9%、糖醛酸含量为58.5%、总糖含量为92.8%,分子质量大于400 kD。气相色谱法分析表明:该方法提取的苹果皮果胶由鼠李糖、岩藻糖、阿拉伯糖、木糖、葡萄糖、半乳糖、葡萄糖醛酸及半乳糖醛酸8种单糖组成,单糖组成的物质的量比为9.5:19.2:4.6:0.1:4.6:3.6:2.3:56.3,岩藻糖含量高达19.2%。而超声法、盐酸法提取的苹果皮果胶中未检测到岩藻糖。进一步研究表明:富含岩藻糖的苹果皮果胶的提取与柠檬酸作萃取剂有一定关系。
苹果皮果胶;提取;岩藻糖;理化性质
中国是一个苹果种植大国,近几年产量一直维持在3 000万t以上,约占世界总产量的40%,同时又是浓缩苹果汁的主要生产及出口国,苹果皮渣是果汁、果酱、果脯等生产加工过程中主要的下脚料,约为总加工量的20%~25%[1]。目前,除少量苹果皮渣被用于饲料及深加工外,绝大部分被遗弃,不仅造成资源的浪费,而且严重污染环境。果皮的主要成分是果胶,是一类以聚半乳糖醛酸为主、结构复杂的多糖聚合物。果胶的食物纤维是维持人体健康的重要物质,具有增强胃肠蠕动促进营养吸收的功能,对防治高血压、肠癌、糖尿病很好的作用。在食品工业中果胶作为凝胶剂、稳定剂、增稠剂已被广泛应用[2]。果胶也被应用于医药产业,研究发现果胶能有效降低心脏病和胆结石发病率[2-3]。
目前,果胶的提取方法主要有水提、酸提及酶法等[1]。其中酸提法由于操作方便、提取效率较高、所用试剂和工具价格低廉,因而应用比较广泛。酸提法是利用稀酸将果皮细胞中的非水溶性原果胶转化成水溶性果胶,然后在果胶液中加入乙醇或多价金属盐类,使果胶以沉淀析出,常用的酸有盐酸、硫酸、亚硫酸、草酸铵等,但是在提取过程中果胶支链容易遭到破坏,影响结构的完整度,并且提取周期长、效率低。此外,传统酸法得到果胶的种类比较单一,很难全面系统评价其理化性质和生物活性,因而限制了果胶的开发利用。
Kumar等[4]研究表明,以pH 2.5的柠檬酸和盐酸为萃取剂提取苹果皮果胶时,发现用柠檬酸提取的苹果皮果胶支链破坏小,更好的保持了果胶结构的完整性。但该方法仍无法克服酸提取法存在的提取液黏度大、生产周期长、效率低等缺陷。而超声法可提高果胶的提取产率和效率[5-7]。Seshadri等[8]研究了超声提取对果胶分散体流变力学和光学的影响,发现超声可改变果胶凝胶流动性,凝胶强度和凝胶时间会随着超声时间的延长而降低,进而提高果胶的溶解度,同时降低了提取液的黏度。
基于此,本研究以柠檬酸萃取和超声辅助提取法结合,从苹果皮中提取富含岩藻糖的苹果皮果胶,确定了最优提取条件;系统地测定了该法所得苹果皮果胶的总糖含量、酯化度、糖醛酸含量、单糖组成等理化性质,并与现有方法进行比较;同时对富含岩藻糖苹果皮果胶的提取机理进行初步探讨。
1 材料与方法
1.1 材料与试剂
陕西礼泉红富士苹果购自陕西省李泉县城果品批发市场;鼠李糖(Rha)、阿拉伯糖(Ara)、木糖(Xyl)、葡萄糖(Glc)、半乳糖(Gal)、硼氢化钠(NaBH4)、正丙胺 上海国药集团;葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)、蓝色葡聚糖(Mr=2 000 kD)、鸡蛋白蛋白 美国Sigma公司;DEAE-52纤维素 上海恒信化学试剂有限公司;Dextran标准品(1、5、12、25、50、80 kD和150 kD) 德国Fluka公司。
1.2 仪器与设备
2695型高效液相色谱仪 美国Waters公司;2010型气相色谱仪 日本岛津公司;EQUINOX 55型傅里叶红外光谱仪 德国Bruker公司。
1.3 方法
1.3.1 苹果皮果胶的提取
水果刀取下新鲜的苹果皮(约厚3 mm),用45 ℃去离子水清洗3 次,90 ℃水浴10~15 min,使果皮中的酶失活,过滤后用温水漂洗除去溶出的糖类、色素及其他杂质[9],真空干燥箱中70 ℃恒温干燥,粉碎后制成干粉,保存于4 ℃冰箱备用。
取苹果果皮干粉5 g,按表1所述方法进行浸提,对各组提取液分别进行浓缩、醇沉、除蛋白等处理[1],得苹果皮果胶。
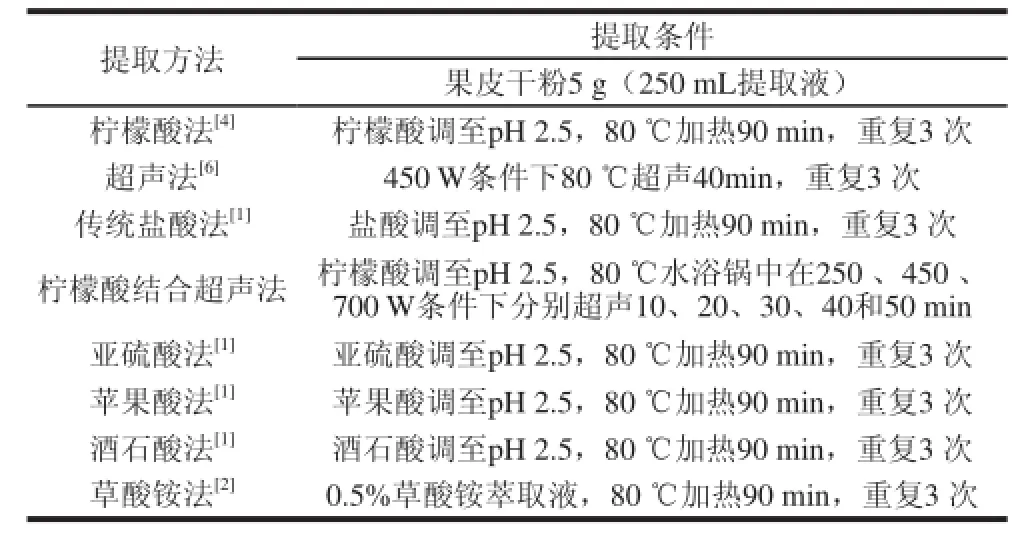
表1 苹果皮果胶的提取方法和条件Table1 Extraction methods and conditions for APs
1.3.2 糖含量、酯化度、糖醛酸含量和分子质量测定
分别采用苯酚-硫酸法[10]、滴定法[11]、间羟联苯法[12]和高效凝胶渗透色谱法法[1]测定苹果皮果胶的总糖含量、酯化度、糖醛酸含量及分子质量。
1.3.3 红外分析
称取2.0 mg样品,在红外干燥箱中去除水分后,采用KBr压片法于4 000~400 cm-1范围内用傅里叶变换红外光谱仪进行红外光谱分析。
1.3.4 单糖组成分析
单糖标准(鼠李糖、岩藻糖、阿拉伯糖、木糖、肌醇、甘露糖、葡萄糖、半乳糖、葡萄糖醛酸及半乳糖醛酸)的衍生:按照同时测定糖醛酸和醛糖的衍生方法进行衍生[10]。
果胶样品的衍生化反应:称取样品4 mg,加入2 mol/L三氟乙酸2 mL,121 ℃密闭水解2 h,将样品中的多糖水解为单糖,然后按测定糖醛酸和醛糖的衍生方法进行衍生[10]。
1.3.5 气相色谱条件
色谱柱:rtx-50柱(30.0 m×0.25 mm,0.25 øm);载气:氮气;分流比19:1;进样口温度270℃;检测器温度280 ℃;升温程序:180 ℃保持2 min,然后以6 ℃/min上升至210 ℃,再以0.3 ℃/min上升至215 ℃,最后以6 ℃/min上升至240 ℃,保持30 min。
2 结果与分析
2.1 超声辅助柠檬酸法提取条件优化
如图1所示,在某一特定的超声功率下,苹果皮果胶的得率在一段时间内随着超声时间的延长(10~40 min)而增加。在250 W条件下超声40 min时,苹果皮果胶达到最高得率13.2%;450 W条件下超声30 min时,达到最高得率14.6%;700 W条件下超声20 min时,达到最高得率13.6%。继续延长超声时间,果胶得率反而降低。结果表明超声辅助柠檬酸法提取苹果皮果胶的产率最大值为14.6%,与传统法相比,产率提高,也节省了提取时间。当产率达到最大值时,继续超声会使产品得率降低,这可能是因为一方面超声时间过长会导致提取液中杂质积累,增加了除蛋白过程中的损失;另一方面可能由于超声时间过长溶液中的果胶会在热降解和超声的剪切效应下部分流失[13]。考虑到苹果皮果胶的提取时间和产率,以pH 2.5的柠檬酸为萃取剂,在450 W超声30 min为最佳提取条件。

图1 超声辅助柠檬酸法中超声时间与功率对果胶产量的影响Fig.1 Effect of extraction time and ultrasound power on the yield of APs
2.2 酯化度测定
酯化度是果胶凝胶特性的重要指标。本实验采用滴定法对苹果皮果胶进行酯化度分析。柠檬酸法、超声提取法、超声辅助柠檬酸提取法和传统盐酸提取法提取的苹果皮果胶酯化度分别为67.4%、71.6%、69.9%和74.4%。超声辅助柠檬酸提取法与柠檬酸、超声和传统盐酸提取法相比,提取所得苹果皮果胶的酯化度变化不大。
2.3 糖醛酸含量分析
苹果皮果胶的糖醛酸含量测定用间羟联苯法。以己糖醛酸标准品含量为横坐标、以对应的标准己糖醛酸溶液有色衍生物的吸光度为纵坐标,绘制标准曲线回归方程为:Y=0.012 9X-0.008 1,相关系数R²=0.999 1。柠檬酸法、超声法、超声辅助柠檬酸法和传统盐酸法提取所得苹果皮果胶的糖醛酸含量分别为56.5%、62.0%、58.5%和76.6%。结果表明用柠檬酸法和超声辅助柠檬酸法提取的苹果皮果胶糖醛酸含量偏低,因而推测这2种方法提取的苹果皮果胶具有更多的中性糖侧链分支,侧链分支降解少。
2.4 分子质量测定分析
采用高效凝胶渗透色谱法对果胶分子质量进行测定。结果表明,用柠檬酸法、超声法、超声辅助柠檬酸法及传统盐酸法提取所得苹果皮果胶的分子质量均大于400 kD。
2.5 糖含量测定
测定苹果皮果胶的总糖含量采用苯酚-硫酸法,以葡萄糖含量为横坐标、以对应葡萄糖吸光度为纵坐标,得线性回归方程为Y=1.863 3X+0.002 2,R²=0.999 1。结果显示,柠檬酸法、超声法、超声辅助柠檬酸法与传统盐酸法提取的苹果皮果胶总糖含量分别为92.1%、91.8%、92.8%和92.7%。
2.6 果胶红外图谱分析

图2 不同提取方法所得果胶的红外图谱分析Fig.2 FTIR spectra of pectins extracted by different methods
如图2所示,4种方法所得苹果皮果胶都具有果胶的特征吸收峰,都在3 620~3 020 cm-1和3 000~2 800 cm-1处有吸收峰,分别为—OH的伸缩振动和糖类的—CH2或—CH3的C—H伸缩振动;1 620~1 550、1 440~1 395、1 400~1 300 cm-1处的吸收峰分别为C=O的非对称伸缩振动、C—O伸缩振动、C=O对称伸缩振动;1 320~1 210 cm-1处的吸收峰为—OH变角振动;1 151.64、1 025.04 cm-1左右都有吸收峰,为吡喃型糖的特征吸收峰,是其糖苷键的C—O—C的非对称振动峰[14]。4种果胶在1 750~1 700 cm-1处有典型的糖醛酸的特征吸收峰。
2.7 苹果皮果胶的单糖组成分析
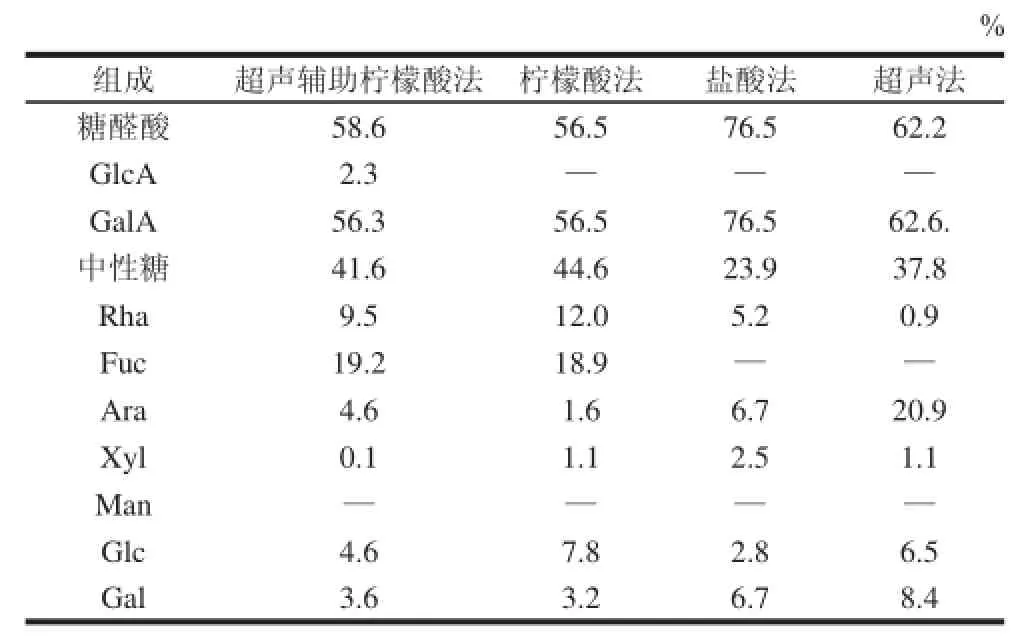
表2 不同方法提取所得苹果皮果胶的单糖组成及含量分析Table2 Monosaccharide components and their contents in pectins extracted by different methods
柠檬酸法、超声法、超声辅助柠檬酸法和传统盐酸法提取所得苹果皮果胶,在单糖组成方面具有较大差异(表2)。柠檬酸法、超声法、超声辅助柠檬酸法和传统盐酸法提取的苹果皮果胶中性糖相对含量分别为44.6%、37.8%、41.6%、23.9%,可见用柠檬酸法、超声辅助柠檬酸法提取的苹果皮果胶中性糖含量明显高于超声法及传统盐酸法。

表3 不同酸法提取的苹果皮果胶单糖组成及含量分析Table3 Monosaccharide components and their contents in APs extracted by different acid methods
以Rha与GalA相对含量比表示果胶的分支程度,比值越高说明分支度更高[15]。结果表明,柠檬酸法、超声辅助柠檬酸法提取的苹果皮果胶中,Rha与GalA物质的量比分别为1:5和1:7;而超声提取法与传统提取法提取的苹果皮果胶中Rha与GalA物质的量比值仅分别为1:16和1:70,因此用柠檬酸法和超声辅助柠檬酸法提取苹果皮果胶能获得更多的支链,果胶局部降解较少。
此外,气相色谱分析结果显示,用柠檬酸法、超声辅助柠檬酸法提取的苹果皮果胶中Fuc含量分别高达18.9%和19.2%。据报道,一般酸法或超声法提取的苹果皮果胶中较少发现Fuc,或者其中的Fuc含量较低[5]。本研究结果表明,用柠檬酸作萃取剂可能是富含岩藻糖果胶得率高的一个主要原因。
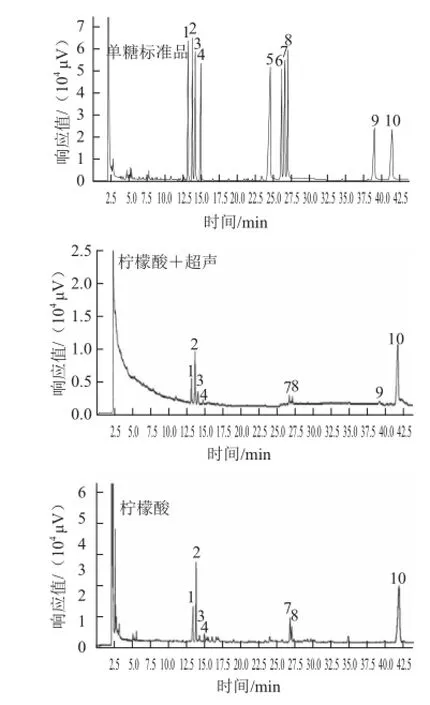

图3 不同提取方法所得果胶的单糖组成色谱图Fig.3 GC Analysis of the monosaccharide compositions of pectins extracted by different methods
为了进一步确认是否以柠檬酸作为萃取剂可得到富含Fuc的苹果皮果胶,分别用pH 2.5的盐酸、亚硫酸、苹果酸、酒石酸为萃取剂提取苹果皮果胶。采用气相色谱法对各种方法所得苹果皮果胶进行单糖组成分析。如表3所示,在盐酸法、亚硫酸法、苹果酸法、酒石酸法提取的苹果皮果胶中,所得的单糖含量及种类具有一定的差异,但均未发现含有Fuc,从而证实了所得的富含Fuc的苹果皮果胶与柠檬酸作为萃取剂有必然关系。
Jean-Pierre等[15]用柠檬酸萃取茶树叶果胶时,发现其中含有一定量Fuc,含量为1.4%。Kurita等[16]提取柑橘皮果胶时,发现用柠檬酸处理2 h后,再用盐酸萃取剂提取柑橘皮果胶,得到的果胶聚合度高,但半乳糖醛酸聚糖结构被破坏,中性糖相对含量显著增加,同时发现Fuc从微量增加到0.8%;还发现用柠檬酸处理的柑橘果胶与未处理过的相比,Ara含量降低了82%,Ara结构单元在酸溶液中发生了大量的降解[16-19],导致柠檬酸提取的苹果皮果胶中含有更多的鼠李半乳糖醛酸聚糖-Ⅰ(RG-Ⅰ)和鼠李半乳糖醛酸聚糖-Ⅱ(RG-Ⅱ)侧链(富含Fuc)。本研究采用柠檬酸结合超声法提取的苹果皮果胶中,Ara相对含量仅为4.6%,进一步证实了用pH 2.5的柠檬酸提取苹果皮果胶时,阿拉伯聚糖结构单元在柠檬酸溶液中发生了大量的降解[20],获得了更多的RG-Ⅰ和RG-Ⅱ侧链,从而得到了富含Fuc的苹果皮果胶,这与Darvill等的研究一致[21]。
3 结 论
本研究以超声辅助柠檬酸法提取得到了富含Fuc的苹果皮果胶,克服了传统法耗时、果胶支链易破坏和结构单一等缺陷,在苹果皮果胶的提取生产研究中有重要的方法参考意义。在450 W超声30 min,苹果皮果胶的产率最高达14.6%。气相色谱分析表明,以柠檬酸法、超声法、超声辅助柠檬酸法和传统盐酸法提取所得的苹果皮果胶中,Rha与GalA的物质的量比分别为1:5、1:16、1:7、1:70,结果显示与超声法和传统盐酸法相比,用柠檬酸法和超声辅助柠檬酸法提取苹果皮果胶含有更多的支链。
研究结果显示,用超声辅助柠檬酸法提取所得的苹果皮果胶中Fuc含量高达19.2%,丰富了果胶的种类,有助于全面系统地来研究果皮或果渣中果胶的理化性质和生物活性。此外,研究结果证实了所得的富含Fuc的苹果皮果胶与采用柠檬酸作萃取剂有必然关系,可能是果胶中阿拉伯聚糖结构单元在柠檬酸溶液中发生了降解,得到了更多的富含Fuc RG-Ⅰ和RG-Ⅱ侧链的果胶。
[1] 李建军. 柑橘果胶可控性降解和寡糖片段的分离分析及其活性研究[D]. 西安: 西北大学, 2008: 1-136.
[2] FISHMAN M L, COOKE P H, CHAU H K, et al. Global structures of high methoxyl pectin from solution and in gels[J]. Biomacromolecules, 2007, 8(2): 573-578.
[3] ARSLAN N, TOGRU H. Filtration of pectin extract from grapefruit peel and viscosity of pectin solutions[J]. Journal of Food Engineering, 1996, 27(2): 191-201.
[4] KUMAR A, CHUAHAN G S. Extraction and characterization of pectin from apple pomace and its evaluation as lipase (steapsin) inhibitorits evaluation as lipase (steapsin) inhibitor[J]. Carbohydrate Polymers, 2010, 82(2): 454-459.
[5] CHEMAT F, GRONDIN I, SHUM CHEONG SING A, et al. Deterioration of edible oils during food processing by ultrasound[J]. Ultrasonics Sonochemistry, 2004, 11(1): 13-14.
[6] TOMA C, PITTENGER M F, CAHILL K S, et al. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotypeinthe adult murine heart[J]. Circulation, 2002, 105(1): 93-98.
[7] INATORU M, TOMA M, RADU O, et al. The use of ultrasound for the extraction of bioactive principles from plant materials[J]. Ultrasonics Sonochemistry, 1997, 4(2): 135-139.
[8] SESHADRI R, WEISS J, HULBERT G J, et al. Ultrasonic processing influences rheological and optical properties of high-methoxyl pectin dispersions[J]. Food Hydrocolloids, 2003, 17(2): 191-197.
[9] 徐溪, 黄琳娟, 王仲孚, 等. 苹果果胶活性寡聚半乳糖醛酸的分离制备及其ESI-MS分析研究[J]. 化学学报, 2010, 68(15): 1525-1531.
[10] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1994: 324-326.
[11] SCHULTZ H. Determination of the degree of esterification of pectin[J]. Journal of Carbohydrate Chemistry, 1965, 5: 189-191.
[12] GAMA H, MABON N, NOTT K, et al. Kinetic of the hydrolysis of pectin galacturonic acid chains and quantification by ionic chromatogrhy[J]. Food Chemistry, 2006, 96(3): 477-484.
[13] BAGHER H, ASHTIANI F Z. Comparisons between conventional, microwave and ultrasound-assisted methods for extraction of pectin from grefruit[J]. Chemical Engineering and Processing, 2011, 50(11): 1237-1243.
[14] ZHAO G H, KAN J Q, LI Z X, et al. Structural features and immunological activity of polysaccharide from Dioscorea opposita Thunb roots[J]. Carbohydrate Polymers, 2005, 61(2): 125-131.
[15] JEAN P E, CORINNE P R, COURTOIS B. Chemical characterization of pectin from green tea (Camellia sinensis)[J]. Carbohydrate Polymers, 2011, 83(3): 1232-1239.
[16] KURITA O, FUJIWARA T, YAMAZAKI E. Characterization of the pectin extracted from citrus peel in the presence of citric acid[J]. Carbohydrate Polymers, 2008, 74(3): 725-730.
[17] LINERS F, THIBAULT J F, van CUTSEM P. Influence of the degree of polymerization of oligogalacturonates and of esterification pattern of pectin on their recognition by monoclonal-antibodies[J]. Plant Physiology, 1992, 99(3): 1099-1104.
[18] HYUN J R, BAE I Y, LEE S Y. Enhancement of anti-radical activity of petin from ple pomace by hydroxamation[J]. Food Hydrocolloids, 2011, 25(3): 545-548.
[19] SIRISOMBOON P, TANANA M, FUJITA S, et al. A simplified method for the determination of total oxalate-soluble pectin content in janese pear[J]. Journal of Food Composition and Analysis, 2001, 14(1): 83-91.
[20] RENARD C M G C, CREPEAU M J, THIBAULT J F. Structure of the repeating units in the rhamnogalacturonic backbone of ple, beet, and citrus pectins[J]. Carbohydrate Research, 1995, 275(1): 155-165.
[21] DARVILL A G, MCNEIL M A, ALBERSHEIM P. Structure of plant cell walls. Ⅷ. A new pectic polysaccharide[J]. Plant Physiology, 1978, 62(3): 418-422.
Extraction and Physico-chemical Properties of Fucose-Rich Pectins from Apple Peel
CHENG Yang, ZHANG Ying, DUAN Shuang-yan, HUANG Lin-juan, WANG Zhong-fu*
(Key Laboratory of Resource Biology and Biotechnology in Western China, Ministry of Education, Shaanxi Provincial Key Laboratory of Biotechnology, College of Life Science, Northwest University, Xi’an 710069, China)
In this study, apple pectins (APs) were extracted from apple peel by ultrasound-assisted extraction with citric acid, and investigated for physico-chemical properties. Under the optimized conditions of pH 2.5 citric acid solution as the extraction solvent, 450 W ultrasound power and 30 min radiation time, the yield of APs was 14.6%. The extracted APs were characterized by a degree of esterification of 69.9% and a molecular weight larger than 400 kD, and contained 92.8% total sugar, 58.5% aldonic acid. GC data indicated that the APs consisted of eight monosaccharides including Rha, Fuc, Ara, Xyl, Glc, Gal, GlcA and GalA, with a relative molar ratio of 9.5:19.2:4.7:0.1:4.6:3.6:2.3:56.3 and a significantly high percentage of Fuc, reaching 19.2%. Further results revealed that the extraction of Fuc-rich APs was likely associated with the method using citric acid as the extraction solvent.
apple pectin; extraction; fucose; physico-chemical properties; citric acid
O629.12
A
1002-6630(2014)10-0006-05
10.7506/spkx1002-6630-201410002
2013-07-16
国家自然科学基金面上项目(31071506);陕西省教育厅自然科学基金项目(2013JK0714)
程洋(1987—),男,硕士研究生,研究方向为植物多糖的分离提取与活性测定。E-mail:chengyangn@163.com
*通信作者:王仲孚(1971—),男,教授,博士,研究方向为糖生物学与糖工程学。E-mail:wangzhf@nwu.edu.cn
——α-葡萄糖醛酸酶的研究进展*

