响应面法优化微波辅助酶解合浦珠母贝蛋白工艺
王 晶,吴燕燕,李来好,杨贤庆
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306)
响应面法优化微波辅助酶解合浦珠母贝蛋白工艺
王 晶1,2,吴燕燕1,*,李来好1,杨贤庆1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306)
研究微波对酶解合浦珠母贝蛋白的影响,以水游离氨态氮含量和抗氧化活性为指标,选择较好的作用酶,通过单因素试验确定料液比、加酶量(E/S)、微波温度、微波功率及时间和后续水浴时间等因素水平,以水解度和DPPH自由基清除率为响应值,响应面法优化酶解合浦珠母贝蛋白工艺条件。结果表明,微波辅助蛋白酶酶解合浦珠母贝蛋白工艺条件为微波温度58 ℃、微波功率300 W、微波时间17 min、加酶量5 000 U/g,后续在58 ℃条件下再水浴1.5 h。预测响应值为0.224 4,水解度达到26.15%,验证实验证明与响应优化模型预测值误差不大,二次多元拟合度较好。
合浦珠母贝蛋白;微波辅助酶解;抗氧化活性;响应面法
合浦珠母贝,又称马氏珠母贝,是我国南海近海的主要养殖品种,也是我国主要的产珠贝种。但是采珠后会产生的大量珍珠贝肉,在市面上的加工利用率低且应用面窄[1]。研究发现合浦珠母贝肉不仅具有很高的食用价值,还富含蛋白质、多种不饱和脂肪酸、矿物质和维生素等营养物质[2-3]。同时其酶解产物还具有抗氧化功能、较强的清除自由基能力[4-7]。珍珠的抗衰老特性已得以证明,合浦珠母贝因其在海洋中的特殊生长环境,其贝肉中还有丰富的抗氧化肽[8-10],因此为从海洋资源中提取天然抗氧化剂提供了新途径。
微波是指频率在300 MHz~300 GHz的高频电磁波,目前学术界对微波加速有机反应的机理有两种观点:微波热效应和分子振动降低反应活化能的非热效应[11]。但微波技术最大的特点是可以缩短酶解时间,从而提高提取效率、降低成本[12-13]。
本实验利用微波辅助蛋白酶水解合浦珠母贝蛋白,以期缩短蛋白水解时间,提高蛋白质水解度,为酶解合浦珠母贝蛋白制备抗氧化肽提供资源和工业化生产提供新思路和技术支持,为进一步纯化抗氧化肽提供科学依据。
1 材料与方法
1.1 材料与试剂
合浦珠母贝购自海南养殖基地。
Alcalase 2.4L蛋白酶(2×105U/g) 丹麦诺维信公司;木瓜蛋白酶(8×105U/g,CAS:9001-7 3-1,生物试剂)、酸性蛋白酶(5×1 05U/g,C A S:9 0 0 1-7 5-6,生物试剂)、风味蛋白酶(2×104U/g,生物试剂) 广州市齐云生物技术公司;胰蛋白酶(2.5×105U/g,CAS:9002-07-3,生物试剂)、复合蛋白酶(1.2×105U/g,生物试剂) 广州菲博生物科技公司;枯草蛋白酶(1.1×105U/g,食品级) 无锡市雪梅酶制剂科技有限公司;DPPH(CAS:1898-66-4,分析纯) 美国Sigma公司;甲醛以及其他试剂(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
DS-1高速组织捣碎机 上海标本模型厂;DK-S24型恒温水浴锅 上海森信实验仪器厂有限公司;3K30型高速冷冻离心机 德国Sigma公司;MAS-Ⅱ 微波仪 上海新仪微波化学科技有限公司;Kjeltel2300凯氏定氮仪 丹麦FOSS仪器有限公司;Delta320精密pH计 梅特勒-托利多仪器(上海)有限公司;Akku-drive电子滴定仪 德国赫施曼公司;SUNRISE酶标仪 奥地利Tecan公司。
1.3 方法
1.3.1 样品前处理
将合浦珠母贝去壳和脏器,然后直接用组织捣碎机将贝肉绞碎待用。
1.3.2 常规水解合浦珠母贝蛋白
称取贝肉12 g若干份,每个样品以料液比3:2(g/mL)加0.2 mol/L磷酸缓冲溶液(pH 7.0)8 mL,再按照4 000 U/g加酶量加入Alcalase 2.4L蛋白酶,混匀后置于60 ℃水浴锅。依次水浴1、2、3、4 h和5 h取出样品[14],在100 ℃条件下灭酶10 min,10 000 r/min 离心10 min,取上清液测定其游离氨态氮含量和DPPH自由基清除率。
1.3.3 微波辐射辅助蛋白酶水解合浦珠母贝蛋白
对处理过的样品采用微波仪微波辅助酶解,在设定功率条件下达到设定的温度后,会自动以最低功率100 W保持样品的温度。其他按照以下条件处理:称取经前处理的贝肉12 g,料液比3:2(g/mL)加0.2 mol/L 磷酸缓冲液(pH 7.0),加酶量4 000 U/g、微波功率300 W,在60 ℃条件下微波10 min后,取出继续在60 ℃条件下水浴1.5 h,再经灭酶,离心,测定其水解度(degree of hydrolysis,DH)和DPPH自由基清除率。以此条件为基准,对比先加酶后微波水浴与先微波后加酶水浴的效果,再选择最佳作用酶,并考察料液比、加酶量(E/S)、微波温度、微波功率以及时间和后续水浴时间等单因素的影响,采用Box-Behnken设计建立数学模型,以DH和DPPH自由基清除率作为响应值,进行响应面分析,确定微波辅助酶解的工艺条件。
1.3.3.1 酶的选择
将Alcalase 2.4L蛋白酶(pH 7.0,60 ℃)、木瓜蛋白酶(pH 6.5,60 ℃)、胰蛋白酶(pH 8.0,40 ℃)、酸性蛋白酶(pH 3.0,50 ℃)、枯草蛋白酶(pH 8.0,50 ℃)、风味蛋白酶(pH 7.0,50 ℃)和复合蛋白酶(pH 6.5,50 ℃)编号为1~7,从中选择最佳微波辅助酶解的酶类,根据其各自的最佳pH值和温度结合以上基准条件处理样品,并测定其游离氨态氮含量和DPPH自由基清除率。
1.3.3.2 酶解工艺条件对微波辅助酶解的影响
其他条件同1.3.3.1节,设置料液比3:1、3:2、1:1、2:3和1:3(保持系列料液总量不变来称取样品的质量);加酶量2 000、4 000、8 000、12 000、16 000、20 000 U/g;微波温度30、40、50、60、70 ℃;微波功率200、300、400、600、800、900 W;微波处理时间1、3、5、10、15、30、45、60 min;水浴时间0.5、1.0、1.5、2.0、2.5、3.0 h,考察酶解工艺条件对微波辅助酶解的影响,选择最优比例,测定其游离氨态氮含量和DPPH自由基清除率。
以上实验过程中发现,用到微波处理中的样品量较小时会造成较大的实验处理误差,推测是微波炉腔内微波处理分布不均匀,那么平行组在相同的设定条件下页会有相对较大的误差,所以,为了减小实验中不稳定性因素的影响和减小实验误差,在处理过程中加有500 mL去离子水的玻璃容器于微波腔中,每次将处理组放在玻璃容器的水中处理。
1.3.3.3 响应面试验设计
考虑微波处理对酶的影响,根据单因素试验结果,选择微波温度、微波功率、微波时间以及加酶量4 个因素作为响应变量,其编码为A、B、C和D。利用Design Expert v 8.0.6.1软件按照Box-Behnken原理进行响应面设计,优化微波辅助蛋白酶水解合浦珠母贝肉工艺。各试验组的编码与水平见表1。

表1 响应面试验因素与水平Table1 Variables and levels in the three-level, four-variable Box-Behnken experimental design
1.3.4 指标测定
样品总氮含量测定参照凯氏定氮法[15],氨基态氮含量测定参照甲醛-电位滴定法[16]。DH[17-18]按式(1)计算。

式中:N1为水解液中氨基氮含量;N2为原料中粗蛋白氮含量。
抗氧化活性测定:以对DPPH自由基的清除能力验证酶解液的抗氧化活性状况,参考文献[19-20],并稍作修改,具体如下:取1 mL样品酶解液于10 mL的离心管,再依次加入1 mL去离子水,1 mL DPPH溶液(2×10-4mol/L,DPPH溶于无水乙醇),混匀后在室温条件下避光反应20 min,10 000 r/min离心10 min,于517 nm波长处测吸光度Ai,实验空白组为1 mL无水乙醇代替DPPH自由基溶液加入1 mL去离子水测定吸光度为Aj,对照组为1 mL去离子水代替1 mL样品在517 nm波长处测定吸光度A0,并以等体积去离子水和无水乙醇混合液空白调零,DPPH自由基清除率按公式(2)计算。
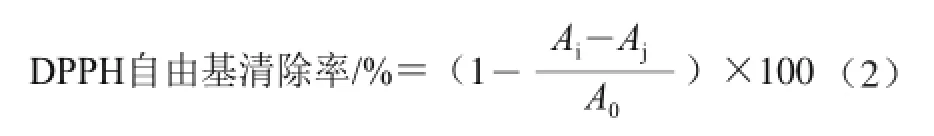
式中:A0为对照组吸光度;Ai为样品组吸光度;Aj为空白组吸光度。
2 结果与分析
2.1 水浴与微波酶解合浦珠母贝蛋白效果
为了表征微波辅助酶解处理合浦珠母贝肉的效果,设立了不同的处理组,先加酶后微波10 min,再水浴酶解1.5 h和微波10 min,再加酶水浴酶解1.5 h,讨论微波辅助酶解的功效大小。各组处理样品经过灭酶离心后,取上清液,测定其游离氨态氮含量和DPPH自由基清除率,结果见表2。
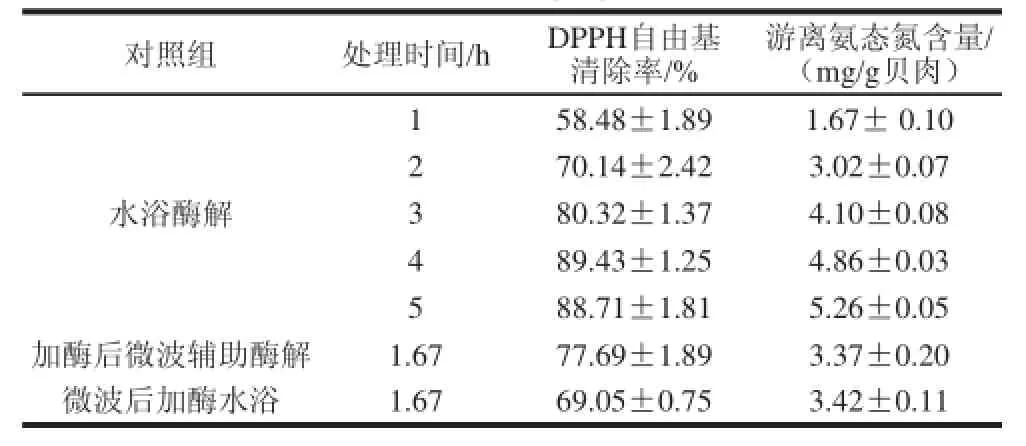
表2 微波辅助酶解和水浴酶解处理组的游离氨态氮含量和DPPH自由基清除率结果Table2 Effect of enzymatic hydrolysis alone or sequentially combined with microwave treatment on free ammonia nitrogen content and DPPH radical scavenging rate
2.2 酶的选择
图1为微波辅助7 种酶处理合浦珠母贝肉的游离氨态氮含量和DPPH自由基清除率结果,不同的酶以料液比3:2在各自最适的pH值环境和微波处理温度中作用于底物,微波处理10 min后,水浴1.5 h。不同的酶受微波条件的影响大小也不同[21],由图1可见,DPPH自由基清除率较高的是木瓜蛋白酶>Alcalase 2.4L>复合蛋白酶,水解度较好的是枯草蛋白酶>风味蛋白酶>Alcalase 2.4L,综合考虑游离氨态氮含量和DPPH自由基清除率,保证水解度和活性较高,1号酶分别达到3.488 6 mg/g贝肉和81.303%,即Alcalase 2.4L蛋白酶效果最佳,因此,后续实验选择该酶进行微波处理。
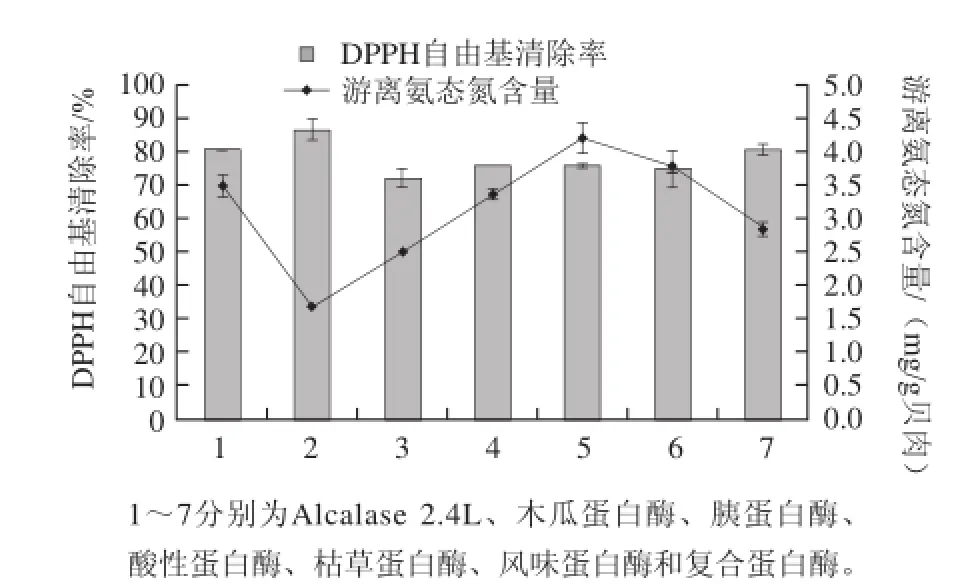
图1 7种不同的酶对合浦珠母贝肉微波辅助酶解的效果Fig.1 Effect of different enzymes on the hydrolysis of Pinctada martensii muscle proteins
2.3 单因素试验
2.3.1 料液比对微波辅助酶解的影响
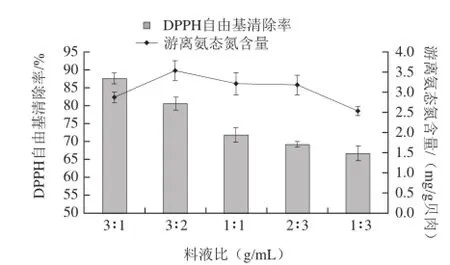
图2 料液比对微波辅助酶解的影响Fig.2 Effect of material/liquid ratio on the microwave-assisted enzymolysis of Pinctada martensii muscle proteins
由图2可知,处理样品时通过维持料液总量不变来称取各组的样品量,以减小实验误差。随着贝肉比例的减少,DPPH自由基清除率逐渐降低,而游离氨态氮的含量在3:2时最高为3.535 mg/g贝肉。综合考虑活性和水解量,料液比为3:2的处理结果较好。
2.3.2 加酶量对微波辅助酶解的影响
由图3可知,不同加酶量对微波处理的影响较大,加酶量为4 000~8 000 U/g范围时[22],无论是DPPH自由基清除率还是游离氨态氮的含量都明显高于其他的酶加量的结果,最高为4.248 mg/g贝肉和80.505%。说明酶与底物的平衡结合量在这个范围内,可以使酶解达到最佳状态。
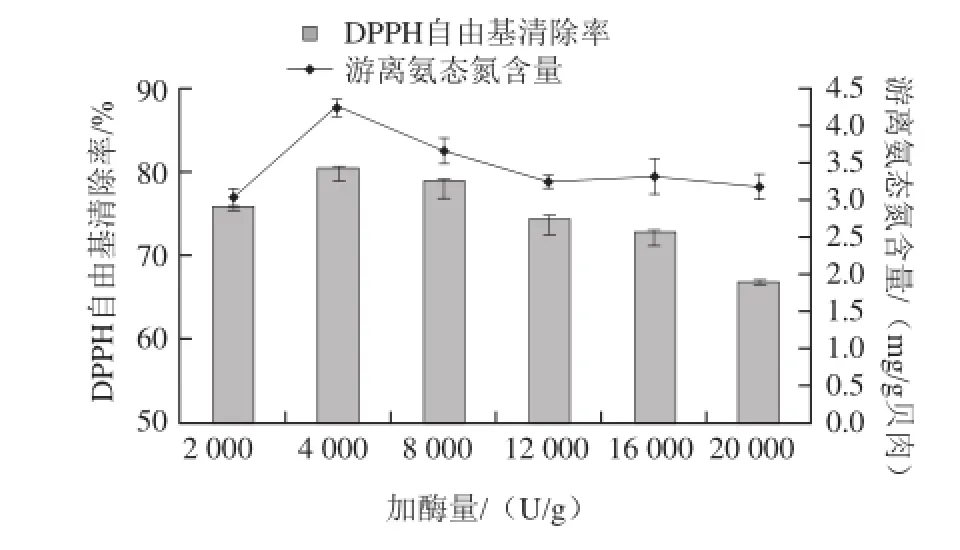
图3 加酶量对微波辅助酶解的影响Fig.3 Effect of E/S ratio on the hydrolysis of Pinctada martensii muscle proteins
2.3.3 微波温度对微波辅助酶解的影响
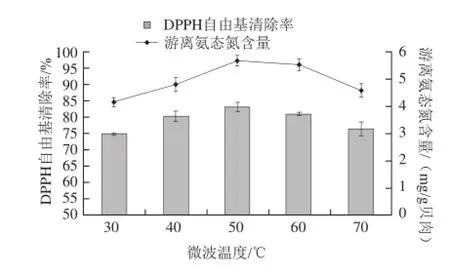
图4 微波温度对微波辅助酶解的影响Fig.4 Effect of microwave temperature on the hydrolysis of Pinctada martensii muscle proteins
由图4可见,样品在50~60 ℃条件下微波10 min后水浴1.5 h的处理样液,其DPPH自由基清除率还是游离氨态氮的含量都较高,因此在此范围内可以有效同时保证高水解度和活性。
2.3.4 微波功率对微波辅助酶解的影响
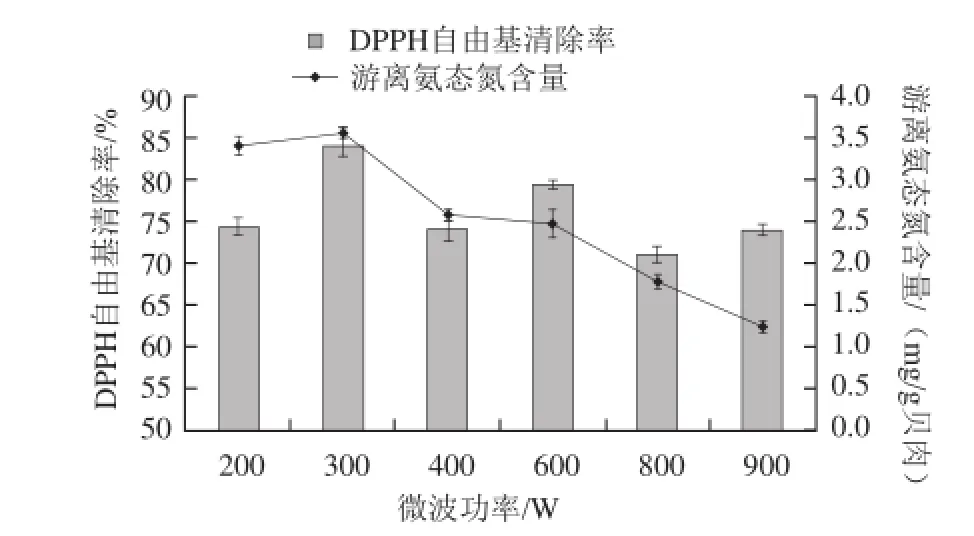
图5 微波功率对微波辅助酶解的影响Fig.5 Effects of microwave power on the hydrolysis of Pinctada martensii muscle proteins
从图5可知,随着微波功率加大,DPPH自由基清除率还是游离氨态氮的含量总体呈现下降趋势。酶自身结果和活力在不同的微波功率下会受到一定的影响,目前的机理虽然尚不明确,但一致认为较大的功率会破坏酶活力。所以需要在较低的功率条件下找到快速处理的平衡点[23-24]。综合实验对水解度和DPPH自由基清除率的要求,微波功率300 W左右处理样品较好,分别达到3.55 mg/g贝肉和83.811%。
2.3.5 微波处理时间对微波辅助酶解的影响
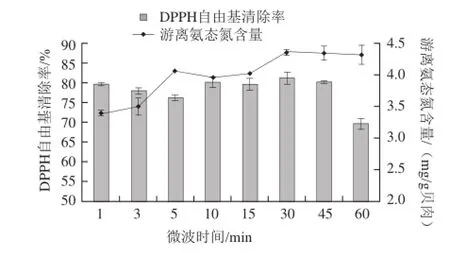
图6 微波时间对微波辅助酶解的影响Fig.6 Effect of microwave time on the hydrolysis of Pinctada martensii muscle proteins
根据已选择较好的微波功率,在此条件下加热处理样品时间过长也会影响酶的活力情况[25-26]。由图6可知,随着微波处理时间延长,DPPH自由基清除率在10~45 min内较高。而游离氨态氮的含量大体呈递增趋势,30 min后曲线变的平缓,可能是酶的活性位点长时间在微波作用下被破坏,造成酶活性下降的缘故。
2.3.6 水浴处理时间对微波辅助酶解的影响
由于微波对酶也存在一定的负面影响,应该选择在能够保证较高的水解度和活性条件下,可以快速达到处理要求作用于样品,后续需要结合水浴,达到总体过程时间低于全水浴的处理结果。图7为微波处理后不同水浴时间的影响,随着水浴时间延长,游离氨态氮的含量也随之增加,而DPPH自由基清除率在1.5~2 h表现较突出,本着节省能源缩短处理时间的目的,实验选择1.5 h水浴时间较佳。
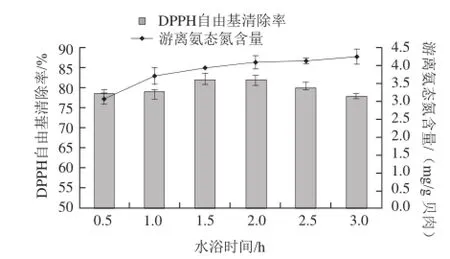
图7 水浴时间对微波辅助酶解的影响Fig.7 Effect of subsequent water-bath heating time on on the hydrolysis of Pinctada martensii muscle proteins
2.4 响应面优化试验
2.4.1 响应面设计试验和显著性分析
运用Design Expert v 8.0.6.1软件使用编码单位对试验进行四因素三水平的响应设计,见表3,优化试验综合考虑酶解液的高DH和DPPH自由基清除率,设立以DH×DPPH自由基清除率为响应值,试验共29 组,其中包含24 个析因点和5 个零点,5 次零点试验做误差估计。数据结果进行多元回归拟合,回归方程的方差分析、各项的方差分析和参数估计及显著性分析的主要结果归纳分别见表4。
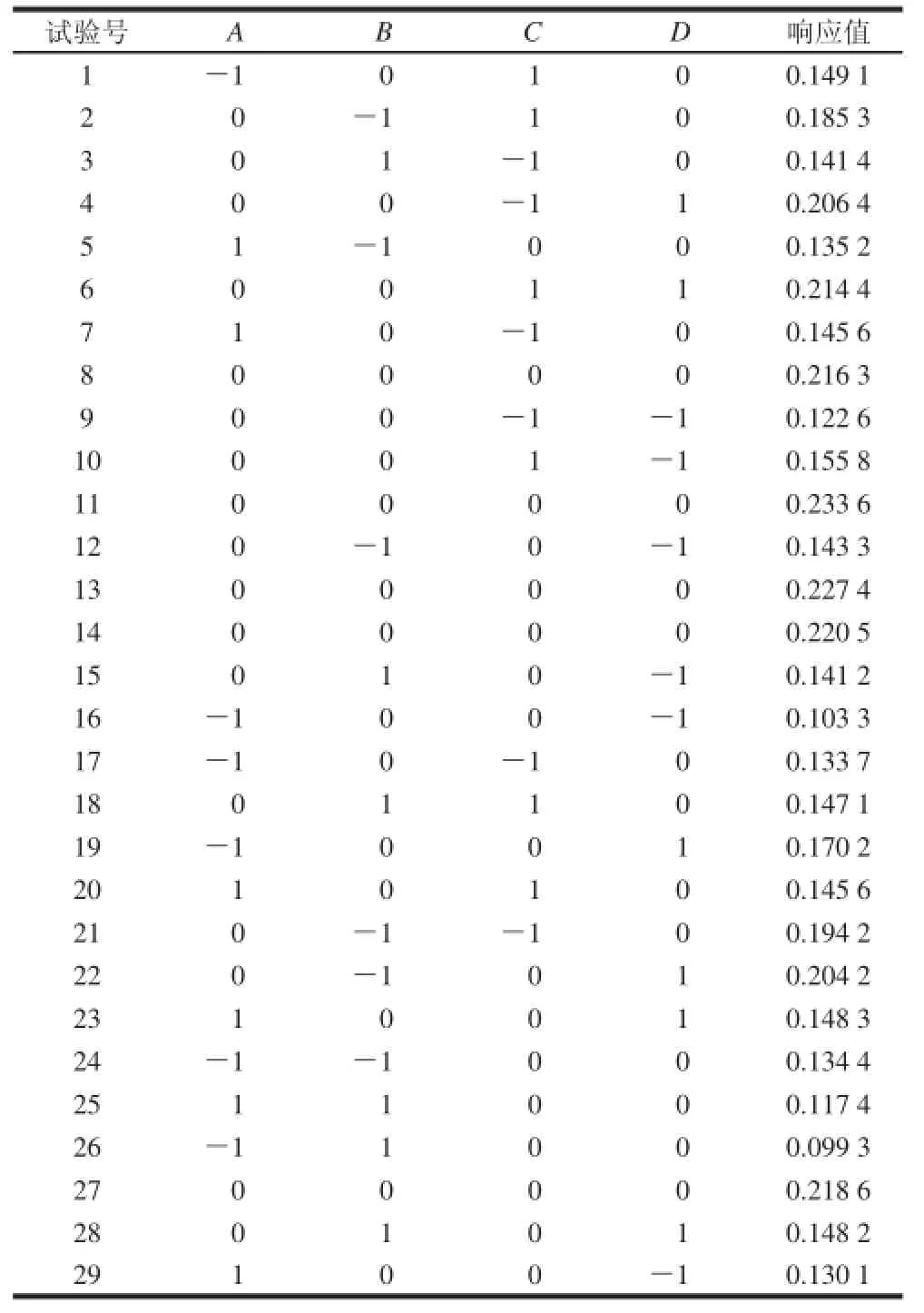
表3 Box-Behnken试验设计及结果Table3 Arrangement and results of the three-level, four-variable Box-Behnken experimental design
利用软件对数据进行二次多元回归拟合微波辅助酶解合浦珠母贝蛋白方程如下:
响应值= 0.22+2.683×10-3A-0.017B+4.450×10-3C +0.025D+4.325×10-3AB-3.850×10-3AC-0.012AD+3.650×10-3BC - 0.013BD - 6.300×10-3CD - 0.061A2-0.038B2- 0.020C2- 0.026D2
如表4所示,二次多元回归拟合方程的方差分析,B、D、A2、B2和D2项为极显著影响因素,其中AD项和BD项交互影响显著,其他项不显著,说明各项对响应值的影响并非线性关系。整体二次多元拟合的模型的校正决定系数R2Adj= 93.02%,P<0.000 1,表明试验所选用的二次项模型具有极显著性。失拟项P=0.181 8>0.05,差异不显著说明残差均是由随机误差引起的,而R2=96.51%说明响应值有96.51%取决于所选的因素变量。所以用此模型可以较好地预测和优化微波辅助酶解合浦珠母贝蛋白。
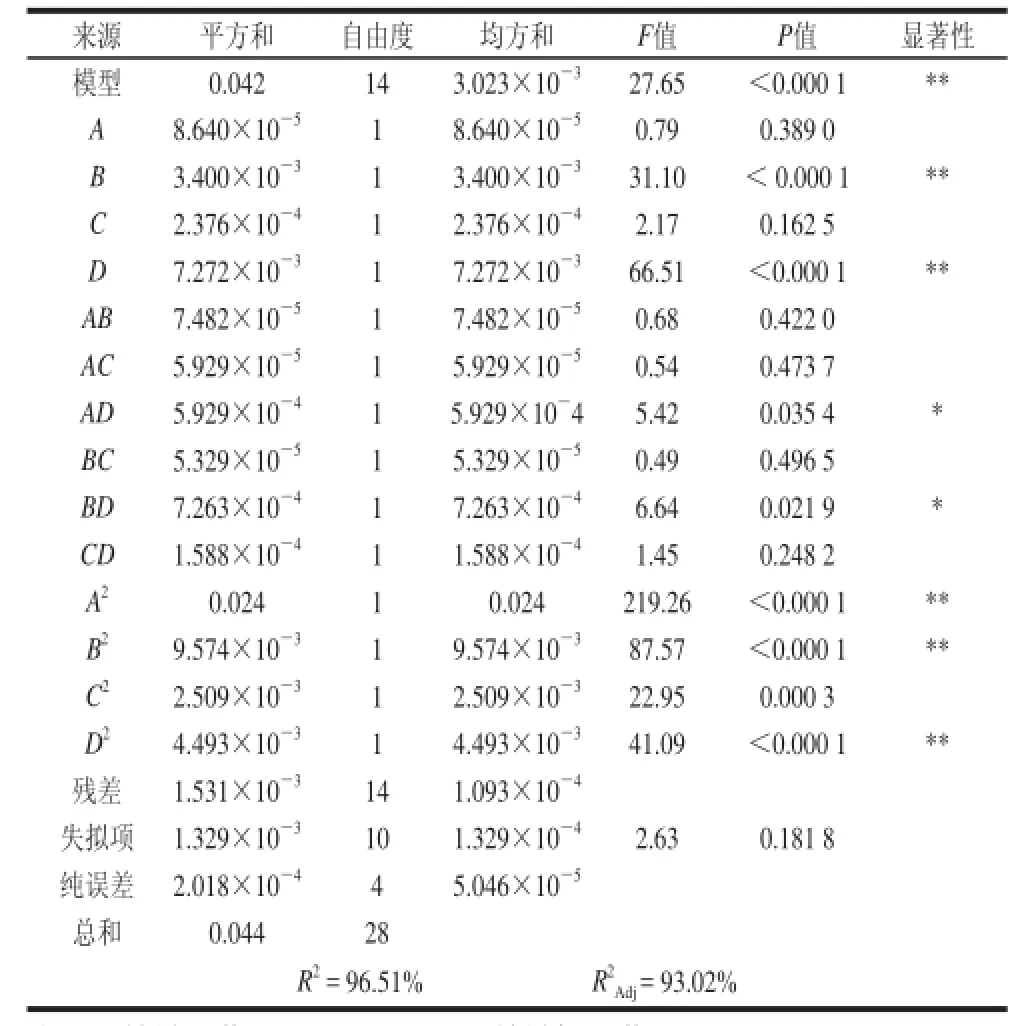
表4 回归方程的方差分析Table4 Analysis of variance for the regression equation
2.4.2 响应面结果分析
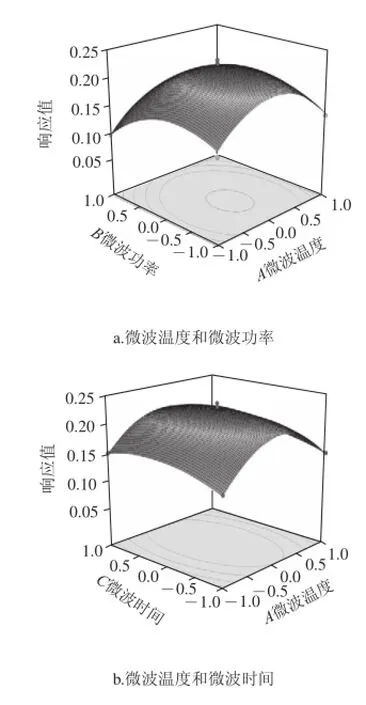
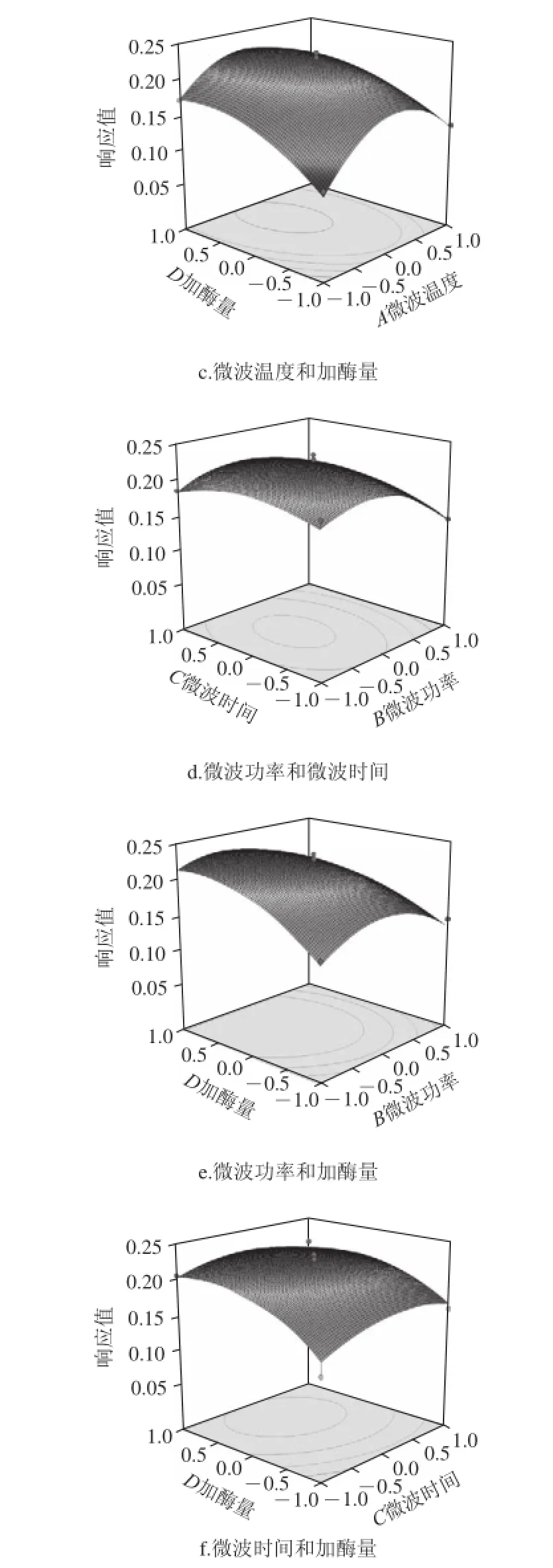
图8 两两交互作用对响应值的影响Fig.8 Interactive effects of experimental conditions on the hydrolysis of Pinctada martensii muscle proteins
由图8等高线可以看出,各因素间的交互影响较好,基本呈现椭圆形。图8b固定微波温度,改变微波时间,其响应值变化较小,呈平缓的弧线,说明微波时间影响不及微波温度影响大。图8e和8f中,各自固定微波功率和时间,响应值随着加酶量的增大而增大,起初变化较大,但后面变化平缓甚至有些许滑低,可能是底物已被饱和催化的缘故。
对模型发成求导得出最优条件为A=58.31、B=272.65、C=17.22、D=5 016.84,即微波温度58.31 ℃、微波功率272.65 W、微波时间17.22 min、加酶量5 016.84 U/g,此时预测的响应值为0.224 4,DH为26.15%。
2.5 模型验证实验及活性测定
为了进一步检验响应面优化条件的可靠性,结合实际操作,将实验条件A、B、C和D修正为58 ℃、300 W、17 min和5 000 U/g进行验证实验,得到DH为(25.04±0.46)%,响应值为0.217 3±0.070 0。
3 结 论
3.1 本实验采用微波辅助酶解合浦珠母贝肉有效可行,通过优化实验证明微波能够促进贝肉水解,节省资源和时间,按照优化条件进行酶解的结果相当于常规水浴3 h(水解度(22.74±0.08)%)与4 h(水解度(26.95±0.03)%)之间,于是微波辅助酶解可以将水浴酶解时间缩短约一半。
3.2 实验中对比了加酶和不加酶以及先加酶和后加酶微波处理的结果,发现微波前加酶较好,说明微波在一定程度上也是可以促进酶的作用。
3.3 响应优化的二次多元拟合度较好,对各因素的影响进行显著性分析,并优化出的最佳工艺条件为微波温度58 ℃、微波功率300 W、微波时间17 min、加酶量5 000 U/g,后续在58 ℃条件下再水浴1.5 h。在此条件下酶解合浦珠母贝肉能够在一定程度上为工业化提供方向,并为后续实验研究提供一定的参考依据。
[1] 郝记明, 章超桦, 郭顺堂. 酶解制备马氏珠母贝肉ACEIP的工艺研究[J].食品科学, 2007, 28(5): 128-131.
[2] 刁石强, 李来好, 陈培基, 等. 马氏珠母贝肉营养成分分析及评价[J].浙江海洋学院学报, 2000, 19(l): 42-46.
[3] 吴燕燕, 李来好, 杨贤庆, 等. 栅栏技术优化即食调味珍珠贝肉工艺的研究[J]. 南方水产, 2008, 4(6): 56-62.
[4] 胡雪琼, 周盛华, 夏杏洲, 等. 马氏珠母贝肉酶解产物清除自由基活性的研究[J]. 食品工业科技, 2009, 30(5): 97-99.
[5] WU Yanyan, TIAN Qian, LI Laihao, et al. Inhibitory effect of antioxidant peptides derived from Pinctada fucata protein on ultraviolet-induced photoaging in mice[J]. Journal of Functional Foods, 2013, 5(2): 527-538.
[6] 吴燕燕, 田倩, 尚军, 等. 合浦珠母贝抗氧化肽的性质及应用研究[J].食品工业科技, 2011, 32(11): 123-126; 130.
[7] 田倩, 吴燕燕, 李来好, 等. 合浦珠母贝肉酶解液中抗氧化肽的分离及活性研究[J]. 食品科学, 2011, 32(增刊1): 144-148.
[8] WU Yanyan, LI Laihao, DUAN Zhenhua, et al. Application of response surface methodology to optimise preparation high antioxidantactivity product from pinctada fucata muscle[J]. Advanced Materials Research, 2012, 396-398: 1341-1348.
[9] 尚军, 李来好, 吴燕燕, 等.响应面法优化超声波辅助蛋白酶水解合浦珠母贝肉的条件研究[J]. 食品科学, 2009, 30(18): 44-49.
[10] 吴燕燕, 尚军, 李来好, 等. 合浦珠母贝肉短肽的分离及其抗氧化活性研究[J]. 食品工业科技, 2012, 33(7): 123-126.
[11] 左继红. 微波辅助蛋白酶水解反应工艺和反应器的研究[D]. 无锡:江南大学, 2008.
[12] 曹光辉, 黄诚, 尹红, 等. 微波辅助酶法水解草鱼鱼鳞的工艺条件[J].吉首大学学报: 自然科学版, 2010(2): 101-104.
[13] 曹川, 包建强. 响应面法优化微波辅助提取贻贝蛋白的工艺研究[J].食品工业科技, 2012, 33(5): 258-261.
[14] 尚军. 合浦珠母贝肉寡肽的制备及其抗氧化活性研究[D]. 湛江: 广东海洋大学, 2010.
[15] GB 5009.5—2010 食品中蛋白质的测定[S].
[16] ZBX 66038—1987 氨基态氮测定法[S].
[17] NIELSEN P M, PETERSEN D, DARNBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal Food Science, 2001, 66(5): 642-646.
[18] 敬思群, 热那汗·买买提, 兰雁. 加酶超声提取核桃抗氧化肽工艺优化[J]. 食品工业科技, 2012, 37(3): 94-98.
[19] WU Huichun, CHEN Huaming, SHIAU C Y. Free amino acids and peptides related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food Research International, 2003, 36(9/10): 949-957.
[20] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38: 175-182.
[21] IZQUIERDO F J, PEÑAS E, BAEZA M L, et al. Effects of combined microwave and enzymatic treatments on the hydrolysis and immunoreactivity of dairy whey proteins[J]. International Dairy Journal, 2008, 18(9): 918-922.
[22] LIU D, LI X N, QIN Z J, et al. Study on the processing technique of enzyme hydrolysis Eupolyphaga sinensis peptide and innunoregulatory effect[J]. Journal of Chinese Medicinal Materials, 2012, 35(9): 1382-1385.
[23] 曹光辉, 黄诚, 尹红. 微波辅助酶法水解草鱼鱼鳞的工艺条件[J]. 吉首大学学报: 自然科学版, 2010, 31(2): 101-104.
[24] IZQUIERDO F J, PEÑAS E, BAEZA M L, et al. Effects of high pressure and microwave on pronase and α-chymotrypsin hydrolysis of β-lactoglobulin[J]. Food Chemistry, 2005, 92: 713-719.
[25] 李磊, 陈均志, 张海平. 微波复合酶水解植物蛋白制取小分子多肽的研究[J]. 安徽农业科学, 2007, 35(19): 5655- 5656; 5660.
[26] IZQUIERDO F J, PEÑAS E, BAEZA M L, et al. Microwave-assisted digestion of β-lactoglobulin by pronase, α-chymotrypsin and pepsin[J]. International Dairy Journal, 2007, 17: 465-470.
Optimization of Conditions for Microwave-Assisted Enzymolysis of Pinctada martensii Muscle Proteins Using Response Surface Methodology
WANG Jing1,2, WU Yan-yan1,*, LI Lai-hao1, YANG Xian-qing1
(1. Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
The microwave-assisted enzymatic hydrolysis of Pinctada martensii muscle proteins was optimized by response surface methodology. Alcalase 2.4L was chosen as the best enzyme to hydrolyze Pinctada martensii muscle proteins based on free ammonia nitrogen content and DPPH radical scavenging activity of hydrolsates. The levels of operating parameters such as substrate concentration, E/S ratio, solvent temperature, microwave power, radiation time and water bath heating time were established by single-factor experiments for response surface Box-Behnken design. Based on the mathematical product of degree of hydrolysis (DH) and DPPH radical scavenging rate, the optimal hydrolysis conditions were determined as a solvent temperature of 58 ℃, microwave treatment at 300 W for 17 min after addition of 5 000 U/g Alcalase 2.4L, and subsequent water bath heating at 58 ℃ for 1.5 h. Under these conditions, the maximum predicted DH was 26.15%, which was multiplied by DPPH radical scavenging rate to obtain 0.224 4. The small difference from the actual values observed in verification experiments suggested a high degree of fitting.
Pinctada martensii muscle proteins; microwave-assisted enzymolysis; antioxidant activity; response surface methodology
TS254.9
A
1002-6630(2014)10-0011-07
10.7506/spkx1002-6630-201410003
2013-07-03
“十二五”国家科技支撑计划项目(2012BAD28B05);海南省重点科技项目(ZDXM20100005);广东省科技计划项目(2011B031200009);国家海洋局海洋公益性行业科研专项(2013418018)
王晶(1987—),女,硕士研究生,研究方向为海洋产物资源利用。E-mail:wjing8816@163.com
*通信作者:吴燕燕(1969—),女,研究员,博士,研究方向为水产品加工与安全控制。E-mail:wuyygd@163.com

