Fenton体系中罗丹明B的化学发光和微量铁(II)的测定
池 泉,覃艳蕾,杨 桢,雷剑英,池继涛,黄 涛
(中南民族大学 化学与材料科学学院,武汉 430074)
罗丹明是常见的一类荧光染料,在化学发光反应中常用作增敏剂或能量转移试剂[1].但在一些强氧化性体系中罗丹明类物质也可直接被氧化而产生化学发光,陈国南等[2]发现在碱性条件下,过氧化氢可以氧化二溴茜素紫产生化学发光,在阳离子表面活性剂十六烷基三甲基溴化铵的存在下Co(II)离子催化此反应,利用此反应建立了水样中痕量Co(II)的测定方法.马永军等[3-5]发现Ce(IV)可直接氧化罗丹明B产生化学发光,并应用于抗坏血酸和DNA的测定.Fenton反应也可应用于化学发光体系[6],本研究在pH 3.0的HClO4介质中,利用Fe(II)-H2O2体系氧化降解罗丹明B,褪色的过程中同时产生化学发光,且发光强度与Fe(II)的浓度呈线性依赖关系.本文进一步研究了此发光反应的影响因素,并据此建立了基于罗丹明B化学发光的Fe(II)离子的分析方法,探讨了其发光机理.
1 实验部分
1.1 试剂与仪器
罗丹明B(分析纯,上海试剂三厂),抗坏血酸(分析纯,上海展云化工有限公司),七水合硫酸亚铁、三氯化铁、30%过氧化氢和其他试剂(分析纯,中国医药集团上海化学试剂公司).实验用水(高纯水,18.2 MΩ).
称取0.012 g罗丹明B溶于10 mL高纯水中,获得罗丹明B储备液(2.5 mmol·L-1). Fe(II)储备液和H2O2储备液于实验前新鲜配制.将0.417 g FeSO4·7H2O溶解于pH 3.0的HClO4溶液中,稀释定容到50 mL,获得Fe(II)储备液(0.030 mol·L-1). H2O2储备液(0.010 mol·L-1)由30%的H2O2稀释配制,用KMnO4法标定其准确浓度.
流动注射化学发光分析仪(IFFM-E型,西安瑞迈分析仪器有限公司),荧光光谱仪(970CRT型,上海精密科学仪器有限公司),紫外-可见光谱仪(TU-1901型,北京普析分析仪器有限公司).
1.2 实验方法
采用静态注射的方法进行化学发光试验.加入适量 pH 3.0 的HClO4溶液、Fe(II)标准溶液和40 μL罗丹明B溶液于10mL 烧杯中,放入化学发光检测器暗盒检测.从注射口注入40 μL 0.1mol·L-1H2O2溶液,控制混合溶液总体积为2 mL,记录加入H2O2后体系化学发光的峰值I,重复测量3次.
在荧光光谱仪上记录罗丹明B在Fenton体系中的化学发光光谱和加入H2O2前后罗丹明B的荧光光谱的变化;在紫外-可见光谱仪上记录加入H2O2前后罗丹明B的可见光谱的变化.光谱扫描均在加入H2O2后立即进行,扫描时间1 min,连续扫描2次.
2 结果与讨论
2.1 化学发光动力学曲线
罗丹明B在Fenton体系中的化学发光动力学曲线见图1.由图1可见,在罗丹明B和Fe(II)的混合溶液中注射H2O2后立即检测到发光信号,发光强度迅速达到最大值,然后逐渐减小,在1min内降到本底值附近.说明在Fenton体系中罗丹明B的氧化是一个快速发光过程.

图1 罗丹明B化学发光动力学曲线
2.2 介质pH的影响
实验发现,在酸性溶液中,用H2O2氧化罗丹明B几乎观察不到化学发光;在碱性溶液中,直接用H2O2氧化罗丹明B可检测到微弱的化学发光.由于Fenton一般在约pH 3.0的酸性条件下进行,实验研究了pH在2~6的HClO4介质对体系化学发光的影响,结果见图2.如图2所示,体系化学发光强度随着介质pH的增大而增大,但发光稳定性降低,当pH>5后化学发光强度减弱.罗丹明B在碱性条件下更易被H2O2氧化,但体系受Fenton反应pH的影响,体系的化学发光强度最大值与Fenton反应的最佳pH不吻合.兼顾发光强度和其灵敏度,选择pH 3.0的HClO4介质.
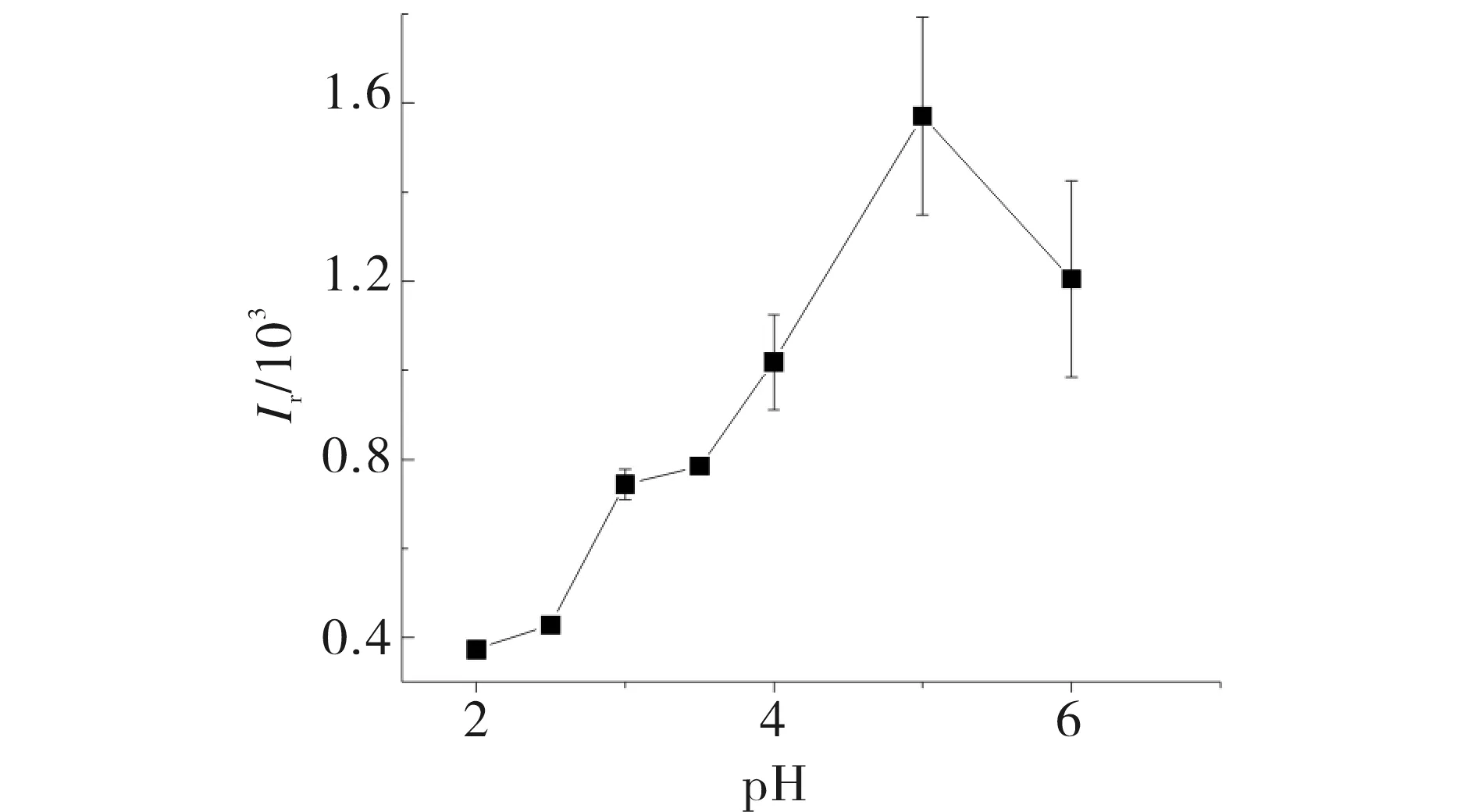
4.8×10-5 mol·L-1 RhB;2.0 mmol·L-1 H2O2;0.90 mmol·L-1 Fe(II)
2.3 罗丹明B浓度的影响
罗丹明B浓度对体系化学发光强度的影响结果见图3.如图3所示,体系的发光强度随罗丹明B浓度的增加而增加.当浓度超过3.0 × 10-5mol·L-1后,发光强度增加减缓;浓度超过4.8 × 10-5mol·L-1后,发光强度反而减弱,这是由于罗丹明B浓度增加,颜色加深,产生自吸收现象[7].故选择罗丹明B的浓度为4.8 × 10-5mol·L-1.
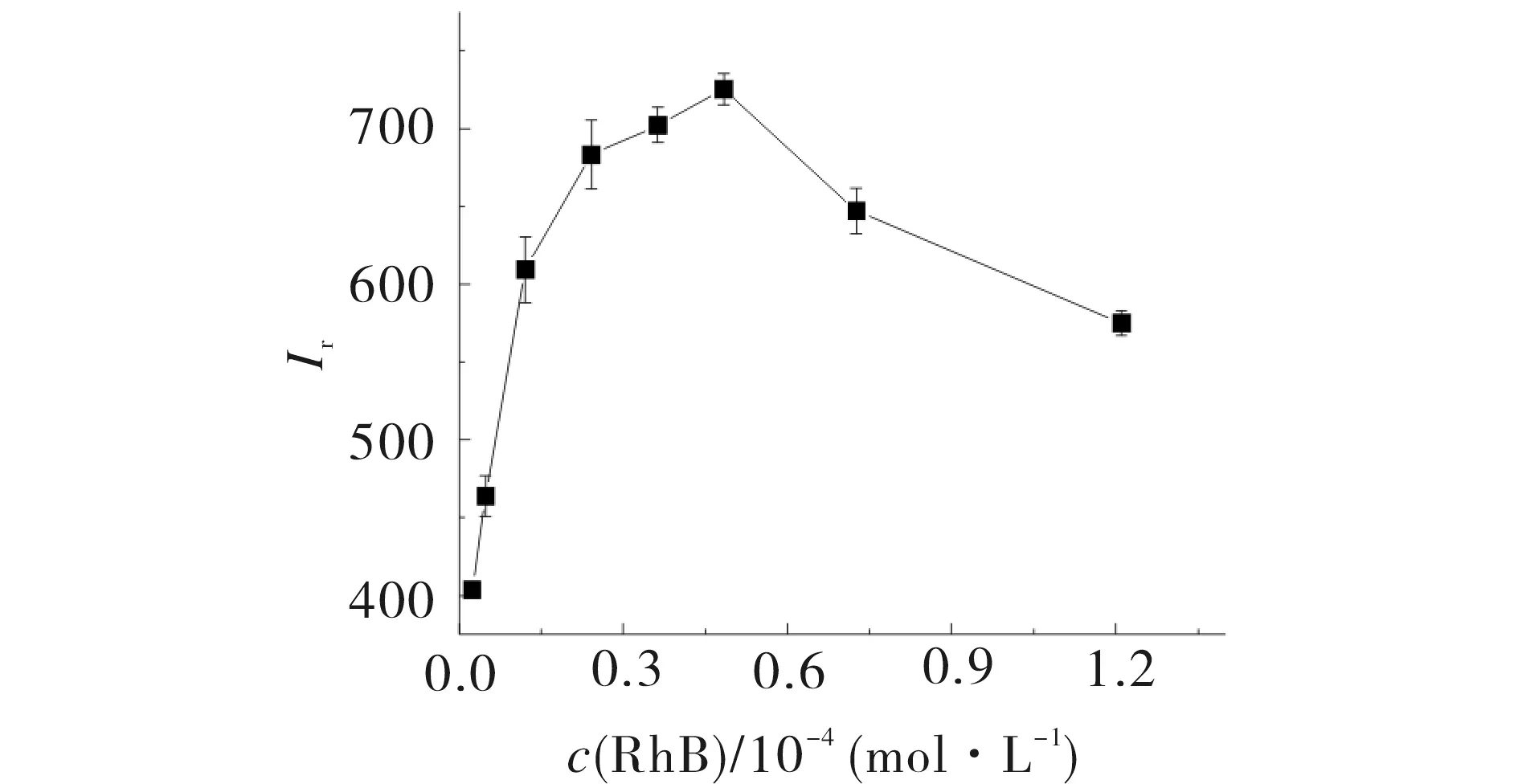
0.90 mmol L-1 Fe(II);2.0 mmol L-1 H2O2;pH 3.0
2.4 H2O2浓度的影响
H2O2浓度对体系的化学发光强度影响见图4.由图4可见,化学发光强度随H2O2浓度的增加而增加.当体系中H2O2的终浓度在mmol·L-1级时,Fe(II)的浓度与发光强度的线性关系较好,且较稳定,兼顾方法的灵敏度和重现性,选用40 μL 0.1 mol·L-1的H2O2溶液,其终浓度为2 mmol·L-1.
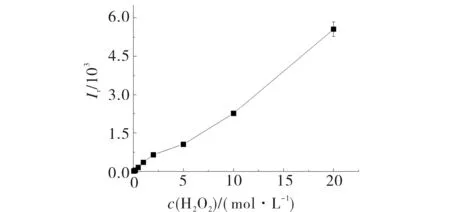
4.8×10-5 mol·L-1 RhB;1.5 mmol·L-1Fe(II);pH 3.0
2.5 Fe(II)与Fe(III)的比较
Fenton反应中Fe(II)与Fe(III)可相互转化,直接使用Fe(III)需要在碱性条件下并辅助加热Fenton反应才能进行[8].相同条件下Fe(II)与Fe(III)对体系化学发光强度的影响,结果见图5.如图5所示,在一定Fe(II)浓度范围内,化学发光强度随浓度的增加而增加,浓度超过1.5 mmol·L-1后,化学发光强度增加缓慢后维持不变;随着Fe(III)浓度的增加,化学发光只有微弱增强,与Fe(II)相比,作用不明显.故在此实验条件下,Fe(III)不能直接用于催化发光反应.

1)Fe(II);2)Fe(III)
2.6 Fe(II)测定的校准曲线、精密度及检出限
在最佳实验条件下,Fe(II)浓度在3.0×10-7~1.2×10-3mol·L-1(1.7×10-8~6.7×10-5g·mL-1)时,体系的化学发光强度与Fe(II)浓度有线性关系,结果见图6.如图6所示,线性回归方程为I= 13.39 + 498.66c(mmol·L-1),r=0.997,检出限为1.7×10-7mol·L-1(9.4 ng·mL-1). 9次平行测定0.35 μg·mL-1Fe(II)的标准溶液,相对标准偏差为4.7%.

4.8×10-5 mol·L-1 RhB;2.0 mmol·L-1 H2O2;pH 3.0
2.7 干扰实验
对常见的金属离子和一些有机小分子以及白蛋白等物质进行干扰实验,若允许化学发光强度峰值的变化率为±5%,当Fe(II)浓度为0.42 μg·mL-1时,共存物质最大允许倍数结果见表1.如表1所示,不同物质影响Fenton反应的进行和发光测定的原因各有不同:金属离子中Fe(III)影响较大,因Fenton反应中Fe(II)和Fe(III)可相互转换,即Fe(III)也参与到Fenton反应;Co(II)在一定条件下也可催化H2O2分解,作用和Fe(II)类似;柠檬酸、氨基酸和白蛋白则较易和铁形成络合物.

表1 不同物质对Fe(II)测定的影响
允许限度测定相对误差为±5%
2.8 Fe(II)样品的测定
在最佳实验条件下测定了合成样和自来水中的Fe(II),并作加标回收试验,结果见表2. 如表2所示,自来水样品中未检出Fe(II),所有样品的加标回收率均在90%~110%之间.

表2 不同样品中Fe(II)的测定 (n=3)
ND: 未检出
2.9 化学发光机理
罗丹明B在Fenton体系中的光谱测定结果见图7.化学发光光谱如图7a所示,因反应是一个快速发光过程,在进行发光光谱扫描时,发光过程已接近完成,发光信号微弱,观察到在430 nm有一较强的发射峰.图7b和图7c分别记录了在罗丹明B和Fe(II)离子的混合溶液中加入过氧化氢前后紫外-可见光谱和荧光光谱的变化.图7中显示,罗丹明B在550 nm有最大吸收,加入过氧化氢后其吸收峰值迅速下降,反应2 min后几乎褪色完全,且在褪色的过程中,其吸收峰发生蓝移.与此相对应,罗丹明B在589 nm的荧光发射峰峰值也迅速下降(激发波长505 nm),同时发生蓝移.

1)RhB+Fe(II);2)RhB+Fe(II)+H2O2 0 min;3)RhB+Fe(II)+H2O2 1 min
据此推测发光机理如下:
Fe(II)+ H2O2→Fe(III)+ OH-+ ·OH.
(1)
Fenton反应迅速产生大量的羟自由基·OH(反应1),·OH进攻罗丹明B的1位C原子,生成活性的自由基中间体(反应2),中间体退激发光(反应3).中间体15位C原子进一步受到·OH攻击,C1—C15键断裂,降解形成小分子产物(反应4).中间体的共轭程度较罗丹明B降低,因此观察到在褪色过程中溶液的吸收峰和荧光峰均发生蓝移.

3 结语
本文在pH 3.0的高氯酸溶液中Fenton体系直接氧化罗丹明B产生化学发光,探讨了影响化学发光的因素和发光机理,并据此建立了微量Fe(II)离子的化学发光分析方法. 该法测定Fe(Ⅱ)离子的浓度线性范围为3.0×10-7~1.2×10-3mol·L-1,检出限为1.7 × 10-7mol·L-1. 9次平行测定含Fe(II)离子0.35 μg·mL-1的标准溶液的相对标准偏差为4.7%.根据其化学发光光谱、紫外-可见吸收光谱以及荧光光谱,推测其发光机理为Fenton体系中产生的羟自由基进攻罗丹明B的1位C原子形成的活性中间体退激发光.实验还发现一些还原性物质(如抗坏血酸)浓度较低时对体系的化学发光有增敏作用,浓度较高时抑制化学发光,有望据此建立一些还原性物质的新的化学发光分析方法.
[1]林金明. 化学发光基础理论与应用[M].北京:化学工业出版社,2004.
[2]Chen G-N,Duan J-P,Hu Q-F. Flow injection chemilu-minescent detection of trace Co(II)with dibromoalizarin violet-H2O2-CTMAB system[J]. Mikrochim Acta,1994,116(4): 227-238.
[3]Ma Y,Jin X,Zhou M,et al. Chemiluminescence behavior based on oxidation reaction of rhodamine B with cerium(IV)in sulfuric acid medium[J]. Anal Chim Acta,2003,489(2): 173-181.
[4]Ma Y,Zhou M,Jin X,et al. Flow-injection chemilu-minescence determination of ascorbic acid by use of the cerium(IV)-Rhodamine B system[J]. Anal Chim Acta,2002,464(2): 289-293.
[5]Ma Y,Zhou M,Jin X,et al. Flow-injection chemilu-minescence assay for ultra-trace determination of DNA using rhodamine B-Ce(IV)-DNA ternary system in sulfuric acid media[J]. Anal Chim Acta,2004,501(1): 25-30.
[6]Cheng Z,Yan G,Li Y,et al. Determination of antioxidant activity of phenolic antioxidants in a Fenton-type reaction system by chemiluminescence assay[J]. Anal Bioanal Chem,2003,375(3): 376-380.
[7]Han S,Liu E,Li H. Flow injection chemiluminescence determination of hemin using the rhodamine B-H2O2-NaOH system[J]. Microchim Acta,2005,149(3): 281-286.
[8]Kaczmarek M,Idzikowska A,Lis S. Europium-sensitized chemiluminescence of system tetracycline- H2O2-Fe(II)/(III)and its application to the determination of tetracycline[J]. J Fluoresc,2008,18(6): 1193-1197.

