化学发光探针构建及应用进展
冯玉蓉,徐 帅,宦双燕,袁 林,张晓兵
(湖南大学 化学化工学院,湖南 长沙 410082)
化学发光是指分子吸收化学反应产生的化学能而被激发并发射光子的过程。化学发光现象最早被发现于一些生物体内,如海洋生物。之后,科学家在一些实验过程中也发现了化学发光现象。1877 年,Radziszewski 发现洛芬碱在碱性条件下被过氧化氢等物质氧化时可以发射绿光[1];1928 年,Albrecht 观察到鲁米诺在碱性介质中的化学发光现象[2];1954 年,Eisenbrand 发现光泽精在碱性条件下与过氧化氢反应发生化学发光,且具有较高的化学发光效率[3]。随着人们对化学发光领域的研究不断深入,目前已经构建了多种化学发光体系。化学发光分子在应用过程中不需要外部激发光源,从而可以有效避免外加光源干扰,其在生物成像,特别是活体成像领域具有独特优势。
本文主要介绍鲁米诺、过氧草酸酯、1,2-二氧杂环丁烷化学发光体系在检测和肿瘤治疗中的应用。
1 鲁米诺类化学发光体系
鲁米诺,又称发光氨,1928 年科学家首次发现它被氧化时能发出蓝光[2]。鲁米诺及其衍生物因具有水溶性好、性质稳定、发光效率高、合成简单等特点,被广泛应用于传感、生物成像和肿瘤治疗等领域。
当用氧化剂如过氧化氢处理鲁米诺的碱性水溶液时,会有光产生[4]。在碱性溶液中,鲁米诺首先与碱性物质作用生成中间物鲁米诺负离子;在氧化剂的作用下,鲁米诺负离子被进一步氧化生成不稳定的有机过氧化物中间体,随后分解得到激发态的3-氨基邻苯二甲酸;激发态分子跃迁回到基态的过程中伴随着光的产生,其最大发射波长约为425 nm[5](图1)。鲁米诺类化学发光分子具有化学发光量子产率高的特点,因此常被用于检测生物标记物。

图1 鲁米诺发光原理Fig.1 General luminescence mechanism of Luminol
1.1 鲁米诺化学发光体系在检测活性物种和活体成像中的应用
2011 年,Waite 课题组开发了一种检测羟基自由基的鲁米诺化学发光探针1(图2)。该探针对羟基自由基的检测限为31 nmol/L[6]。2013 年,基于鲁米诺发光体系,Pluth 课题组设计了两种硫化氢化学发光探针2,3(图2)。这两种化学发光探针都对H2S具有强化学发光响应,并且能检测正常生理水平下生物体内的H2S含量[7]。

图2 检测羟基自由基和硫化氢的鲁米诺化学发光探针Fig.2 Chemiluminescence probe for hydroxyl radicals and hydrogen sulfide based on Luminol
尽管鲁米诺化学发光探针具有检测限低、选择性好等特点,但其仍然存在着发射波长短(约425 nm)、组织穿透深度有限等缺点,阻碍了该体系在生物成像中的应用。因此,研究人员通过将鲁米诺化学发光体系与不同荧光染料连接,得到性能改善的鲁米诺化学发光体系。
2007 年,Burgess 课题组将鲁米诺衍生物分别与荧光素(λem=524 nm)和尼罗红(λem=634 nm)共价连接,利用分子内能量转移机理,得到发射波长分别为524 和634 nm 的化学发光分子4 和5[8](图3)。
2015 年,Rochford 课题组将BODIPY 与鲁米诺共价连接,利用化学发光共振能量转移(chemiluminescence resonance energy transfer,CRET)机理,得到具有双发射峰(456,514 nm)(图3)的BODIPY-鲁米诺化学发光分子6[9]。探针6 被应用于检测活体内源性超氧化物,在520 nm 处呈现BODIPY 发射峰。然而,由于较低的化学发光量子产率和较差的细胞膜穿透能力,探针6 在细胞内成像能力相对于母体鲁米诺化学发光分子较差。因此,通过进一步改进提升CRET 效率和细胞通透性,该类化学发光探针有望进一步应用于细胞和活体成像。
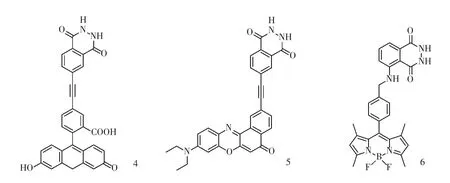
图3 基于能量转移的鲁米诺化学发光体系Fig.3 Luminol chemiluminescence system based on energy transfer mechanism
2021 年,Wang 课题组基于pH 超敏感纳米递送技术平台,构建了一类智能近红外自发光纳米探针7(图4),实现了活体内淋巴转移的成像检测与判断[10]。探针7 由髓过氧化物酶(myeloperoxidase,MPO)响应的化学发光分子鲁米诺、近红外探针焦脱镁叶绿素a(pyropheophorbide a,PPa)和pH 超敏感聚合物3 部分组成。当探针7 进入前哨淋巴结后,被炎性巨噬细胞吞噬,进而在酸性的巨噬体中解离,随后鲁米诺被肿瘤过表达的MPO 激活发光,并通过CRET 将蓝色的化学发光转变为近红外光。借助该化学发光纳米探针,作者成功区分肿瘤转移淋巴结和良性淋巴结;并且在小体积活体肿瘤(100~200 mm3)模型中实现了对转移性前哨淋巴结的早期检测。
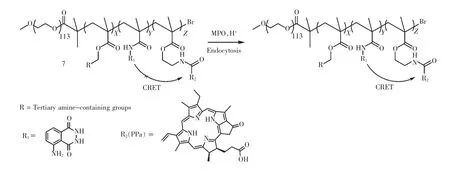
图4 基于鲁米诺化学发光体系的纳米探针Fig.4 Nanoparticles based on Luminol chemiluminescence system
1.2 鲁米诺化学发光体系在肿瘤治疗中的应用
光动力治疗(photodynamic therapy,PDT)是一种非侵入性的、光激活的治疗手段,可用于多种疾病的治疗。然而,目前的光动力疗法多依赖于光敏剂(photo sensitizer,PS)吸收外部光源,因此,PDT 的效果仍然受到光源的穿透深度、光敏剂吸光效率的限制。基于化学发光不需要外加光源这一显著优势,可以有效解决外加光源穿透深度限制PDT 治疗效果的问题。
2019 年,Wang 课题组设计开发了一种新型光疗系统8(图5),该系统由能够发光的鲁米诺化学发光体系和血红蛋白连接的共轭聚合物纳米颗粒(Hb-NPs)组成[11]。如图5 所示,Hb-NPs 可以吸收鲁米诺与H2O2作用后产生的化学发光,从而敏化由血红蛋白产生的氧分子,产生活性氧杀死癌细胞。为了提高循环过程中血红蛋白的稳定性,Hb-NPs 被封装在融合脂质体中,并在与癌细胞接触后被细胞内化。在PDT 过程中,该系统不需要外部光源,且可以解决PDT 过程中细胞内氧分子水平不足的问题。

图5 鲁米诺化学发光系统用于光动力治疗Fig.5 Luminol chemiluminescence system for photodynamic therapy
2 过氧草酸酯类化学发光体系
过氧草酸酯类化学发光因具有高灵敏度、高量子产率和化学发光时间长等优势,被广泛用于生物成像和肿瘤治疗等领域。
过氧草酸酯类化学发光体系属于间接化学发光,一般由草酸酯、氧化剂(通常为过氧化氢)和合适的染料组成。如图6 所示,当体系中的过氧化氢氧化过氧草酸酯产生过氧酸单元后,过氧酸单元经过内部环化反应形成电子激发的1,2-二氧杂环丁酮中间体;随后,中间体分解为二氧化碳释放能量,从而通过CRET 激发附近的荧光团释放化学发光[12]。
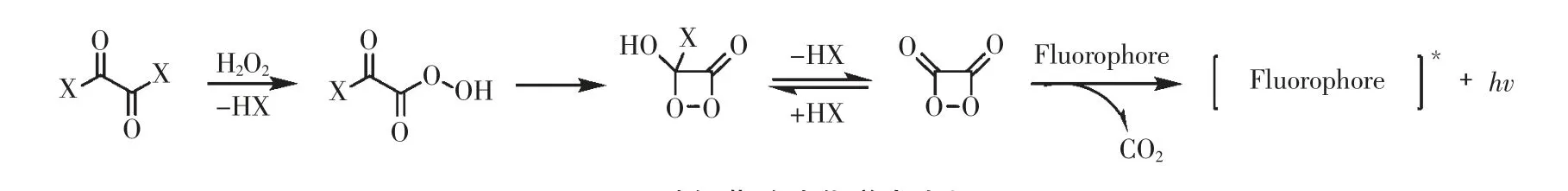
图6 过氧草酸酯化学发光机理Fig.6 General luminescence mechanism of peroxyoxalate
2.1 过氧草酸酯化学发光体系在检测及生物成像中的应用
由于过氧草酸酯化学发光体系遇水易分解,且其化学发光量子产率易受水的影响,因此,过氧草酸酯化学发光体系常被设计为纳米颗粒,用于生物活体成像。
2014 年,Rao 课题组将荧光共振能量转移(fluorescence resonance energy transfer,FERT)机理和化学发光共振能量转移(CRET)机理相结合,设计开发了一种基于半导体材料的纳米颗粒(图7)。该纳米颗粒具有两个独立的成像通道:基于CRET 的过氧草酸酯化学发光通道用于检测H2O2;基于FRET 的荧光成像通道用于检测ONOO-和次氯酸盐[13]。该纳米颗粒成功应用于对乙酰氨基酚(APAP)和异烟肼(INH)诱导的小鼠肝损伤模型中,H2O2和ONOO-同时无串扰成像。
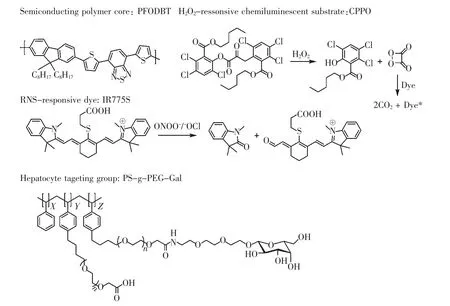
图7 FRET-CRET 半导体聚合物纳米颗粒组分结构Fig.7 Composition structure of FRET-CRET semiconductor polymer nanoparticle
近红外发光成像技术具有低背景荧光干扰、较小的组织光损伤和更深的组织穿透性等优点,因此,开发近红外化学发光体系,可以进一步发挥化学发光在活体成像中的优势。
2016 年,Pu 课题组基于草酸酯发光体构建了过氧化氢响应的近红外化学发光半导体聚合物纳米颗粒9(semiconducting polymer nanoparticles,SPNs)(图8)[14]。以不同光电特性的聚芴衍生物作为发光报告分子,分别与底物双(2,4,6-三氯苯基)草酸酯(TCPO)配对,得到一系列对H2O2具有高选择性的SPN,并从中筛选得到化学发光性能优越的SPN-PFPV。随后,作者将NIR 染料-硅2,3-萘酚菁双(三己基甲硅烷基氧化物)(NIR775)作为CRET能量受体掺入SPN-PFPV 中,得到具有近红外发射的化学发光纳米探针SPN-NIR。SPN-NIR 实现了活体内外源性H2O2与LPS 诱导的腹膜炎和神经炎症中内源性H2O2成像。

图8 过氧草酸酯类化学发光半导体聚合物纳米颗粒的组分结构及响应机理Fig.8 Composition structure and response mechanism of semiconductor polymer nanoparticle based on peroxyoxalate
2020 年,Zhang 课题组设计了级联CRET 和FRET 过程的过氧草酸酯化学发光体系,实现了对关节炎小鼠的近红外二区(NIR-Ⅱ)化学发光成像。该体系由化学发光底物双[3,4,6-三氯-2-(戊氧基羰基)苯基]草酸酯(CPPO)和两个donor-acceptordonor(D-A-D)荧光染料(BTD540,BBTD700)组成[15]。如图9 所示,CPPO 首先被H2O2氧化成不稳定的1,2-二氧杂环丁酮(DOD)中间体;该中间体分解产生的能量通过CRET 过程转移至BTD540;随后,BTD540 通过FRET 过程将能量进一步转移至BBTD700,得到近红外二区发射的化学发光信号。由于BTD540 和BBTD700 的大斯托克斯位移和高荧光共振能量转移效率,该体系的最大发射波长可达935 nm,从而在活体内成像具有更深的穿透深度和更高的信背比。该体系成功实现了对关节炎小鼠中H2O2的近红外二区化学发光成像。
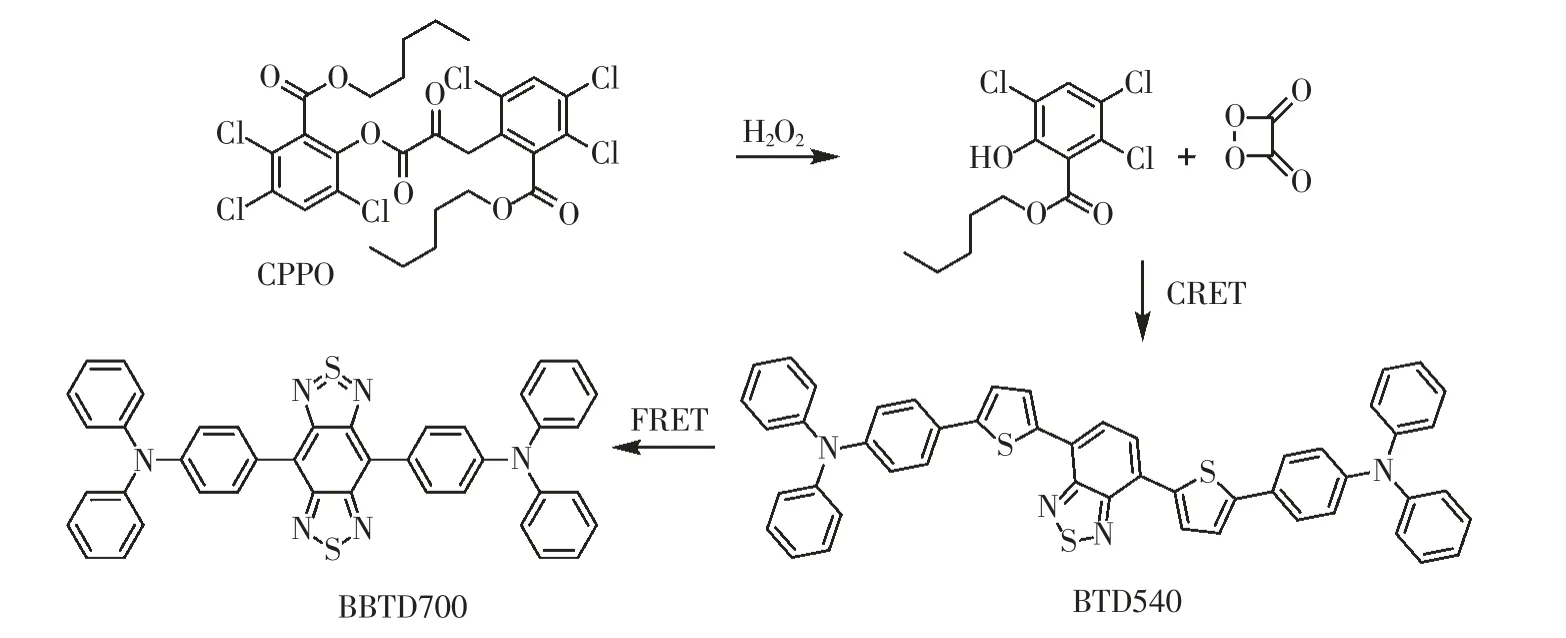
图9 过氧化氢激活NIR-II 化学发光探针的过程及机理Fig.9 Activation mechanism of NIR-II chemiluminescence probe towards hydrogen peroxide
2.2 过氧草酸酯化学发光体系在肿瘤治疗中的应用
2017 年,Liu 课题组构建了一种基于聚集诱导发光和化学发光的新型纳米诊疗体系,用于成像指导的化学激发光动力治疗。该纳米体系由双[2,4,5-三氯-6-(戊氧基羰基)苯基]草酸酯(CPPO)与新型的具有近红外发射和活性氧生成能力的AIE 光敏剂TBD 组成(图10)[16]。H2O2氧化CPPO 产生的化学能经过CRET 过程传递给AIE 体系,既能够产生近红外化学发光信号实现活体肿瘤精准成像,也可以有效产生单线态氧,诱导肿瘤细胞凋亡和抑制肿瘤细胞生长。

图10 化学发光诊疗体系的构建和激活机理Fig.10 Construction and activation mechanism of chemiluminescence diagnosis and treatment system
3 1,2-二氧杂环丁烷类化学发光体系
在鲁米诺类和过氧草酸酯类的化学发光体系中,需要氧化剂触发化学发光,因此常被设计为检测活性物种的探针,而在检测其他物种方面应用较少。此外,过氧草酸酯化学发光体系常被设计为间接化学发光探针,而化学发光能量转移效率会对化学发光强度产生较大影响。这些因素限制了鲁米诺和过氧草酸酯化学发光体系在生物成像方面的应用。
1969 年,Mumford 课题组在3,3,4-三甲基-1,2-二氧杂环丁烷热分解为丙酮和乙醛的过程中观察到发光。当在苯溶液中于60 ℃分解时,3,3,4-三甲基-1,2-二氧杂环丁烷最大发射波长为430~440 nm[17](图11),该项研究证明了1,2-二氧杂环丁烷类分子在构建化学发光体系方面的潜力。

图11 1,2-二氧杂环丁烷热分解发光过程Fig.11 Thermal decomposition and luminescence process of 1,2-Dioxetane
3.1 1,2-二氧杂环丁烷类化学发光体系的发展历程
1982 年,在生物发光的启发下,Schaap 课题组发现酚羟基取代基的去质子化可以将稳定的、发光效率低的二氧杂环丁烷转化为性能优越的发光中间体[18]。当酚羟基去质子形成酚盐后,电子从酚盐取代基向杂环丁烷转移从而引发1,2-二氧杂环丁烷的裂解,得到电荷转移激发态,激发态跃迁回基态的过程中,其能量以光辐射的形式释放(图12)。相较于酚羟基取代,酚盐取代的1,2-二氧杂环丁烷的分解速率是其4.4 × 106倍,证明酚盐是产生分子内电子转移从而产生化学发光的关键物质。

图12 1,2-二氧杂环丁烷类化学发光机理Fig.12 General luminescence mechanism of 1,2-Dioxetane
1987 年,Schaap 课题组在上述结构的基础上引入了金刚烷取代基,进一步提升了1,2-二氧杂环丁烷衍生物的热稳定性[19],基于此,Schaap 首次开发出生物酶激活的化学发光体系(图13,化合物10)。同时,由于羟基易于修饰,Schaap 课题组所开发的这种化学发光体系可以作为检测各种生物物质的通用化学发光平台。当检测底物存在时,羟基的保护基团(即识别基团)断裂,释放出不稳定的酚盐结构,随即发生分子内电子转移和电子回转,导致分子裂变,释放能量,并激发苯甲酸酯产生光(图13)[20]。
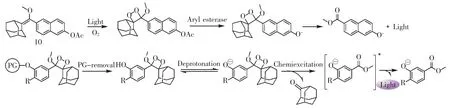
图13 乙酰酯酶激活的二氧杂环丁烷化学发光体系及发光机理Fig.13 Dioxetane chemiluminescence system and luminescence mechanism activated by acetyl esterase
3.2 1,2-二氧杂环丁烷类化学发光体系性能调控新策略
相较于其他化学发光体系,1,2-二氧杂环丁烷类并不依赖于氧化物种来激发化学发光,因此,该体系可根据需求构建多种化学探针。然而,早期的1,2-二氧杂环丁烷化学发光体系仍然存在着易被水猝灭、发光强度低、发射波长短等缺点,难以在生物体内应用。
1989 年,Schaap 课题组将1,2-二氧杂环丁烷化学发光分子和荧光染料包裹在十六烷基三甲基溴化铵(CTAB)中,形成的胶束将化学发光分子与水隔离,有效避免了水对化学发光的猝灭作用。当化学发光分子被激活后,其能量转移至共同包裹在胶束中的荧光染料,使化学发光强度相较于单独化学发光体系增强400 倍(图14,化合物11)[21]。然而,考虑到胶束稳定性及毒性问题,基于该策略构建的化学发光体系无法用于生物成像。

图14 基于能量转移的胶束包封的化学发光体系Fig.14 Micellar encapsulated chemiluminescence system based on energy transfer
2019 年,Shabat 课题组用荧光染料-β-环糊精包封1,2-二氧杂环丁烷形成主客体复合物。β-环糊精的包封作用可以有效避免水的猝灭作用,同时化学能传递激活荧光染料能显著增强化学发光。与单独存在的化学发光分子相比,该主客体复合物使化学发光强度增强了1 500 倍,在活体层面实现了LPS 诱导炎症期间小鼠腹腔内内源性H2O2成像[22]。
为提升1,2-二氧杂环丁烷类化学发光体系的化学发光强度,2016 年,Shabat 课题组通过将化学发光分子与荧光染料共价连接,得到了荧光显著增强的化学发光体系。当化学发光分子结构中与酚羟基相连的保护基团在底物的作用下脱除后,释放出化学能,该能量随即通过共价键传递至荧光染料,激活染料发光[23](图15)。基于以上原理,该课题组设计了两种响应β-半乳糖苷酶(β-gal)的化学发光探针12 和13,完成了对HEK293-LacZ 细胞中过表达的β-gal 的高对比度成像。当探针在体外被β-gal激活后再进行活体注射,探针12 实现了小鼠皮下注射的外源性β-gal 成像;而借助近红外化学发光特性,探针13 实现了小鼠腹腔内注射的外源性βgal 的高对比度成像。

图15 与荧光染料共价连接的1,2-二氧杂环丁烷化学发光体系Fig.15 1,2-Dioxetane chemiluminescence system conjugated to fluorescent dyes
虽然将1,2-二氧杂环丁烷与荧光染料共价连接,可以在一定程度上增强化学发光强度,但最终化学发光强度会受到化学发光能量转移效率的影响。此外,基于上述策略构建的间接化学发光染料还存在着光稳定性差、合成困难等缺点。因此,设计开发直接化学发光的染料和探针,对进一步发挥化学发光在活体成像中的优势十分必要。
2017 年,Shabat 课题组通过在1,2-二氧杂环丁烷化学发光母体结构酚羟基邻位引入不同吸电子基团,获得了具有直接化学发光且具有高量子产率的化学发光染料。该类化学发光染料的化学发光量子产率最高可提高3 个数量级(表1)[24]。基于以上设计策略,Shabat 课题组设计开发了系列直接化学发光探针用于活体生物酶(化合物19、20)[25-26]、小分子(化合物21、22)[27-28]等的检测(图16)。
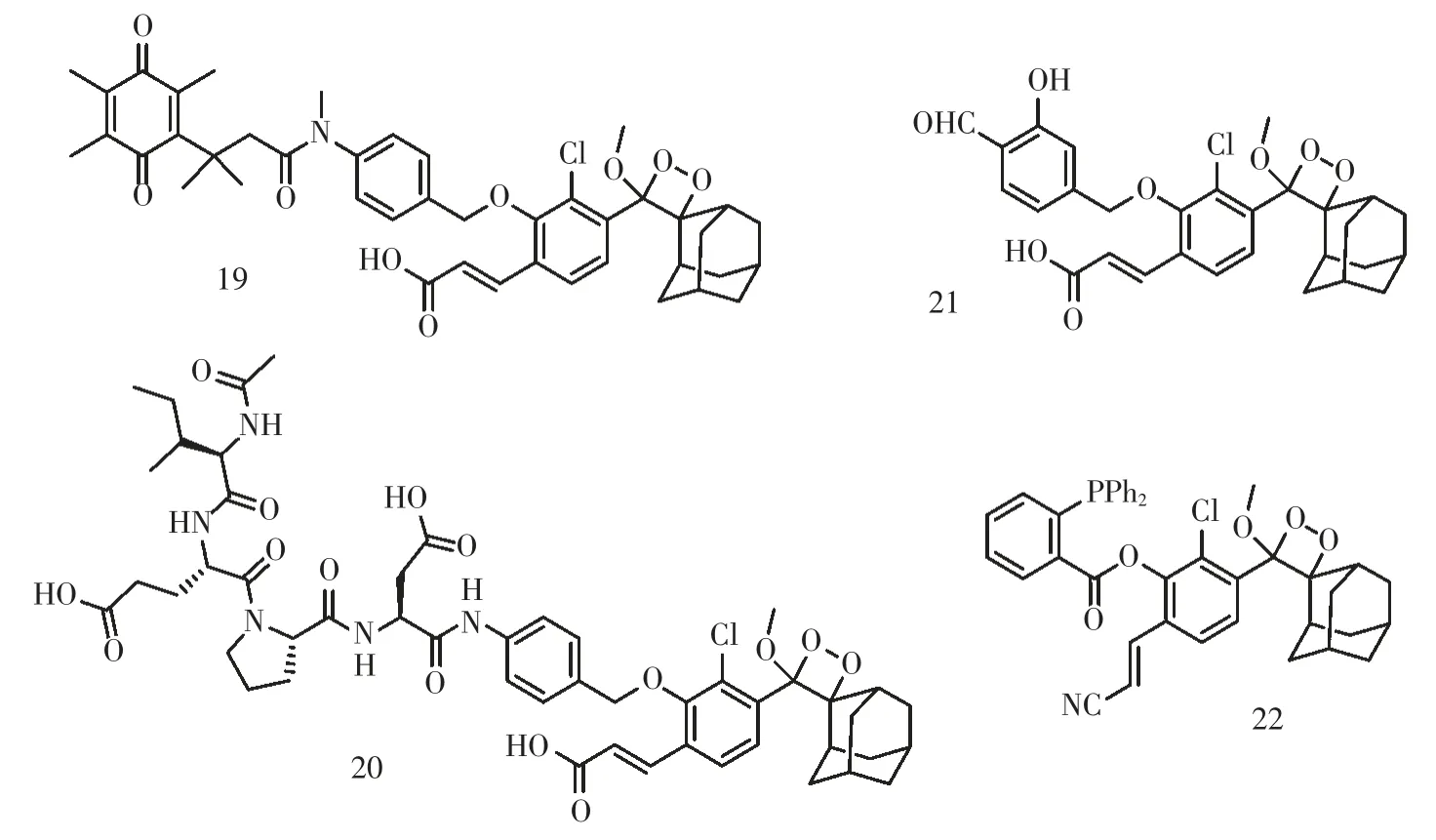
图16 基于1,2-二氧杂环丁烷的化学发光探针Fig.16 Chemiluminescence probes based on 1,2-Dioxetane

表1 吸电子取代基对化学发光性质的影响Tab.1 The influence of electron-withdrawing substituents on chemiluminescence properties
3.3 1,2-二氧杂环丁烷类化学发光体系波长调控策略及多模式生物应用
上述基于1,2-二氧杂环丁烷的直接化学发光探针可以用于活体成像,但它们的发射波长大多位于可见光区,这不利于更深层组织的活体成像。
2017 年,Shabat 课题组将化学发光分子与近红外荧光染料(DCMC)共价连接,扩展了化学发光母体的共轭体系,得到了最大发射波长为690 nm 的直接近红外化学发光染料(图17,化合物23)。在此染料的基础上,他们还分别构建了对β-gal(化合物24)和H2O2(化合物25)特异性响应的近红外化学发光探针,并将H2O2探针用于小鼠炎症模型活体成像[29]。基于此种策略构建的近红外化学发光染料具有比较突出的活体成像效果,因此,这类近红外化学发光染料也被设计为探针用于活体内检测疾病相关活性物种(化合物26、27、28)[30-31](图17)。
2021 年,Pu 课题组将二氰基亚甲基-4H-苯并硫代吡喃和二氰基亚甲基-4H-苯并硒基吡喃与二氧杂环丁烷单元连接,得到了最大发射波长分别为760 和780 nm 的近红外化学发光染料29 和30(图17),基于这两种染料构建的响应β-gal 的化学发光探针能够实现肿瘤细胞和荷瘤小鼠中β-gal 的高对比度成像[32]。

图17 基于1,2-二氧杂环丁烷的近红外化学发光探针Fig.17 Near infrared chemiluminescence probes based on 1,2-Dioxetane
基于化学发光在活体成像方面的突出优势,2018 年,Shabat 课题组将化学发光与前药相结合,通过化学发光强度来监控药物释放。如图18 所示,当探针31 被β-gal 激活后,释放出单甲基耳他汀E药物的同时产生化学发光信号。该课题组在细胞水平证明了探针31 的化学发光强度与药物释放水平具有良好的线性关系,同时释放的药物能够有效杀死癌细胞[33]。
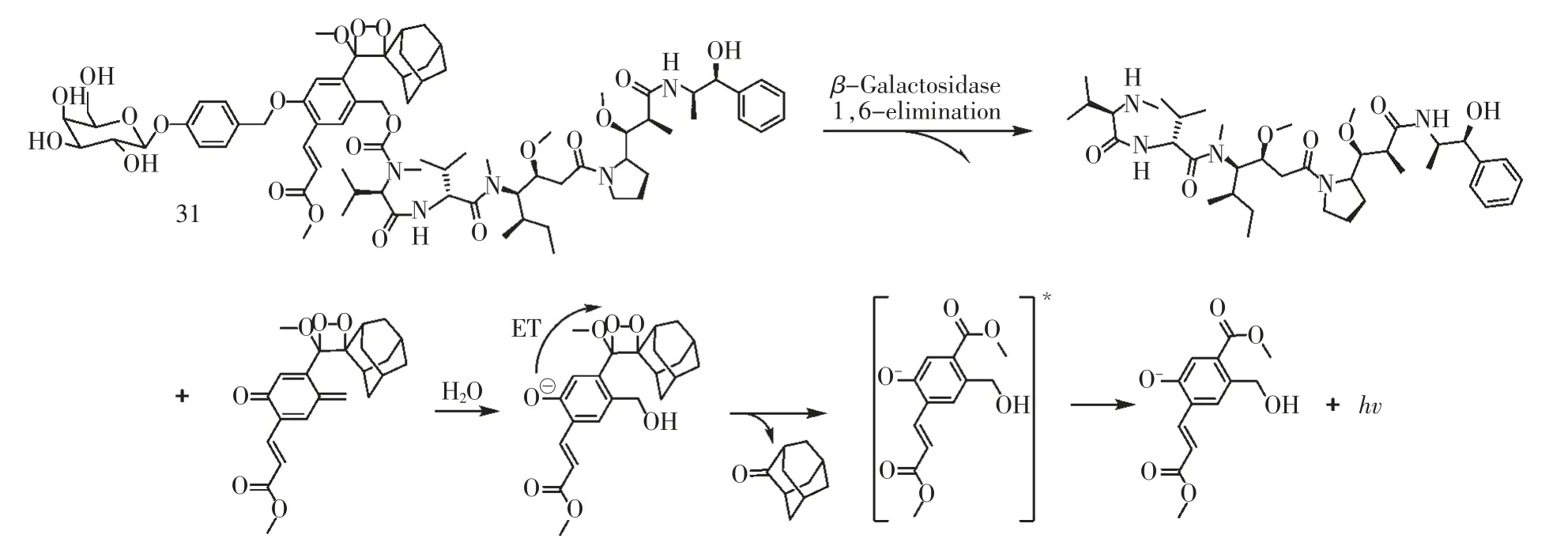
图18 基于1,2-二氧杂环丁烷的化学发光探针用于前药设计Fig.18 Chemiluminescence probe based on 1,2-Dioxetane for prodrug design
为进一步拓展化学发光探针在复杂生物环境中的应用,2019 年,Pu 课题组报道了单分子荧光-化学发光探针32 用于小鼠肝损伤过程中多组分同时双模态成像。如图19 所示,该探针利用化学发光成像通道可以实现超氧阴离子的成像;借助荧光成像通道可以检测caspase-3 的活性。在活体层面,该探针能够实现药物诱导小鼠肝毒性发展过程中氧化应激和细胞凋亡阶段的标记物的纵向检测和成像[34]。借助双模态成像的优势,该探针可以在无光谱串扰的前提下检测出肝毒性过程中超氧阴离子和caspase-3 水平的顺序上调。这种检测策略为多目标的检测提供了新的思路,还成功实现了对急性肾损伤发展过程中多种目标物的检测[35-36]。

图19 单分子荧光-化学发光报告分子及其响应机理Fig.19 Unimolecular chemo-fluoro-luminescent reporter and response mechanism
4 总结与展望
相较于其他成像手段,化学发光不需要额外的激发光源,因此,在活体成像中,化学发光具有背景荧光干扰小、成像对比度高的突出优势,目前已被广泛应用于生物传感、成像和肿瘤治疗等领域。在本文中,我们详细介绍了鲁米诺、过氧草酸酯、1,2-二氧杂环丁烷化学发光体系的发光机理、设计策略,以及在生物体内检测活性物种和肿瘤治疗等方面的应用。
化学发光强度低是限制化学发光生物应用的主要因素,研究人员通过多种策略来增强化学发光强度,例如:将化学发光体系与荧光染料共价连接,通过化学发光共振能量转移过程增强化学发光;Shabat 课题组在分子结构中引入不同吸电子基团,构建直接化学发光染料并提升染料化学发光强度,在所得染料的基础上设计开发可生物体内检测酶和活性物种的化学发光探针。因此,通过对化学发光分子进行结构改进,有望获得更多性能优越的化学发光体系。
尽管化学发光体系在探针设计和应用方面已取得快速进展,但它仍然存在一些问题亟待解决与突破:1)基于1,2-二氧杂环丁烷化学发光体系已构建出多种激活型探针用于检测生物体内的酶和小分子,但此类化学发光染料仍然存在着合成路线复杂、波长较短的问题,限制其在探针设计、生物传感和成像方面的应用。因此,开发合成简单的新型化学发光体系,对发挥化学发光的成像优势十分必要。2)近红外化学发光染料已被设计合成,而相较于近红外一区(NIR-I,700~900 nm),近红外二区成像在组织穿透深度和成像信背比方面具有不可比拟的优势。因而,设计开发NIR-II 化学发光染料和探针将进一步促进化学发光在活体成像中的应用。3)与一些水溶性、脂溶性荧光染料相似,当化学发光探针在生物体内被激活时,释放的染料分子易从反应部位扩散,从而较难提供成像的原位信息。因此,开发能够原位成像的化学发光体系对提升成像准确度具有重要意义。
综上所述,化学发光作为一种成像分析手段,在生物应用中具有独特的优势。通过设计开发新型化学发光体系或对现有的化学发光体系进行修饰和改进,可得到性能更优越的化学发光体系,扩大其生物应用范围。

