巢式PCR联合焦磷酸测序检测乙肝病毒耐药基因的方法建立和初步临床应用
刘 玲 李从荣 郑 毅 赵友云
1.武汉大学人民医院检验科(湖北武汉,430060) 2.湖北省中医院检验科
HBV基因组在复制过程中,在经过RNA逆转录复制过程中,因RNA聚合酶和逆转录酶缺乏严格的校正机制,使病毒基因的复制过程中极易发生核苷酸的错配,因此,HBV是一种变异性极高的病毒。在机体自身、药物和病毒的多重作用下,HBV DNA聚合酶的逆转录活性区 (RT区)会发生多种耐药突变[1]。耐药突变不仅会降低抗病毒治疗的效果,还会使乙型肝炎进一步进展、恶化。HBV基因变异及其导致的药物靶位氨基酸的替代是导致病毒耐药的基础,所以对HBV耐药突变位点的检测极具临床意义。本研究的目的是建立能适用临床检测HBV对核苷 (酸)类似物耐药突变的巢式PCR联合焦磷酸测序技术的检测体系。
1 材料与方法
1.1 病例来源 选取223例于2011年8月至2013年2月间在湖北省中医院肝病科就诊的CHB患者,诊断标准参照《慢性乙型肝炎防治指南》[2],其中192例曾经或现在接受核苷(酸)类似物治疗 (用药组),31例此前无核苷 (酸)类似物治疗史 (未用药组)。男176人,女47人;患者年龄 (41±33)岁。
1.2 重组质粒及标准株 HBV B、C型野生标准株由武汉大学生命科学学院病毒学国家重点实验室提供,定量至2×105copies/ml,作为标准病毒DNA。HBV标准野生株重组质粒(pHBV)873bp包含有 8个突变位点 (rt173L、rt180M、rt181V、rt184G/I/S、rt202I/G、rt204I/V/S、rt236T、rt250V/L)由上海生工生物公司合成。质粒由2×105copies/ml逐级10倍稀释至2×102copies/ml作为标准质粒DNA,对巢式PCR体系进行评估。
1.3 实验方法
1.3.1 引物设计 从美国国立生物技术信息中网络数据库(NCBI,http://www.ncbi.nlm.nih.gov)下载 A、B、C、D型HBVP基因片段,作为靶基因。针对其P基因RT区,在上下游使用Primer Expresx 3.0分别设计两对引物,命名为P引物。引物除须满足设计的基本要求外,还要保证内外引物间有50-150bp的距离,并用Blast验证两对引物的特异性。第一轮引物命名为P1/P2,第二轮PCR引物命名为P3/P4(见表1)。所有的引物均委托上海生工生物公司合成。

表1 巢式PCR引物序列
1.3.2 HBV DNA提取 患者血液以EDTA抗凝后离心取血浆,按照上海复星科技有限公司生产的HBV检测试剂盒说明书进行核酸提取。
1.3.3 巢式PCR反应体系及参数 标准病毒HBV DNA(浓度为2×105copies/ml且包括B/C型)、标准质粒DNA(浓度为2×105copies/ml至2×102copies/ml),每个标准质粒DNA均平行重复两次。根据在同一扩增条件下不同反应体系扩增的PCR产物电泳条带效果和PCR速度最快原则来确定最优反应体系 (见表2)。
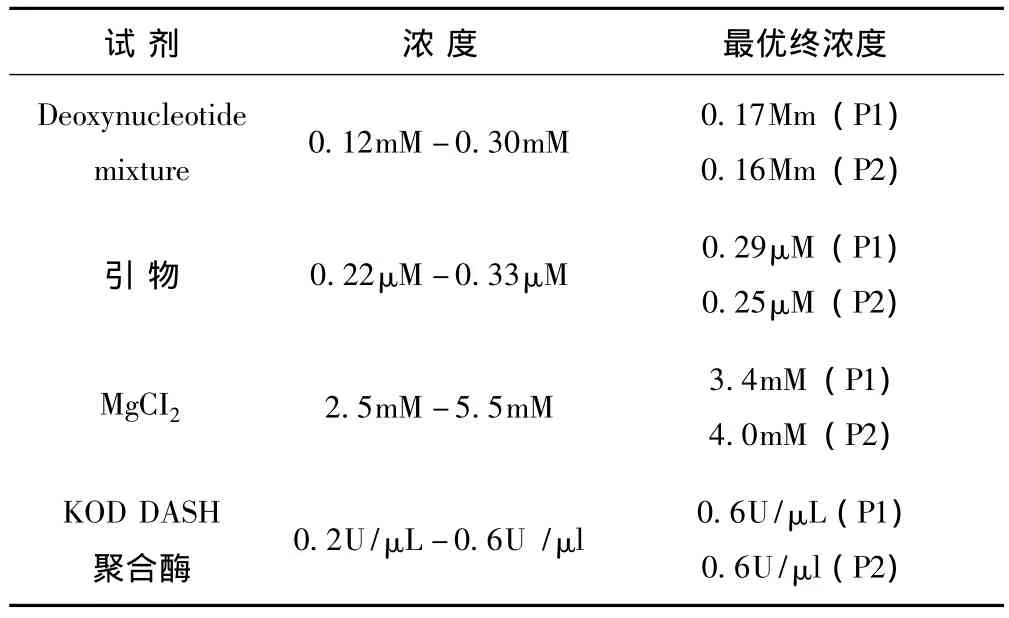
表2 巢式PCR反应体系优化
1.3.4 巢式PCR实验 根据引物设计参数确定最佳反应条件如下:引物P1/P2:第一轮94℃ 6分钟;94℃ 30秒,60℃ 5秒,74℃ 30秒,40个循环;74℃ 6分钟。引物P3/P4:第二轮94℃ 6分钟;94℃ 30秒,55℃ 5秒,74℃ 26秒,40个循环;74℃ 6分钟。
按照表2中的反应体系优化结果,配制巢式PCR反应缓冲液。50μl反应体系包含对应浓度的上述试剂和5μl DNA模板。
1.3.5 琼脂糖凝胶电泳检测PCR产物 取5.5μl PCR产物在1.5%琼脂糖凝胶上电泳,检测目的条带是否存在及其亮度。将产物电泳结果阳性的样本,送测序公司,进行焦磷酸测序。
1.3.6 测序结果的序列比对 将测序结果中,seq格式序列与NCBI上下载的HBV标准野生毒株序列用Mega 4.0进行比对,从而得到巢式PCR反应的最低检测浓度。将测序结果的ab1格式文件,用Chromas软件对其中标准质粒DNA的测序情况进行分析,检查是否出现重叠峰,是否发生突变,验证质粒DNA纯度及PCR产物的特异性。
1.3.7 临床样本的检测 对223例CHB患者进行巢式PCR检测,同时以荧光定量PCR反应对其病毒载量定量。将测序结果的 seq格式文件中的序列复制到 http://www.ncbi.nlm.nih.gov/projects/genotyping/formpage.cgi可得到HBV分型结果。将ab1格式文件用Mega 4.0与HBV标准序列片段进行比对可得到HBV耐药突变结果。对用药组和未用药组结果数据进行分析,评估核苷类似物治疗对患者体内HBV病毒变异的影响。
2 结果
2.1 巢式PCR产物检测下限 本实验通过巢式PCR技术,利用两对引物成功扩增出HBV P基因RT区长约755bp,B/C型标准病毒DNA都能由P引物成功扩增出阳性条带。标准质粒DNA用引物经两轮约4小时巢式PCR扩增后,质粒DNA浓度由2×105copies/ml至2×103copies/ml者均在设计长度位置有可见的明亮阳性条带;浓度为2×102copies/ml时有隐约的可见条带 (图1、图2),但送测序后,均显示反应弱,测序失败。故初步确定2×103copies/ml为巢式PCR反应的检测下限。
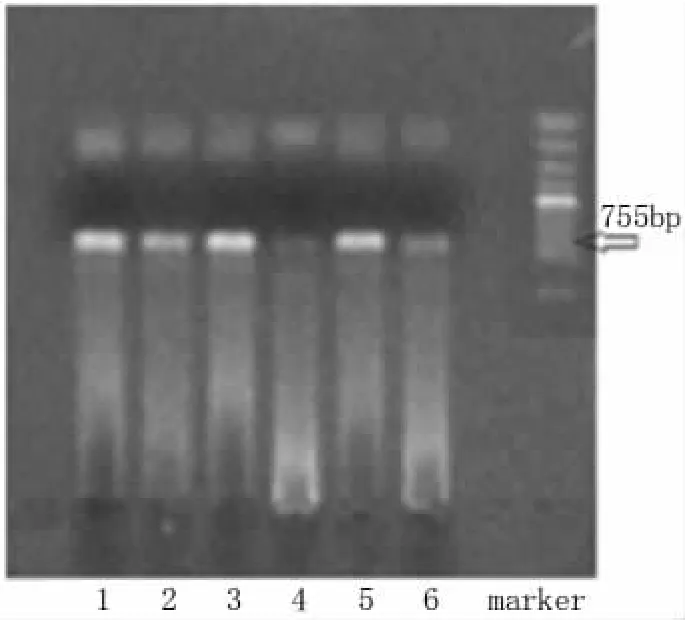
图1 质粒和标准HBV巢式PCR产物电泳图(1~4为2×105copies至2×102copies质粒,5、6为B、C型标准HBV DNA)
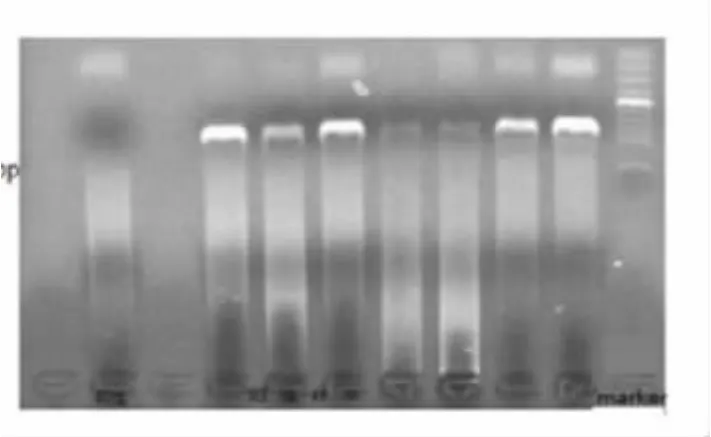
图2 HBV巢式PCR产物电泳图
2.2 测序结果分析及序列比对 标准病毒DNA、标准质粒DNA测序结果均未出现重叠峰现象,测序结果良好,表明实验中未出现非特异性扩增和污染现象。B/C型标准病毒测序结果于美国国立生物技术信息中心数据库中进行分型均与其对应的型别相符 (图3)。浓度为2×105copies/ml至 2×103copies/ml的标准质粒DNA经巢式PCR扩增产物测序结果良好,且条带长度基本与设计相符。
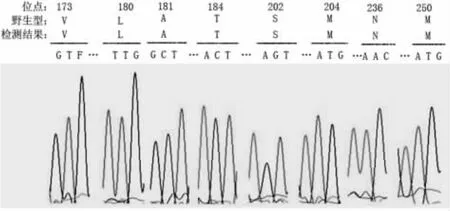
图3 标准病毒DNA测序结果
2.3 巢式PCR反应结合焦磷酸测序技术的临床应用 利用本巢式PCR反应结合焦磷酸测序体系,进行的临床应用的初步探索,将223例慢性乙肝患者分为用药组和未用药组,选取RT中的8个位点 (rt173L、rt180M、rt181V、rt184G/I/S、rt202I/G、rt204I/V/S、rt236T、rt250V/L)作为靶位点分析。所有样本均能通过巢式PCR扩增出阳性条带,并成功测序。在用药组192例中,53例 (27.6%)患者发生耐药突变,其中30.1%(16例)发生204位点突变,产生180位点、181耐药突变的均为5.6%(3/53),3.8%(2/53)发生236位点突变,1.9%(1/53)发生202位点突变;37.7(20/53)同时产生180/204位点突变,同时发生181/236、204/250位点突变的均为3.8%(2/53);同时发生3个位点突变的占7.5%(173/180/240、180/181/204、180/184/204、180/202/204各1例)。用药组患者的测序进行基因分型表明153例(79.7%)为B型HBV,39例 (20.3%)为C型HBV。上述突变中,204位点突变往往伴随着180位点的同时突变 (24例,占突变患者的45.3%)(图4)。未用药组31例中,未发现耐药突变的现象,基因分型结果表明25例 (80.6%)为B型HBV,6例 (19.4%)为C型HBV。
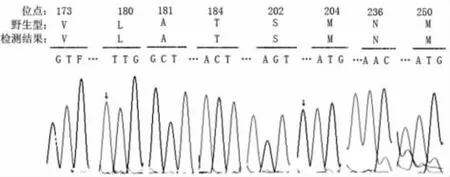
图4 180、204位点突变测序结果(箭头指示突变碱基)
3 讨论
当前对CHB的治疗主要是采用核苷 (酸)类似物和干扰素进行抗病毒治疗,核苷 (酸)类似物尽管具有强大的HBV DNA抑制作用、能方便地口服给药、不良反应也较干扰素少等优点,但选择其作为首选治疗策略的病患须面对长期用药和逐年增高的耐药风险的现实[1,3~6]。
现阶段针对CHB耐药的检测主要有基因型耐药和表型耐药两种[1,6]。当病毒对某些药物产生耐药性时,病毒基因会发生一些明确的突变,且基因型耐药往往在表型耐药前1~3个月出现。因此,在临床治疗过程中对HBV进行耐药基因型的检测,将有助于帮助医生及时给出或调整治疗方案,延缓或阻止表型耐药的发生。基因型耐药检测方法目前常用的有直接测序法、限制性片段多态性分析法、线性探针反向杂交、基因芯片法4种。直接测序法又是其中最为直观的,且能同时检测多个耐药突变位点。
本研究所建立的巢式PCR结合焦磷酸测序技术的HBV耐药突变检测方法中,能对B/C型HBV DNA进行良好的扩增、测序。在对少量临床样本的初步探索中,只检测到B型、C型HBV,且B型居多,与湖北地区的流行病学数据基本相符[7,8]。研究中针对拉米夫定、恩替卡韦、替比夫定、恩曲他滨和阿德福韦酯5种核苷 (酸)类似物的突变位点检测,显示204位点由野生型的M突变为YIDD和YVDD的明显高于其他位点的突变,且180位点突变往往同时突变,这可能与临床上对拉米夫定和恩替卡韦两种药物的大量使用有关[1,2]。
本检测技术能进行HBV多个耐药位点的检测,还能同时进行病毒基因分型,为治疗药物的选用、调整和疗效判断提供重要的依据。巢式PCR方法不需要特殊的检测仪器和昂贵的进口试剂,操作简单快捷;即使不具备焦磷酸测序条件的普通临床实验室也可联合商业测序公司完成HBV分型和耐药突变位点的检测,适合临床推广使用。
[1]杨松,温少芳,闫杰.乙型肝炎病毒耐药专家共识:2009年更新[J].中华实验和临床感染病杂志 (电子版),2009,3:72-79.
[2]中华医学会肝病学分会,中华医学会感染学分会.慢性乙型肝炎防治指南 [J].中华临床感染病杂志,2011,4:1-13.
[3]黄海舟,王荣先,周晓靓.乙型肝炎治疗药物应用进展与研究开发策略 [J].医药导报,2008,27(4):397-400.
[4] HSU YS,CHIEN RN,YEH CT,et al.Long- term outcome after spontaneous HBeAg seroconversion in patients with chronic hepatitis B[J].Hepatology,2002,35(6):1522-1527.
[5] CHEN YC,CHU CM,YEH CT,et al.Natural course following the onset of cirrhosis in patients with chronic hepatitis B:a long-term follow-up study[J].Hepatol Int,2007,1(1):267-273.
[6]耿颖,张建军.乙型肝炎病毒基因变异与临床[J].医学综述,2008,14(4):544-546.
[7]周建平,王鸣,王忠提,等.湖北咸宁地区正常人群与血吸虫疫区人群感染HBV基因型分析 [J].实用预防医学,2010,17(10):2096-2098.
[8]贾昱娴,田德英,章述军.365例乙型肝炎基因型分布与临床相关性研究[J].中西医结合肝病杂志,2009,19(4):235-237.
——一道江苏高考题的奥秘解读和拓展

