心肌梗死模型大鼠心肌组织基因表达变化及缝隙连接相关基因分析1)
吴爱明,翟建英,张冬梅,娄利霞,朱海燕,赵明镜,王硕仁
心肌梗死(MI)是威胁人类健康的主要疾病之一[1],在我国发病率呈现逐年升高趋势[2]。虽然随着MI后再灌注治疗的普及,患者早期死亡率大幅降低[3],但是幸存的MI患者仍具有发生致死性心律失常的潜在风险[4]。这与基因的改变和调控密不可分。因此,有必要从基因水平研究MI后心律失常的发生机制,以进一步降低MI患者的猝死率。本研究制作MI大鼠模型,进行了左心室心肌组织的全基因组表达谱芯片检测和分析,并采用实时荧光定量聚合酶链反应(Real-time PCR)方法验证了心肌细胞间缝隙连接通路相关的3条基因,旨在为进一步从基因水平认识MI后心律失常发生的分子机制提供实验依据。
1 材料与方法
1.1 实验动物 雄性SD大鼠,平均体重220g~250g,由北京维通利华实验动物技术有限公司提供,许可证编号:SCXK(京)2002-0003。
1.2 主要仪器 RSP1002型呼吸机(美国Kent公司),心电示波仪(上海医学电子仪器厂),杂交炉(美国Agilent公司),扫描仪(美国 Agilent公司),分光光度计(美国Nanodrop公司),Realtime PCR仪(美国Stratagene公司)。
1.3 主要试剂 RNA提取试剂盒(美国Promega公司),RT试剂盒(美国Promega公司),SYBER Green染料(美国ABI公司)。Agilent大鼠全基因组表达谱芯片(生物芯片上海国家工程研究中心)。
1.4 动物模型制备与分组方法 大鼠随机分为模型组和假手术组,参照文献[5]制作 MI大鼠模型,用戊巴比妥钠(50mg/kg)麻醉,固定备皮,气管插管,连呼吸机和心电图仪。在左胸第三、四肋间开胸约1.5cm,用眼科弯镊轻提左心耳,在动脉圆锥与左心耳之间下约1mm处用5/0手术线结扎左冠状动脉前降支,迅速关胸缝合。心电图Ⅱ导联显示ST段显著抬高表示结扎成功。假手术组只穿线,不结扎。术后常规饲养1个月取材。
1.5 心肌组织的基因芯片检测和生物学信息分析方法 由生物芯片上海国家工程研究中心完成。首先提取心肌组织样本的总RNA,质检合格后进行总RNA纯化,cDNA合成,cRNA合成,cRNA纯化,cRNA单荧光染料(Cy3)标记,芯片杂交、洗涤、扫描,归一化处理等一系列步骤,得到基因芯片检测结果。然后对模型组和假手术组的芯片数据进行差异基因分析,根据基因在两个分组中几何平均数的比值倍数决定差异基因的变化方向,比值大于1的基因为上调基因,小于1的是下调基因。用Fold Change值表示两组数据均一化以后的信号值的差异倍数。差异基因筛选标准为Fold Change值≥2或≤0.5。在此基础上利用京都基因与基因组百科全书(The Kyoto Encyclopedia of Genes and Genomes,KEGG)细胞通路(pathway)数据库进行差异基因的pathway注释,对差异基因富集的pathway进行归类,初步分析MI后pathway的变化。
1.6 心肌组织缝隙连接蛋白43(Cx43)、蛋白激酶C(PKC)、酪蛋白激酶1(CK1)的mRNA检测方法 登陆GenBank检索基因序列,用Primer Premier 5软件进行引物设计。Cx43上游引物:5′-TTCATGCTGGTGGTGTCC-3′;下游引物:5′-AGTGGTGGCGTGGTAAGG-3′。CK1 上游引物:5′-TACCGCCAACCGACTCCGAAGT-3′ ;下游引物:5′-GCGCACCTCTGTGGAGTCTCAT-3′。PKC 上游引物:5′-GCTTCAACATCGACATGCCTCACC-3′;下游引物:5′-ACATTCATGCCGCAGTCTTCACACT-3′。内 参 基 因 β-Actin 上游引物:5′-AGATCCTGACCGAGCGTGGC-3′;下游引物:5′-CCAGGGAGGAAGAGGATGCG-3′。提取左心室梗死边缘区心肌组织总RNA,M-MLV逆转录酶反转成cDNA,加入SYBR Green PCR Master Mix组成251反应体系,每个样本做3个平行管,进行Real-time PCR检测。扩增条件均为:95℃10min变性后;95℃30s,55℃30s,72℃20s,共40个循环。以β-Actin作为内参,将所得Ct值按照2(-ΔΔct)的方法计算mRNA的相对表达量,以差异倍数进行统计分析。
2 结 果
2.1 RNA纯度和完整性检测结果(见表1) 总RNA经分光光度计检测,OD260nm/OD280nm,比值介于1.8~2.1;经琼脂糖凝胶电泳鉴定,28S、18S两条带清晰可见,且无拖尾现象,提示完整性良好,可以进行基因表达谱芯片检测。

表1 RNA抽提检测结果
2.2 基因芯片检测和生物学信息分析结果 Agilent大鼠全基因组表达谱芯片采用Cy3单色荧光标记,芯片涵盖了41 012个大鼠基因。按照差异表达基因筛选标准,与假手术组比较,模型组共筛选出上调表达的基因3 136条,下调表达的基因2 222条。pathway富集度分析显示,这些差异基因共涉及了130个pathway。对检索到的pathway进行初步归类,主要涉及了糖、脂、核酸、氨基酸、能量等新陈代谢pathway;基因转录、蛋白水解、修饰等遗传信息处理pathway;膜转运、信号转导、信号分子等环境信息处理pathway;还有运输分解、细胞的运动、生长、死亡以及细胞间通讯等细胞过程pathway。其中与MI后心律失常发生关系比较密切的是细胞通信pathway,并且其重要分支缝隙连接pathway中的关键蛋白Cx43及其上游激酶CK1和PKC的基因表达出现了显著的下调和上调。
2.3 MI大鼠心肌组织Cx43、PKC、CK1mRNA检测结果 采用Real-time PCR检测相关基因表达,与假手术组比较,模型组Cx43和CK1mRNA表达显著降低(P<0.05或P<0.01),PKC mRNA表达显著增加(P<0.05)。详见表2。
表2 MI大鼠心肌组织Cx43、CK1、PKC mRNA表达的比较(±s)
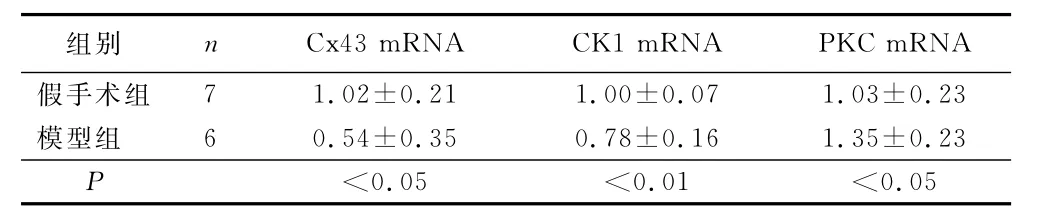
表2 MI大鼠心肌组织Cx43、CK1、PKC mRNA表达的比较(±s)
组别 n Cx43mRNA CK1mRNA PKC mRNA假手术组7 1.02±0.21 1.00±0.07 1.03±0.23模型组 6 0.54±0.35 0.78±0.16 1.35±0.23 P<0.05 <0.01 <0.05
2.4 MI大鼠心肌组织Cx43与CK1、PKC mRNA表达的相关分析结果 经Pearson相关分析,MI大鼠心肌组织Cx43mRNA表达与CK1mRNA呈显著正相关(P<0.01),与PKC mRNA呈显著负相关(P<0.05)。详见表3。

表3 MI大鼠心肌组织Cx43与CK1、PKC mRNA表达的相关分析
3 讨 论
基因芯片技术是指通过微阵(Microarray)技术将高密度的DNA片段附着在固相表面,以同位素或荧光标记的DNA探针,借助碱基互补杂交原理,进行大量基因表达测试,具有高通量的特点[6]。基因芯片实验技术包括基因表达测试——生物信息学分析——验证实验三部分,本研究严格遵循了这些技术要求。基因表达测试采用了比较成熟的Agilent大鼠全基因组表达谱芯片,然后借助KEGG pathway数据库对芯片数据进行了初步的生物信息学的分析,最后用Real-time PCR技术进行了感兴趣基因的验证。
本研究结果提示,MI后心脏基因表达发生了复杂的变化,出现了上千条基因的上调和下调,初步归类这些差异基因发现涉及的pathway主要包括:糖、脂、氨基酸、能量等众多代谢过程,并且基因转录、蛋白水解、修饰、膜转运、信号转导等遗传信息和环境信息的处理也都表现出一定差异。此外,在细胞的运动、生长、死亡和细胞间通讯等细胞过程的pathway同样出现了基因异常表达。其中与MI后心律失常发生关系比较密切的是细胞通信pathway。细胞通信是细胞间精确和高效的发送与接收信息的通讯机制。细胞通信pathway包括多种方式,就心室肌组织而言,缝隙连接pathway是其重要分支,由Cx43构成的心肌缝隙连接对心电活动影响巨大,它是维持心脏电活动协调性和同步性的重要结构基础之一[7]。Cx43的异常将导致心室肌细胞电活动的整体性异常,从而使传导的速度和传导的各向异性发生改变,引起折返和传导阻滞[8,9],最终诱发恶性心律失常而危及患者生命。在缝隙连接pathway中Cx43受多种因素调节,本研究的基因芯片和荧光定量PCR验证结果均表明,MI后Cx43的上游调节因子中CK1和PKC mRNA的异常表达明显,可能共同导致了Cx43mRNA表达的下调。相关分析证实了这一推测,CK 1对Cx 4 3的基因表达有正调节作用(r=0.765,P<0.01),PKC对Cx43的基因表达有负面影响(r=-0.645,P<0.05)。CK1与Cx43的正相关关系可能与CK1促进缝隙连接通道的装配有关[10]。而PKC则是通过调节Cx43的磷酸化而下调了Cx43介导的心肌细胞间通讯[11]。上述研究结果,对于从基因水平阐明MI的病理变化具有积极意义,特别是心肌细胞间缝隙连接通路的Cx43及其上游CK1和PKC mRNA的变化规律,将为深化对MI后心律失常的发病机制的认识和从基因水平防治心律失常发生提供实验依据。
[1]McManus DD,Piacentine SM,Lessard D,et al.Thirty-year(1975 to 2005)trends in the incidence rates,clinical features,treatment practices,and short-term outcomes of patients <55years of age hospitalized with an initial acute myocardial infarction[J].Am J Cardiol,2011,108(4):477-482.
[2]苏懿,王磊,张敏州.急性心肌梗死的流行病学研究进展[J].中西医结合心脑血管病杂志,2012,10(4):467-469.
[3]Falsini G,Liistro F,Ducci K,et al.Shifting from pharmacological to systematic mechanical reperfusion therapy for acute myocardial infarction via a cooperating network:Impact on reperfusion rate and in-hospital mortality[J].J Cardiovasc Med (Hagerstown),2008,9(3):245-250.
[4]Henkel DM,Witt BJ,Gersh BJ,et al.Ventricular arrhythmias after acute myocardial infarction:A 20-year community study[J].Am Heart J,2006,151(4):806-812.
[5]吴爱明,张冬梅,娄利霞,等.生脉注射液联合血塞通注射液对心肌梗死大鼠室颤阈值和心肌连接蛋白43表达的影响[J].中西医结合学报,2011,9(7):775-782.
[6]郭新红,姜孝成,潘晓玲,等.基因芯片技术与基因表达谱研究[J].生物学杂志,2001,18(5):1-2.
[7]Mayama T,Matsumura K,Lin H,et al.Remodelling of cardiac gap junction connexin 43and arrhythmogenesis[J].Exp Clin Cardiol,2007,12(2):67-76.
[8]Patel PM,Plotnikov A,Kanagaratnam P,et al.Altering ventricular activation remodels gap junction distribution in canine heart[J].J Cardiovasc Electrophysiol,2001,12(5):570-577.
[9]Beardslee MA,Lerner DL,Tadros PN,et al.Dephosphorylation and intracellular redistribution of ventricular connexin 43during electrical uncoupling induced by ischemia[J].Circ Res,2000,87(8):656-662.
[10]Cooper CD,Lampe PD.Casein kinase 1regulates connexin-43gap junction assembly[J].J Biol Chem,2002,277(47):44962-44968.
[11]Lampe PD,TenBroek EM,Burt JM,et al.Phosphorylation of connexin 43on serine 368by protein kinase C regulates gap junctional communication[J].J Cell Biol,2000,149(7):1503-1512.

