玻璃酸钠滴眼液抑菌效力的评价
江志杰,高春(北京市药品检验所,北京 100035)
眼用制剂是直接用于眼部发挥治疗作用的制剂,而市场上销售的眼用制剂多为多剂量包装,需要加入抑菌剂以保证产品的正常贮藏和使用,避免微生物生长与繁殖[1]。玻璃酸钠滴眼液可以润滑眼表面,改善其刺激症状,如干涩感和异物感,具有润滑和保湿作用[2],主要用于干燥综合征、斯-约二氏综合征和干眼综合征等内因性疾患,或是手术后、药物性、外伤、佩戴隐形眼镜等外因性疾患。在治疗的过程中,玻璃酸钠滴眼液需要反复打开使用,这就需要建立良好的防腐体系,以保证产品的微生物安全性,否则,环境中的微生物一旦大量侵入,有可能破坏产品的品质或是对人体造成直接的感染,损害消费者的健康。本实验按照中国药典2010年版二部附录[3]中的抑菌剂效力检查法指导原则对 3个厂家的玻璃酸钠滴眼液的抑菌效力进行了评价,验证了产品中抑菌剂的效果。
1 仪器与材料
1.1 仪器
HF safe-1200A2生物安全柜(力康生物医疗科技控股有限公司);SPX-205B-E生化培养箱(上海博讯实业有限公司医疗设备厂);XG1高压蒸汽灭菌器(山东新华医疗器械股份有限公司);JJ5000电子天平(常熟市双杰测试仪器厂)。
1.2 菌种
金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)63501]、大肠埃希菌[CMCC(B)44102]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]均购自中国食品药品检定研究院,菌株传代数均为第3代。
1.3 样品
样品信息见表1。

表1 样品的信息Tab 1 The information of samples
1.4 培养基
胰酪胨大豆肉汤培养基(TSB)、胰酪胨大豆琼脂培养基(TSA)、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基和pH 7.0 氯化钠-蛋白胨缓冲液,均购自北京陆桥技术有限责任公司,均按照中国药典2010年版二部附录要求配制,培养基适用性检查实验结果符合药典要求。
2 方法
2.1 菌液的制备
接种金黄色葡萄球菌、大肠埃希菌和铜绿假单胞菌的新鲜培养物至10 mL胰酪胨大豆肉汤培养基中,33 ℃培养24 h;接种白色念珠菌的新鲜培养物至10 mL沙氏葡萄糖液体培养基中,25 ℃培养24 h。上述培养物用0.9%无菌氯化钠溶液制成每1 mL含菌数为50~100 cfu的菌悬液用于方法学验证。上述培养物,用离心法收集菌体,并用0.9%无菌氯化钠溶液冲洗和制备菌液,采用比浊法制成每1 mL含菌数约为107cfu的菌悬液用于抑菌效力试验。
接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基中,25 ℃培养7 d,加入3 mL含0.05%聚山梨酯 80的 0.9%无菌氯化钠溶液,将孢子洗脱。过滤菌丝吸出孢子悬液至无菌试管内,用含0.05%聚山梨酯80的0.9%无菌氯化钠溶液制成每1 mL含孢子数50~100 cfu的孢子悬液用于方法学验证。加入适量的含0.05%聚山梨酯80的0.9%无菌氯化钠溶液,采用比浊法制成每1 mL含孢子数107cfu的孢子悬液用于抑菌效力试验。
2.2 供试液的制备
取本品30 mL,混匀,即为供试液。
2.3 菌落计数方法验证
2.3.1 菌液组 分别取菌液1 mL,采用平皿计数法,测定上述制备好的菌液中每毫升的活菌数,结果为A。
2.3.2 样品对照组 取供试液1 mL,等量分注于5个平皿中, 每皿0.2 mL,测定供试品本底的细菌数;取供试液1 mL,注入平皿中,测定供试品本底的霉菌和酵母菌数,结果为B。
2.3.3 试验组 取供试液0.2 mL和上述细菌菌液1 mL(50~100 cfu试验菌),分别注入同一平皿中,测定细菌数;取供试液1 mL和上述真菌菌液1 mL(50~100 cfu 试验菌),分别注入同一平皿中,测定霉菌和酵母菌数,结果为C。
2.3.4 回收率的计算 回收率(%)=(菌落数 C-菌落数B)/菌数A×100%。
2.4 抑菌效力试验
2.4.1 样品组 取 5个无菌玻璃试管,分别加入供试液30 mL,然后分别加入金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、黑曲霉和白色念珠菌,使其最终细菌浓度为106cfu·mL-1,酵母菌和霉菌为105cfu·mL-1,接种菌液的体积为供试品体积的1%,即0.1 mL,充分混合,使供试品中的试验菌均匀分布,在试验期间置23 ℃,避光贮存。
2.4.2 菌液组 取 5个无菌玻璃试管,分别加入0.9%氯化钠溶液 30 mL,然后分别加入金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、黑曲霉和白色念珠菌,使其最终细菌浓度为106cfu·mL-1,酵母菌和霉菌为105cfu·mL-1,接种菌液的体积为供试品体积的1%,即0.1 mL,充分混合,使供试品中的试验菌均匀分布,用pH 7.0无菌氯化钠-蛋白胨缓冲液稀释成1∶10、1∶100、1∶1 000等稀释级,分别吸取适宜的稀释级1 mL,注入平皿中,倾注琼脂培养基,待凝固后,置相应温度培养,观察结果,根据测定结果,计算出1 mL供试品各试验菌所加的菌数。
2.4.3 存活菌数测定 在刚接种(0时)和 7,14,28 d分别从上述试管中取样品1 mL,用pH 7.0无菌氯化钠-蛋白胨缓冲液稀释成 1∶10、1∶100、1∶1 000等稀释级。样品组按上述验证的检验方法进行细菌、霉菌和酵母菌计数。根据测定结果,计算各间隔时间的菌数,并换算成l g值。
3 结果
3.1 细菌、霉菌和酵母菌计数方法验证结果
按照中国药典2010年版二部附录要求,采用常规法进行预检验,结果显示样品A、B和C,除黑曲霉和白色念珠菌外,其他验证菌株的回收率均<70%,说明样品A、B和C本身对真菌没有抑菌作用或其抑菌作用可以忽略不计,而对细菌有一定得抑菌作用,因此采用培养基稀释法(每皿0.2 mL)进行细菌计数验证,结果见表2。
从表2可以看出,采用培养基稀释法,3次独立实验的结果显示,样品A、B和C的金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌的回收率均>70%,黑曲霉和白色念珠菌采用常规法,回收率均>70%,因此细菌、霉菌和酵母菌的计数方法确定为(样品A、B和C的菌落计数方法一样):取本品30 mL,混匀,即为供试液;细菌计数,取供试液1 mL,等量分注于5个平皿中,每皿0.2 mL,倾注胰酪胨大豆琼脂培养基(TSA),待凝固后,置33 ℃培养3 d逐日观察结果;霉菌和酵母菌计数,取供试液1 mL,注入平皿中,倾注沙氏葡萄糖琼脂培养基,待凝固后,置25 ℃培养5 d逐日观察结果。
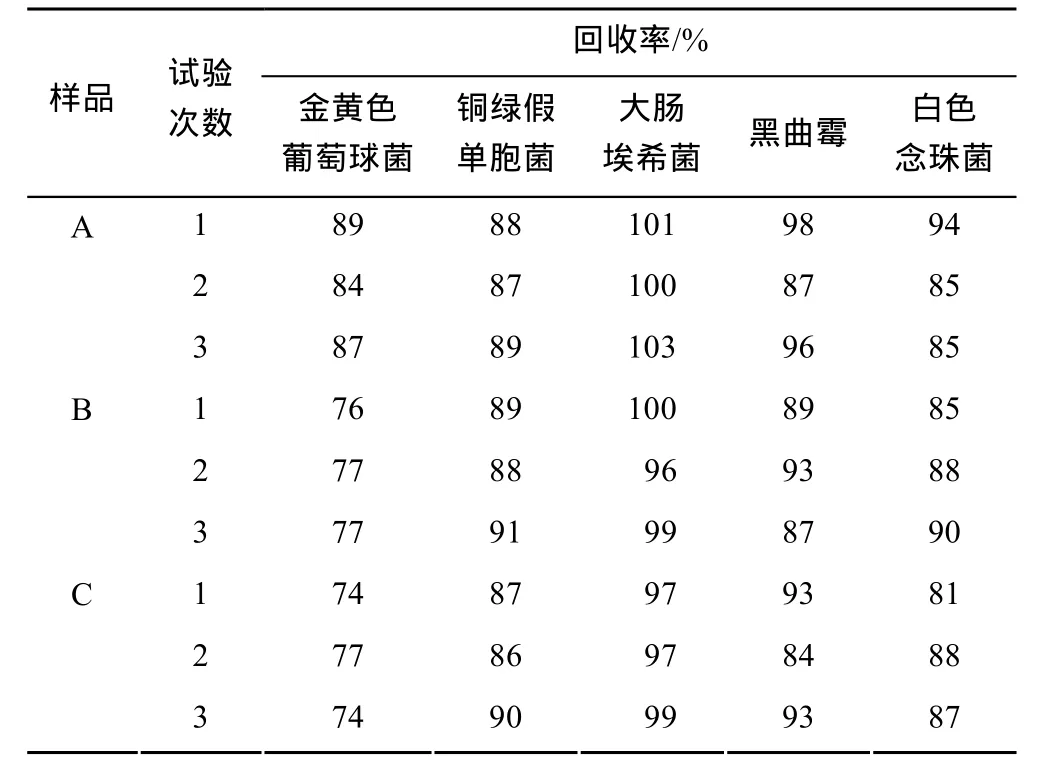
表2 试验组回收率测定结果Tab 2 The recovery results of experiment group
3.2 抑菌效力试验结果
本品为眼用制剂,根据中国药典2010版附录中的抑菌剂效力检查法指导原则要求应属一类产品。3种供试品,接种细菌后,菌的浓度均>106cfu·mL-1,黑曲霉和白色念珠菌接种后浓度均>105cfu·mL-1,而且接种菌液的体积为供试品体积的1%,满足一类产品的要求。结果见表3。
由表3可知,3种玻璃酸钠滴眼液的抑菌作用还是比较明显,尤其是对金黄色葡萄球菌,14 d和28 d后5种试验菌株的菌数均<10 cfu;3种样品的杀菌作用非常强,与菌液组相比,0时,A、B、C样品的金黄色葡萄球菌的菌数lg值分别下降下降0.5,0.3和5;铜绿假单胞菌的菌数lg值分别下降1.5,3.8和2.8;大肠埃希菌的菌数lg值分别下降0.6,2和0.4;黑曲霉的菌数lg值分别下降0,0.3和0;白色念珠菌的菌数lg值分别下降0.1,0.1和 0。与初始值(刚加入菌液时菌数的 lg值)相比,7,14,28 d后的各菌lg下降值见表4。
中国药典2010年版附录中的抑菌剂效力检查法指导原则中指出一类产品抑菌剂抑菌效力判断标准为:细菌,与初始值比,7 d菌数lg值下降≥1.0,14 d菌数lg值下降≥3.0,14 d到28 d菌数不增加;真菌,与初始值比,7,14,28 d菌数均不增加。
由表4结果来看,3个样品的细菌数,与初始值比,除了样品B的铜绿假单胞菌和样品C的金黄色葡萄球菌(样品B的铜绿假单胞菌的初始值只有2.5,而样品C的金黄色葡萄球菌的初始值为0)外,7 d菌数lg值均下降>1.0,14 d菌数lg值下降均>3.0;由于样品B的铜绿假单胞菌lg值的初始为2.5,7,14及28 d的lg值均为0,该结果说明样品 B中的抑菌效力较强,所加入的铜绿假单胞菌在与样品一接触时就被杀死了很多,在接触7 d后所有菌全部被杀灭,其对该菌的抑菌效力是符合要求的。同理样品 C对金黄色葡萄球菌抑菌效力也是符合要求的。3个样品的霉菌数,与初始值比,7,14,28 d菌数均未增加,由此可以看出3个厂家产品的抑菌效力均满足药典要求。
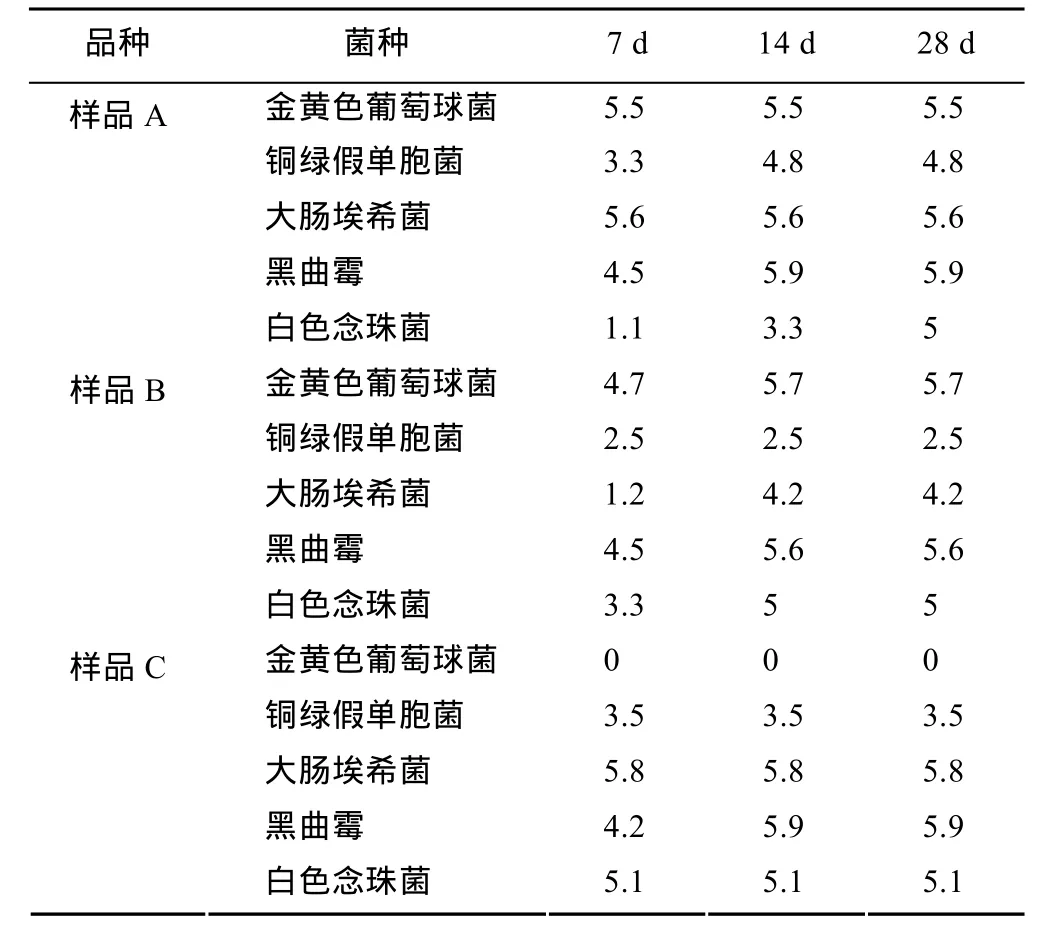
表4 与初始值(0时菌数lg值)相比下降的lg值Tab 4 The decline bacterial counts lg value compared with the initial value
4 讨论
防腐效能试验无论是对消费者还是生产企业都至关重要,防腐剂的量添加过少,会使微生物繁殖而引起污染,防腐剂的量过大,会引起许多不适作用或过敏等病态反应,因此,适量添加防腐剂就显得尤为重要[4],添加最少的抑菌剂,而又能保证其样品的抑菌效力是最科学的。中国药典2005年版及以前,国内对眼用制剂抑菌剂含量测定没有具体要求,也没有要求评价抑菌效果[1],但USP[5]和 CTFA[6]均收载具体的方法,中国药典2010年版也收载了抑菌剂效力检查法的指导原则。
本试验考察了 3个厂家的玻璃酸钠滴眼液的抑菌效力,结果显示均符合药典的要求,它们的抑菌试验结果显示,有些0时或7 d的菌数下降至<1 cfu·mL-1,会不会存在抑菌剂浓度过高的问题有待于进一步研究。在试验过程中发现,测定供试品刚接种(0时)菌数有点难把握,因为要是测定的时间过长,加入的试验菌株有可能被抑菌剂杀灭,而药典没有具体规定多长时间内测定完,而且药典规定初始值为 0时供试品刚接种,而标准又要求细菌7,14 d下降一定的lg值,如果刚接种就被完全杀灭,数字上就没法满足标准,建议将判断标准加以说明,如果将加入样品内的菌数作为初始值(0时),又不能反映供试品初始状态下的抑菌效力,失去了判断抑菌剂浓度是否过高的意义。
[1]ZHANG S L, BAI R W, LI J, et al. Determination of preservative effect on naphazoline hydrochloride and chlorphenamine maleate and vitamin B12 eye drops [J]. Food Drug(食品与药品), 2011, 13(1): 42-44.
[2]CHEN Y Z, ZHAO X Q, ZHANG M L, et al. Effect of hyaluronate eye drops combined with houttuynia cordata eye drops on the treatment of dry eye [J]. Int J Ophthal(国际眼科杂志), 2011, 11(4): 704-705.
[3]Ch.P(2010)Vol Ⅱ(中国药典 2010年版. 二部)[S]. 2010:Appendix XIX N.
[4]NIU Z D, JIANG Z J, ZHANG G H, et al. Evaluation of the effect of preservatives in cosmetic with microbial challenge test [J]. Detergent & Cosmetics(日用化学品科学), 2012,35(3): 36-38.
[5]SUTTON S V, PORTER D. Development of the antimicrobial effectiveness test as USP chapter(51)[J]. PDA J Pharm Sci Technol, 2002, 56(6): 300- 311.
[6]CIVETTA J M. CTFAs preservation guidelines: a histories perspective and review [J]. Cosmetics and Toiletries, 1993,108: 53-59.

