新一代抗菌药物Dalbavancin的研究进展
林忠,孙渊,杨建苗,林建群(浙江省恩泽医疗中心台州医院药剂科,台州318000)
抗菌药物的出现对人类来说既是福又是祸,因为抗菌药物在临床细菌感染治疗中发挥重大作用的同时不可避免的加速了耐药菌株的出现。近60年来,由于抗菌药物滥用,耐药菌株不断出现。早在1946年,医师在使用青霉素治疗感染患者后不久,便证实青霉素在发挥杀菌作用的同时促使了耐药菌株的产生。于是,药物科学家们便开始了与细菌之间的博弈之争。随着时间的推移,各种先进的抗菌药物不断进入临床,同时各种更加强大的超级耐药细菌也频见报道。
不可否认,21世纪多重耐药性革兰阳性菌(G+)的出现已严重威胁人类生命的健康。其中Methicillin-resistant Staphylococcus aureus (MRSA)是多重耐药细菌的典型代表。从1961年首次发现MRSA以来,随着抗菌药物临床使用的更加广泛,MRSA相继出现了对多种抗菌药物的耐药性[1]。万古霉素是公认的治疗 MRSA的一线药物,但自1996年Vancomycin Intermediate Staphylococcus aureus和2002年Vancomycin-resistant Staphylococcus aureus的出现,具有抗菌药物最后一道防线之称的万古霉素也不得不俯首称臣[2]。
在这样一种耐药性细菌急剧增加的时代背景下,研究出新型的抗多重耐药性细菌的药物已迫在眉睫。Dalbavancin是一种替考拉宁类似糖肽(A-40926)半合成衍生物,很多研究数据表明,其抗菌谱与其它糖肽类抗菌药物相类似,但由于其具有比万古霉素和替考拉宁更强的抗菌活性以及更长的药物代谢半衰期,已受到全世界药物科学家的关注。其体外抗 MRSA活性 MIC50仅 0.06 mg·L-1,与万古霉素(1 mg·L-1)、替考拉宁(0.5 mg·L-1)相比大大降低。再加上其体内半衰期达到149~250 h,说明其具有每周给药达到治疗目的的潜力,并且有可能会成为人类历史上第一个以周来计算给药频率的抗菌药物。因此,从它出现伊始,便受到了全世界的高度关注。目前该药已处于Ⅲ期临床研究,有望成为新一代明星糖肽类抗菌药物[3]。
1 结构及作用机制
Dalbavancin是一种替考拉宁类似糖肽(A-40926)半合成衍生物,结构见图 1。其半合成过程是在 A-40926七肽骨架的 C-末端加上一个N,N-二甲基丙胺,同时在糖基上连接长脂肪酸链[4]。其作用机制与万古霉素、替考拉宁等糖肽类抗菌药物相似[5]。首先非特异性地与细胞壁的外层结构相结合,然后与细胞壁肽聚糖合成的前体UDP-N-乙酰胞壁酸所接五肽上的 D-丙氨酰-D-丙氨酸特异性结合,抑制细胞壁的合成[6]。由于其连接二甲基丙胺,增强了活性中心与靶点的结合作用。同时由于其可引起细胞内 UDP-N-乙酰胞壁酰五肽的积累,对细菌的生长同样具有抑制作用。另外,由于糖基上连有长脂肪酸链,与细胞膜及脂溶性物质具有更强的亲和力,因此在治疗过程中与细菌的亲和力更强,抑菌效果更明显,在人体内更易进入血液等组织内,延长其体内代谢时程。
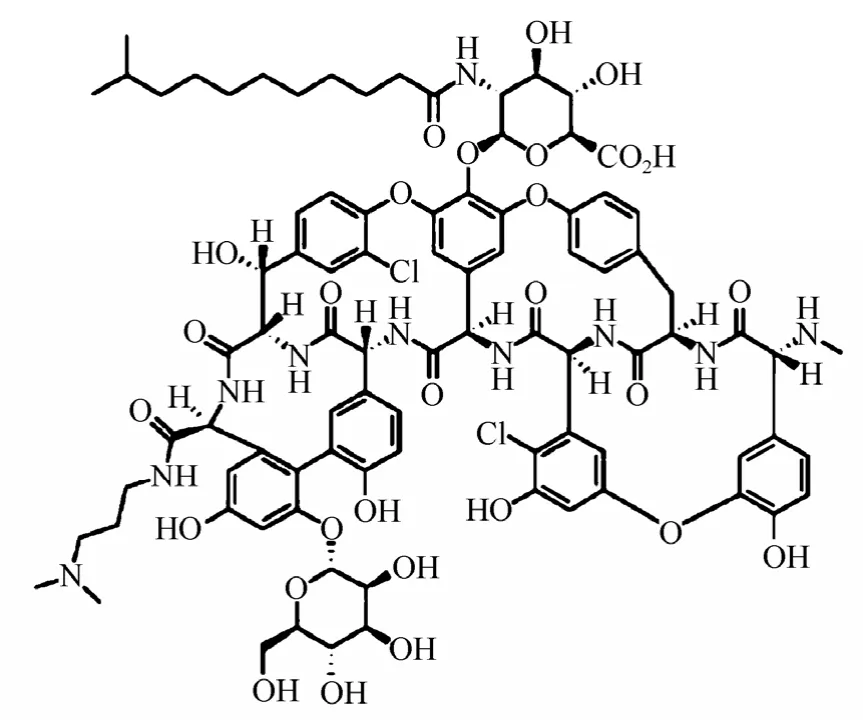
图1 Dalbavancin结构图[4]Fig 1 Chemical structure of Dalbavancin
2 抗菌活性
2.1 Dalbavancin对G+的体外抗菌活性
2007年,Biedenbach等[7]利用来自于美国52个不同医疗中心分离得hemolytic streptococcus测定了Dalbavancin的抗菌活性,证明了Dalbavancin对美国多个医疗中心的致重度皮肤组织感染(SSSI)病菌具有出色的抗菌活性,达到了100%的敏感性。
2009年,Biedenbach等[8]利用 33个国家耐药监测中心收集到的81 673株staphylococcus、enterococcus以及streptococcus测定了Dalbavancin的抗菌活性,结果显示,Dalbavancin对staphylococcus aureus和coagulase negative staphylococcus(CoNS)的 MIC90为 0.06~0.12 mg·L-1,对 β-hemolytic streptococcus和 viridans streptococcus的 MIC90<0.03 mg·L-1,而万古霉素的 MIC90则为 1~2 mg·L-1,说明 Dalbavancin对 G+的抗菌活性是万古霉素的16倍。Dalbavancin对G+的体外抗菌活性见表1。
2.2 Dalbavancin对需氧G+和厌氧G+的体外抗菌活性
Goldstein等[9]利用209种需氧G+和120种厌氧 G+测定了不同抗菌药物之间抗菌活性,发现Dalbavancin对 MRSA、Clostridium perfringens、Peptoniphilus asaccharolyticus、Finegoldia magna、Anaerococcus prevotii的 MIC90≤0.125 mg·L-1,而万古霉素、利奈唑胺、达托霉素、克林霉素对MRSA分的 MIC90别为 0.5,4,0.5,0.25 mg·L-1,对Clostridium perfringens、Peptoniphilus asaccharolyticus、Finegoldia magna、Anaerococcus prevotii的MIC90分别为 1,4,0.5,8 mg·L-1。说明无论是厌氧性还是需氧性G+,Dalbavancin对其抗菌活性都比目前临床使用的一线抗菌药物体外抗菌活性强。
2.3 Dalbavancin对耐药性G+的体外抗菌活性
Dalbavancin的抗菌活性比万古霉素和替考拉宁强。Streit等[10]用 1 000多株临床分离得到的MRSA测定了Dalbavancin的体外抗菌活性,结果显示 Dalbavancin 的 MIC50是 0.06 mg·L-1,而万古霉素和替考拉宁的 MIC50分别为 1,0.5 mg·L-1。Flamm等[11]研究发现,Dalbavancin对耐甲氧苯青霉素 CoNS 的 MIC90是 0.06 mg·L-1,而万古霉素和替考拉宁的 MIC90分别为 2,4 mg·L-1。2011 年,Karlowsky等[12]利用加拿大医院收集的葡萄球菌和链球菌测定了Dalbavancin的抗菌活性,结果表明Dalbavancin对耐青霉素肺炎链球菌和耐青霉素化脓性链球菌的抗菌活性≤0.06 mg·L-1。葡萄球菌染色体SCCmec基因型是区分社会性金黄色酿脓葡萄球菌(CA-MRSA)和院内耐甲氧苯青霉素金黄色酿脓葡萄球菌(HA-MRSA)的分子学元素之一。SCCmecⅣ主要存在于CA-MRSA中,SCCmec基因型Ⅱ和Ⅲ主要存在于 HA-MRSA[13]。2010年,Huang等[14]研究了 Dalbavancin对临床分离到的CA-MRSA和MDR HA-MRSA的抗菌活性,结果表明对CA-MRSA抗菌活性来说,Dalbavancin=万古霉素>替加环素>米诺环素=替考拉宁>四环素(P<0.006),对于MDR HA-MRSA抗菌活性来说,Dalbavancin=万古霉素=替考拉宁>替加环素=米诺环素>四环素(P>0.05)。另外,CA-MRSA的感染总是与杀白细胞素(PVL)相关联的,这可能与皮肤坏死、软组织感染以及肺炎等疾病相关[15]。说明无论是CA-MRSA还是HA-MRSA,Dalbavancin都具有很强的抗菌活性。
2.4 Dalbavancin对炭疽杆菌体内外抗菌活性
炭疽是一种由炭疽杆菌引起的可致命的感染性疾病。2010年,Heine等[16]的研究报告指出,Dalbavancin的体外抗炭疽杆菌的MIC为0.03~0.5 mg·L-1,对应的 MIC50和 MIC90分别为 0.06,0.25 mg·L-1。并且在吸入法老鼠炭疽模型实验中发现,以20 mg·kg-1的给药剂量给药,在给药后6 d内都可以检测到Dalbavancin的抗菌活性。优化给药方式后,以每隔36 h给药15~120 mg·kg-1或者以每隔 72 h 给药 30~240 mg·kg-1,42 d 后,吸入炭疽老鼠的存活率达到了80%~100%。说明Dalbavancin在炭疽疾病治疗中疗效显著。
3 Dalbavancin的药动学研究
抗菌药物药动学研究不仅是评价动物感染模型药物治疗效果的重要方法,也是抗菌药物能否进入临床的先决研究方法;不仅能够为临床实验提供合适的给药方案,也能够预测药物在人体内的血药浓度、代谢途径及药物的毒理反应。Cavaleri等[17]研究了 Dalbavancin在老鼠体内的药动学特点,结果表明血浆t1/2很长,接近187 h,代谢途径有2条,2/3 Dalbavancin以尿液的形式排出体外,1/3 Dalbavancin以粪便的形式排出体外。给药70 d之后,分别有44.2% 和22.3%的药物衍生物在尿液和粪便中被检测到,在处死的动物体内残留的药物衍生物不到给药剂量的5%,说明药物在体内完全消除。
Dorr 等[18]通过动物感染模型研究,认为Dalbavancin在动物体内的抗菌活性血药浓度≥5 mg·L-1,通过健康人体临床药物研究,表明血清抗菌活性血药浓度约20 mg·L-1,在此基础上,研究了利用Dalbavancin治疗SSSI患者临床抗菌活性,结果表明以双剂量给药方式(1 000 mg Dalbavancin iv d 1, 500 mg Dalbavancin iv d 8)临床治疗效果远远超过单剂量给药方式(1 000 mg Dalbavancin iv d 1)和阳性对照组的治疗效果,并且在这种情况下人体的耐受性良好,临床治疗效果也更好。以临床实验证据说明了 Dalbavancin 在治疗 G+感染时具有每周给药1次的潜力。
2007年,Nicolau等[19]研究了Dalbavancin在人体血浆和皮肤水泡中的药动学特征,结果显示,Dalbavancin在人体血浆和皮肤水泡中的药物平均浓度分别为 285,67.3 mg·L-1,相对应的 AUCDay7分别为 10 806,6 438 mg·h·L-1,进入皮肤水泡中的药物占59.6%。
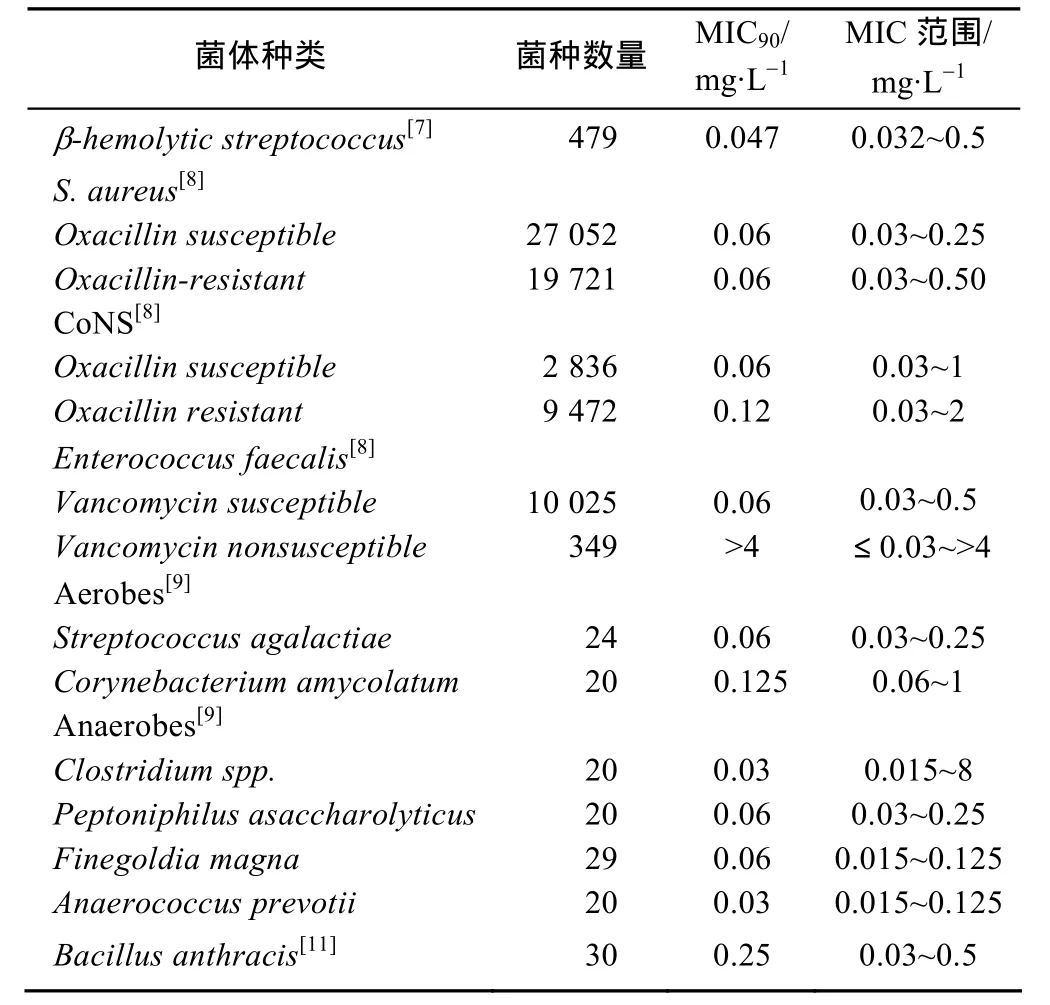
表1 Dalbavancin对G+的体外抗菌活性Tab 1 In vitro antibacterial activity by Dalbavancin
这些数据反映出了在 7 d的治疗期内皮肤水泡中的药物浓度始终处于药物的 MIC90以上,以药动学的研究形式说明了 Dalbavancin对治疗 G+感染的SSSI患者的有效性以及长效性。
4 药效学特征
评价抗菌药物的临床疗效,通常采用体外获得的静态数据如MIC和MBC为指标,但这些参数仅仅说明抗菌活性的高低,不能反映其抗菌的时间长短,近年来将药物浓度、作用时间和抗菌活性进行整合,提出了PK/PD相关参数,从药效学角度预测抗菌药物疗效和指导临床合理用药。根据抗菌药物体内杀菌动力学过程不同,将抗菌药物分为2类,即浓度依赖性抗菌药物和时间依赖性抗菌药物。预测2类抗菌药物的PK/PD参数各不相同。浓度依赖型PK/PD参数主要以AUC24h/MICs和Cmax/MICs进行评估,而时间依赖型主要以T >MICs进行评估。Bowker等[20]利用Staphylococcus aureus体外模拟Dalbavancin代谢半衰期,分别在24,120,240 h测定了AUC24h/MIC分别为214,195,331,AUC24h/MIC与抗菌效应呈线性相关,以体外模拟药物代谢变化的角度研究药物的药效学,为体内研究药效学提供可靠的实验数据。
Andes等[21]利用中性白细胞减少症肺感染老鼠模型研究了Dalbavancin的体内药效学,结果表明药物与老鼠血浆的结合率达到了98.4%,当单次给药剂量2.5 mg·kg-1或者更高剂量时,药物对S.pneumoniae的抑制作用呈剂量相关。当单次给药20 mg·kg-1或者更高剂量时,药物对 S. aureus的抑制作用呈剂量关系。多次给药策略研究得到的Dalbavancin对于5株S. pneumoniae和5株S. aureus药效学参数 Cmax/MICs、AUC24h/MICs的值与疗效通过非线性统计学分析,结果表明 2者之间存在线性相关(R2分别为78%和77%)。其中 5株 S. pneumoniae的 AUC24h/MICs为 17±7,5株 S. aureus AUC24h/MICs为 265±143。说明Dalbavancin属于浓度依赖型抗菌药物。
5 Dalbavancin的临床应用和安全性
5.1 Dalbavancin的临床应用有效性及安全性评估
血管介入仪器是常用医疗设备,使用血管介入仪器有可能会导致患者导管相关性血液感染(CR-BSIs),而CR-BSIs经常会导致患者在治疗过程中死亡。Raad等[22]利用 Dalbavancin治疗CR-BSIs患者,对Dalbavancin的临床应用有效性及安全性进行了评估。结果表明Dalbavancin治疗CR-BSIs患者的治愈率为87%,而万古霉素的治愈率为50%,经统计学分析,Dalbavancin治疗效果优于万古霉素。在Dalbavancin的所有治疗组中患者的耐受性较好,71%的患者认为有不良反应,其中不良反应率>1%的症状在治疗过程中比较温和,主要的不良反应是口腔念珠菌病、腹泻、便秘、发热,而万古霉素治疗组中患者的不良反应主要是口腔念珠菌病、便稀、皮肤霉菌感染,阴道真菌感染、急性肾功能衰竭。其中万古霉素治疗组中 3例患者由于不良反应过大导致治疗中断。说明Dalbavancin治疗CR-BSIs,不仅治愈率高,而且不良反应小。
Marco等[23]在2009年美国专利中报道了关于62例G+感染患者为期15 d的治疗,结果发现在治疗过程中2次给药组(two-dose Dalbavancin 1 000/500 mg)的有效性(94.1%)明显高于单次给药组(single-dose Dalbavancin 1 100 mg)和标准 G+治疗组(分别为61.5%和76.2%)。Dalbavancin的不同给药方式对其药动学参数也产生较大的影响,2次给药组中分别在8 d,20 d,34 d测定Dalbavancin的体内浓度为(30.4±8.2),(21.2±10.0)和(9.0±4.4)mg·L-1,而单次给药组中分别在 8 d,10 d 和24 d测定Dalbavancin的体内浓度为(31.1±7.1),(25.2±4.8)和(10.2±3.5)mg·L-1。说明 2 次给药方式能够在总给药剂量增加400 mg的情况下明显延长Dalbavancin在体内>20 mg·L-1的抑菌时间,从而使相同剂量的Dalbavancin在体内发挥药效时间明显延长。同时,Dalbavancin在2次给药组中所表现的不良反应(76.2%)也明显低于单次给药组以及标准治疗组(分别为95%和100%)。
5.2 Dalbavancin对肠道正常菌群的影响
Dalbavancin主要以尿液和粪便的形式排出体外。人体的正常微生物菌群比较稳定。一般情况下,正常微生物菌群是致病菌的天然屏障。正常微生物菌群的平衡破坏通常是由饮食、辐射或者抗菌药物所引起的。Dalbavancin是一种强效抗G+的抗菌药物,在治疗过程中如果使用不当或者滥用都有可能导致人体的正常微生物菌群平衡的破坏。Nord等[24]研究了 Dalbavancin对人体肠内正常菌群的影响,结果表明Dalbavancin对肠球菌和大肠杆菌的数量有所影响,对乳酸杆菌、梭菌属和类杆菌属的数量没有影响,没有检测到difficult Clostridium,没有Dalbavancin抗性的需氧或厌氧菌被检测到。因此,Dalbavancin对于人体的正常菌群没有明显的影响。
5.3 Dalbavancin的临床监测
在Ⅲ期临床药物等效性研究中表明,在以Dalbavancin 1周给药2次(1 000 mg day 1和500 mg day 8)对照利奈唑胺每天给药 2次[500 mg·(12 h)-1]的疗效比较中,2者都具有很高的治愈率(分别为88.9%和91.2%)。在每组患者中所表现的药动学参数也很相似,发生不良反应比率利奈唑胺高于Dalbavancin(分别为32.2%和25.4%)[25]。
2008年Seltzer等[26]在临床2/3比例项目研究中给出了这样一份报告,研究对象共 1 699例患者,其中1 126例患者给予Dalbavancin治疗,对照药物包括头孢唑林、万古霉素和利奈唑胺。在所有的治疗组中药动学参数基本相似;在血清标本肝功能和肾功能检测中与对照组相比出现反常的数据比率很低;心脏QT时程并没有影响;因此,Dalbavancin对于肝脏、肾脏和心脏没有毒性,且对老年人和糖尿病患者也是安全的。
2010年,美国阿斯特拉制药公司的临床监测证实了Dalbavancin具有稳定的抗菌疗效,是一种潜在的已被实验证明具有治疗金黄色葡萄球菌特别是耐甲氧西林金黄色葡萄球菌引起的 cSSSI和CR-BSIs有确切疗效的抗菌药物。因此,Dalbavancin是一种高治疗效果、低治疗成本、低不良反应的新型抗菌药物[27]。
6 结论
人类与病原体之间的斗争始终持续着。抗药病原菌的不断增长将在未来很长一段时间内始终成为威胁人类健康的热点问题。因此,合理使用抗菌药物,加强抗菌药物的临床管理,加大研究更安全更有效更适合人体药物代谢规律的新抗菌药物品种已迫在眉睫。Dalbavancin是一种新糖肽类广谱抗 G+药物,特别值得关注的是其对于耐MRSA的抗菌活性。在动物模型和临床实验中已经验证了Dalbavancin治疗SSTIs的有效性和长效性。其独特的药动学特点能够为出院治疗的患者带来很大帮助。虽然美国已经研究出好几种具有抑制抗多重药物病原菌的抗菌药物(达托霉素、利奈唑胺、奎奴普丁、替加环素)[28],但是从药物的安全性、有效性以及经济性角度来看,由于Dalbavancin独特的药动学特性,能够极大地缩短患者的住院时间,避免频繁而长期的静脉注射带来的院内感染风险,从而给患者节省了医疗、护理费用,也为患者提供了更安全、更方便的治疗方式。
[1]MORAN G J, KRISHNADSAN A, GORWITZ R J, et al.Methicillin-resistant S.aureus infections among patients in the emergency department [J]. N Engl J Med, 2006, 355(7):666-674.
[2]PILLAI S K, GOLD H S, SAKOULAS G, et al. Daptomycin nonsusceptibility in Staphylococcus aureus with reduced vancomycin susceptibility is independent of alterations in MprF [J]. Antimicrob Agents Chemother, 2007, 51(6): 2223-2225.
[3]DAROUICHE R O, MANSOURI M D. Dalbavancin compared with vancomycin for prevention of Staphylococcus aureus colonization of devices in vivo [J]. J Infect, 2005, 50(3):206-209.
[4]MALABARBA A, GOLDSTEIN B P. Origin, structure, and activity in vitro and in vivo of Dalbavancin [J]. J Antimicrob Chemother, 2005, 55(Suppl 2): 15-20.
[5]GREEN D W. The bacterial cell wall as a source of antibacterial targets [J]. Expert Opin Ther Targets, 2002, 6(1):1-19.
[6]MALABARBA A, NICAS T I, THOMPSON R C. Structural modifi cations of glycopeptide antibiotics [J]. Med Res Rev,1997, 17(1): 69.
[7]BIEDENBACH D J, ROSS J E, FRITSCHE T R, et al.Activity of Dalbavancin tested against Staphylococcus spp.And β-Hemolytic Streptococcus spp. isolated from 52 geographically diverse medical centers in the united states [J].J Clin Microbiol, 2007, 45(3): 998–1004.
[8]BIEDENBACH D J, BELL J M, SADER H S, et al. Activities of Dalbavancin against a worldwide collection of 81 673 gram-positive bacterial isolates [J]. Antimicrob Agents Chemother, 2009, 53(3): 1260-1263.
[9]GOLDSTEIN E J, CITRON D M, WARREN Y A, et al. In vitro activities of Dalbavancin and 12 other agents against 329 aerobic and anaerobic gram-positive isolates recovered from diabetic foot infections [J]. Antimicrob Agents Chemother,2006, 50(8): 2875-2879.
[10]STREIT J M, SADER H S, FRITSCHE T R, et al.Dalbavancin activity against selected populations of antimicrobial-resistant gram-positive pathogens [J]. Diagn Microbiol Infect, 2005, 53(4): 307-310.
[11]FLAMM R K, DRAGHI D C, KARLOWSKY J A. Activity of Dalbavancin against clinical isolates of staphylococci and streptococci from the U.S. and Europe [J]. American Society for Microbiology, 2004, 15: 173.
[12]KARLOWSKY J A, ADAM H J, POUTANEN S M, et al. In vitro activity of Dalbavancin and telavancin against staphylococci and streptococci isolated from patients in Canadian hospitals: results of the CANWARD 2007–2009 study [J]. Diagn Microbiol Infect Dis, 2011, 69(3): 342-347.
[13]DAVIS S L, RYBAK M J, AMJAD M, et al. Characteristics of patients with healthcare-associated infection due to SCCmec type IV methicillin-resistant Staphylococcus aureus [J]. Infect Control Hosp Epidemiol, 2006, 27(10): 1025.
[14]HUANG V, CHEUNG C M, KAATZ G W, et al. Evaluation of Dalbavancin, tigecycline, minocycline, tetracycline,teicoplanin and vancomycin against community-associated and multidrug-resistant hospital-associated meticillin-resistant Staphylococcus aureus [J]. Int J Antimicrob Agents, 2010,35(3): 25-29.
[15]OLIVEIRA D C, DE LENCASTRE H. Multiplex PCR strategy for rapid identification of structural types and variants of the mec element in methicillin-resistant Staphylococcus aureus [J]. Antimicrob Agents Chemother, 2002, 46(7): 2155-2161.
[16]HEINE H S, PURCELL B K, BASSETT J, et al. Activity of Dalbavancin against bacillus anthracis in vitro and in a mouse inhalation anthrax model [J]. Antimicrob Agents Chemother,2010, 54(3): 991-996.
[17]CAVALERI M, RIVA S, VALAGUSSA A, et al.Pharmacokinetics and excretion of Dalbavancin in the rat [J]. J Antimicrob Chemother, 2005, 55(Suppl 2): 31-35.
[18]DORR M B, JABES D, CAVALERI M, et al. Human pharmacokinetics and rationale for once-weekly dosing of Dalbavancin, a semi-synthetic glycopeptides [J]. J Antimicrob Chemother, 2005, 55(Suppl 2): 25-30.
[19]NICOLAU D P, SUN H K, SELTZER E, et al.Pharmacokinetics of Dalbavancin in plasma and skin blister fluid [J]. J Antimicrob Chemother, 2007, 60 (3): 681-684.
[20]BOWKER K E, NOEL A R, MACGOWAN A P.Pharmacodynamics of Dalbavancin studied in an in vitro pharmacokinetic system [J]. J Antimicrob Chemother, 2006,58(1): 802-805.
[21]ANDES D, CRAIG W A. In vivo pharmacodynamic activity of the glycopeptide Dalbavancin [J]. Antimicrob Agents Chemother, 2007, 51(5): 1633-1642.
[22]RAAD I, DAROUICHE R, VAZQUEZ J, et al. Efficacy and safety of weekly Dalbavancin therapy for catheter-related bloodstream infection caused by gram-positive pathogens[J].Clinical Infectious Diseases, 2005, 40(3): 374-380.
[23]MARCO C. Methods of administering Dalbavancin for treatment of bacterial infections: United States, US 200910298748 A1[P]. 2009-03-18.
[24]NORD C E, RASMANIS G, WAHLUND E. Effect of Dalbavancin on the normal intestinal microflora [J]. J Antimicrob Chemother, 2006, 58(3): 627-631.
[25]JAUREGUI L E, BABAZADEH S, SELTZER E, et al.Randomized, double-blind comparison of once-weekly Dalbavancin versus twice-daily linezolid therapy for the treatment of complicated skin and skin structure infections [J].Clin Infect Dis, 2005, 41(10): 1407-1415.
[26]SELTZER E, GOLDBERG L, KRAUSE D. Dalbavancin safety in the phase 2/3 clinical development program [J].Critical Care, 2008, 12(Suppl 2): 27.
[27]Astellas Pharma Global Development, Inc. VIBATIV package insert. Astellas Pharma Global Development, Inc., Deerfield,IL [J/OL]. US FDA-Approved Product Labeling [2010-1-8].http://www.vibativ.com.
[28]DREW R H. Emerging options for treatment of invasive,multidrugresistant Staphylococcus aureus infections [J].Pharmacotherapy, 2007, 27(2): 227-249.

