替考拉宁产生菌的抗性筛选及发酵条件研究
胡海艳,赵培静,梁淑娃,秦鹏,刘燕珠,夏枫耿
(广州市微生物研究所,广东广州 510663)
替考拉宁产生菌的抗性筛选及发酵条件研究
胡海艳,赵培静,梁淑娃,秦鹏,刘燕珠,夏枫耿*
(广州市微生物研究所,广东广州 510663)
[目的]通过对替考拉宁产生菌的菌种选育及发酵工艺的研究,提高其对自身代谢产物的耐受性,进而提高替考拉宁的产量。[方法]以替考拉宁产品本身为筛选剂,利用紫外诱变,对替考拉宁产生菌进行耐自身抗性的筛选。将筛选得出的高产菌进行发酵研究,在发酵起始将不同型号的大孔树脂加入培养基中以吸附发酵过程中释放的替考拉宁,发酵结束后用浓度80%甲醇洗涤树脂,用微生物管碟法测其洗脱液效价。[结果]通过抗性筛选的方法,获得比亲株发酵水平提高18%的菌株。在发酵液培养基中添加7%(w/V)的吸附树脂Diaion HP-20能有效消除替考拉宁对自身菌体的抑制作用,使得替考拉宁产量提高3.52倍。[结论]通过对替考拉宁的抗性筛选及向发酵液中加入吸附树脂能有效提高菌体对自身的耐受性,为进一步的工业化生产提供理论依据。
替考拉宁;游动放线菌;抗性变株;吸附树脂
替考拉宁(Teicoplanin)又称肽可霉素(Teicomycin A2),是Parenti等于1978年发现的一种新的糖肽类抗生素,由游动放线菌(Actinoplanesteichomyceticus)产生[1]。它是继万古霉素之后的又一目前临床治疗多重耐药菌感染的重要抗生素。大量研究表明,替考拉宁对革兰氏阳性菌尤其对多重耐药(MDR)的金黄色葡萄球菌(MRSA)和肠球菌具有强大的抗菌活性[2-3]。万古霉素和替考拉宁是目前仅有的能有效作用于MRSA的有效药物。MRAS的世界性问题导致万古霉素和替考拉宁的需求量增加[4]。与万古霉素相比,替考拉宁因其毒副作用更低,在体内半衰期更长而更具有优势[5]。
为了提高替考拉宁的产量,学者们致力于对其进行菌种筛选和发酵工艺的改良。金志华等[6]以缬氨酸氧肟酸为筛选剂,筛选出一株每升发酵液能产生1.8 g替考拉宁的突变株,其产量比出发菌株提高了50%。Lee[7]通过优化培养基,使得替考拉宁产量提高到1.5 g/L。Jung[8]等通过紫外诱变筛选优势菌和优化上罐发酵条件,使得替考拉宁产量最终达到2.8 g/L。进一步的研究表明,替考拉宁对自身菌体具有一定的反馈抑制作用[4,9]。Lee 等[10]在接种时向培养基中加入0~200 mg/L替考拉宁以考察其对A.teicomyceticusATCC 31121菌株发酵的影响。研究表明,当添加的替考拉宁浓度为10 mg/L时,替考拉宁的形成几乎被完全抑制。笔者通过对替考拉宁的抗性筛选及向发酵液中加入吸附树脂以吸附一部分产物替考拉宁,从菌体和发酵条件2个方面提高菌体对自身产物的耐受性,进而提高替考拉宁产量。
1 材料与方法
1.1 菌种与培养基
1.1.1 菌种。替考游动放线菌由广州市微生物研究所中心实验室保藏。
1.1.2 培养基。固体培养基组成为:葡萄糖1.0 g/L,酵母粉2.0 g/L,K2HPO41.0 g/L,KCl 6.0 g/L,MgSO4·7H2O 0.6 g/L,FeSO4·7H2O 0.04 g/L,pH 7.0。种子培养基组成为:糊精4.0 g/L,可溶性淀粉 24 g/L,酵母粉 6.0 g/L,蛋白胨 2.0 g/L,CaCO32.0 g/L,pH 7.4。发酵培养基组成为:糊精 12 g/L,可溶性淀粉20 g/L,黄豆粉24 g/L,玉米浆16 g/L,Ca-CO32.0 g/L,pH 6.8。供试替考拉宁由广州市微生物研究所提取纯化,经HPLC测定发现其纯度和组分符合药典规定。
1.2 替考拉宁对自身菌体的抑制作用考察 将替考拉宁成品配制成一定浓度的溶液,过滤除菌后涂布到固体培养基上,将未处理的替考拉宁孢子悬液涂布于含有不同浓度的替考拉宁产品的平板培养基上,28℃培养箱培养,观察孢子生长情况。同时,将不同浓度的替考拉宁产品经过滤除菌后加入发酵培养基中,接种种子液(接种量10%),28℃,150 r/min摇床振荡培养一定时间后,取样,测定其效价,考察替考拉宁对发酵的影响。
1.3 抗性菌株选育 将紫外诱变后的孢子涂布于含特定浓度替考拉宁产品的平板培养基上,筛选抗性突变株。
1.4 发酵液中吸附树脂的加入
1.4.1 树脂的预处理。选取HZ 801(上海华震科技有限公司生产),Diaion HP-20(日本三菱公司生产)。XAD-16、FPA53、PLC 90、PLC 98(美国Rohm and Haas公司生产)为添加至发酵液中的吸附树脂。树脂在使用前,先用浓度100%甲醇浸泡12 h,以除去其中的杂质,用纯化水洗至中性后,将树脂放入超声波清洗器中超声脱气,将处理后树脂加入未灭菌的发酵培养基中,121℃,30 min灭菌。
1.4.2 发酵液中加入树脂的培养条件。从斜面上挖取成熟孢子接入500 ml装有种子培养基50 ml锥形瓶中,28℃,150 r/min摇床振荡培养48 h后,移取10 ml种子液接入500 ml装有100 ml发酵培养基的锥形瓶中。发酵培养一定时间后取样,测定其效价。
1.5 组分及效价测定 组分测定采用HPLC法[11];效价测定采用微生物管碟法[12]。
2 结果与分析
2.1 替考拉宁对自身菌体的抑制作用 配制一定浓度的替考拉宁成品溶液,微膜过滤除菌,吸取150μl涂布在倒有固体培养基的平皿上,将未经处理的替考拉宁孢子悬液涂布其上,培养并观察菌落的生长。
从表1可以看出,随着涂布在平板表面的替考拉宁浓度的增加,孢子开始生长的时间越长,且生长速度缓慢,当涂布有0.012 g替考拉宁时其自身孢子几乎不生长。
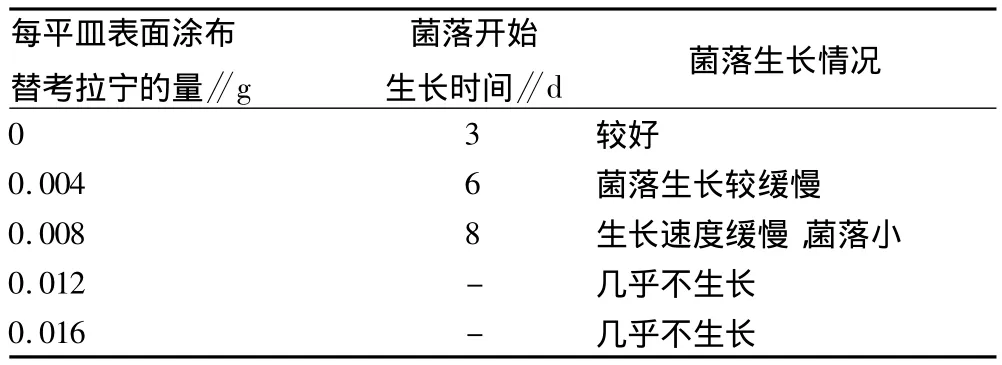
表1 替考拉宁产品对自身菌体生长的影响
为了进一步考察替考拉宁产生菌在发酵过程中是否受自身代谢产物的抑制,接种时向发酵液中加入0~30 mg/L替考拉宁成品,发酵培养8 d后测其效价。从图1可以看出,不加替考拉宁的效价为521.32 U/ml;当替考拉宁的添加浓度为5~15 mg/L时,替考拉宁的效价呈缓慢增加趋势;当替考拉宁的添加浓度为20 mg/L时,最终替考拉宁的效价为306.70 U/ml,下降了41%;当替考拉宁的添加浓度为 30 mg/L时,最终效价仅有116.62 U/ml,其形成受到严重的抑制作用。
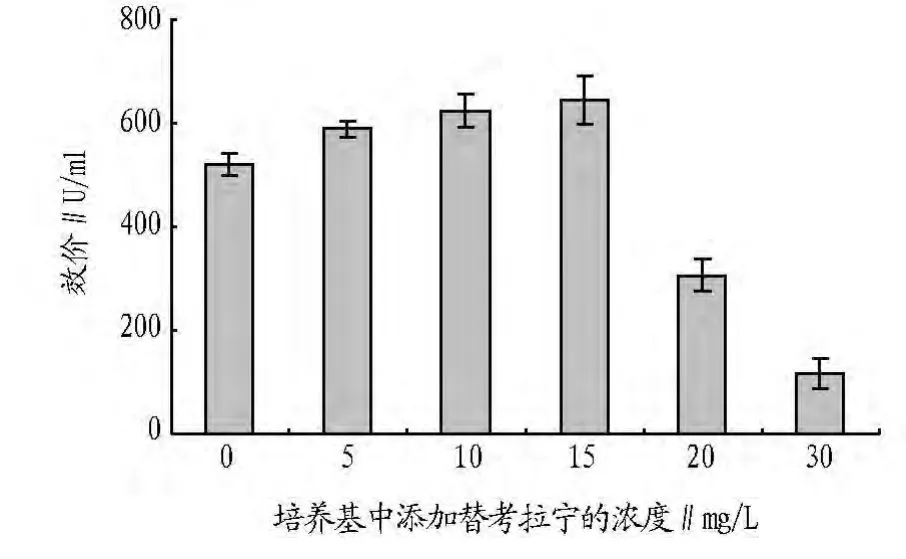
图1 接种时发酵液中加入替考拉宁对终产物的反馈阻遏作用
2.2 抗性菌种的选育 以替考拉宁放线菌 (Actinoplanes teichomyceticus)为出发菌株,制成一定浓度的菌悬液,紫外照射120 s,暗培养2 h,稀释涂布含有0.012 g替考拉宁的平板上,28℃培养箱培养。挑选一定数量的菌落划线斜面,比较其发酵水平。通过一定数量的筛选,获得一株比出发菌株生产能力高18%的菌株,菌株编号为GWT-12-043。群体传代显示,该菌连传10代,其效价水平波动较小。
2.3 发酵液中加入吸附树脂的发酵培养 取HZ 801、Diaion HP-20、XAD-16、FPA 53、FPL 90、FPL 98 6 种经预处理的树脂,加入发酵培养基中,加入树脂量为5%(W/V)。121℃,30 min灭菌,向其中接入种子液,28℃,150 r/min摇床振荡培养8 d后,4 000 r/min,10 min离心,取上清液,测定效价,其沉淀用等体积80%甲醇静态解析30 min后,测定解析液效价。
由表2可知,树脂HZ 801、树脂Diaion HP-20和XAD-16均能明显地提高发酵液中替考拉宁的效价,分别是不添加树脂发酵液的1.66、3.28 和2.07 倍;FPA 53、FPL 90 和 FPL 98的效果较差。吸附效果最好的树脂Diaion HP-20,其发酵液上清液的效价为66.30 U/ml,吸附率达到96.45%。
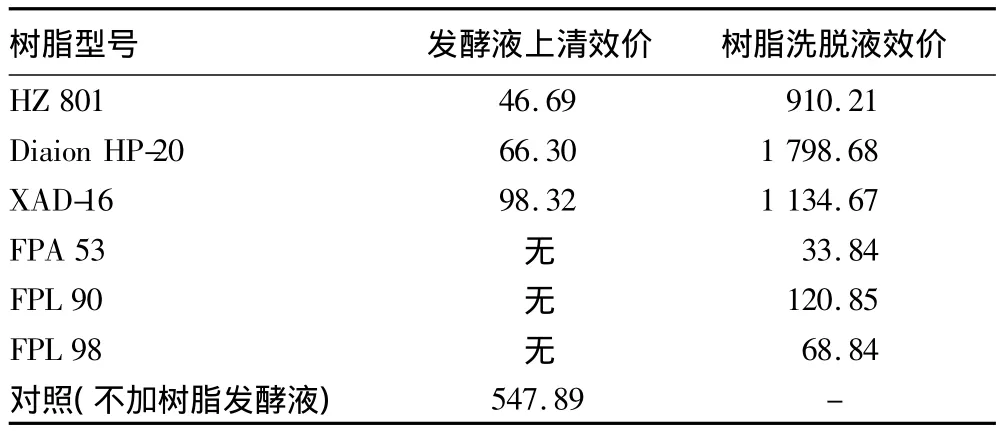
表2 不同树脂解析液和发酵液中替考拉宁的效价 U/ml
为了探索加入发酵液中吸附树脂的最适比例,分别选取价格最低廉的树脂HZ 801、吸附能力最好的树脂Diaion HP-20,按不同比例加入发酵液中,接种培养8 d后测定其效价。由表3可知,添加7%树脂HZ 801时吸附效果最好,替考拉宁的效价最高;当添加7%树脂Diaion HP-20时,其树脂洗脱液效价达到2 173.20 U/ml,吸附率达到97.88%,已经逼近Jung 等[8]所报道的 2.8 g/L。
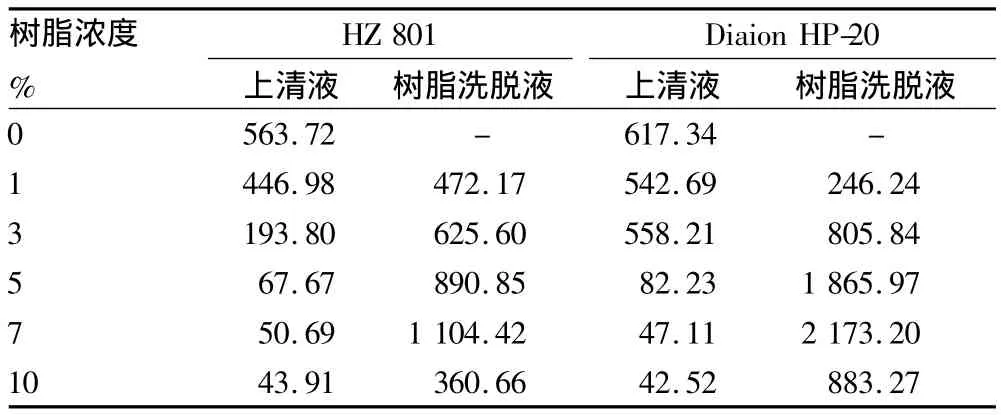
表3 培养基中加入不同浓度树脂HZ 801和Diaion HP-20的效果U/ml
虽然树脂Diaion HP-20对产替考拉宁的吸附量最大,但价格较昂贵,工业用价格约为200元/L,而国产树脂HZ801价格仅在10元/L左右。采用哪种型号的树脂,还需根据实际情况进行具体分析。
3 讨论
抗生素产生菌对其自身所产抗生素的耐受能力不同,高产菌株的耐受能力大于低产菌株[13]。该研究通过用自身抗生素替考拉宁结合紫外诱变来筛选高产菌株,替考拉宁效价提高18%。在发酵过程中,替考拉宁的积累会抑制自身菌体的生长[4]。为了减弱发酵液中替考拉宁对自身菌体生长的抑制作用,在接种前向培养基中加入吸附树脂与菌体一起发酵培养。研究表明,离子交换树脂Diaion HP-20的吸附作用最好,其吸附率达到96%以上,只有不到4%的替考拉宁分布于发酵液中,大大降低了发酵液中替考拉宁的浓度,从而减轻了对自身菌体的抑制作用,进一步提高替考拉宁的产量。
徐波等[14]利用放线菌次级代谢产物产生菌的基因重排育种技术,筛选出一株使替考拉宁产量提高65.3%的融合菌株。在下一步的工作中,将继续进行菌种的筛选工作,并且尝试新的选育方法,以提高菌体对替考拉宁的耐受性,甚至实现不需要通过向发酵液中加入树脂即可以达到高产量的目的。
[1]PARENTIF,BERETTA G,BERTIM,et al.Teichomycins,new antibiotics fromActinoplanes teichomyceticusNov.Sp.I.Description of the producer strain,fermentation studies and biological properties[J].The Journal of Antibiotics,1978,31(4):276 -283.
[2]BARDONEM R,PATERNOSTER M,CORONELLIC.Teichomycins,new antibiotics fromActinoplanes teicomyceticusnov.sp[J].Antibiot,1978,31:170-177.
[3]BROGDENRN,PETERSDH.Teicoplanin.A reappraisal of itsantimicrobial activity,pharmacokinetic properties and therapeutic efficacy[J].Drugs,1994,47:823 -854.
[4]HEYDORN A,TRINE S J,NIELSEN J.Growth and production kinetics of a teicoplanin producing strain ofActinoplanes teicomyceticus[J].JAntibiot,1999,52:40 -44.
[5]WOOD M J.The comparative efficacy and safety of teicoplanin and vancomycin[J].Antimicrob Chemother,1996,37:209 -222.
[6]JIN Z H,WANGM R,CEN P L.Production of teicoplanin by valine analogue-resistantmutant strains ofActinoplanes teichomyceticus[J].Applied Microbiology and Biotechnology,2002,58:63 -66.
[7]LEE JC,MIN JW,PARK D J,et al.Large-scale fermentation for the production of teicoplanin from a mutant ofActinoplanes teichomyceticus[J].Microbiol Biotechnol,2005,15:787 -791.
[8]JUNGH M,KIM SY,PRABHU P,etal.Optimization of culture conditions and scale-up to plant scales for teicoplanin production byActinoplanes Teichomyceticus[J].Appl Microbiol Biotechnol,2008,80:21 -27.
[9]FAZELIM R,COVE JH,BAUMBERG S.Physiological factors affecting streptomycin production byStreptomycesgriceusATCC 12475 in batch and continuous culture[J].FEMSMicrobiology Letters,1995,126:55 -62.
[10]LEE JC,PARK H R,PARK D J,etal.Improved production of teicoplanin using adsorbent resin in fermentations[J].Letters in Applied Microbiology,2003,37(3):196 -200.
[11]蒋沁,倪会敏,石磊,等.HPLC法快速检测发酵液中替考拉宁含量[J].天津药学,2006,18(2):21 -23.
[12]CHEN Y,WANG SY,HUG Y.Determination of teicoplanin in injection by bioassay[J].Chinese Pharmaceutical Journal,2002,37(4):302 -304.
[13]白芳静,左良成,尤春静,等.替考拉宁产生菌耐自身抗性变株的选育[J].畜牧与饲料科学,2011,32(7):98 -99.
[14]徐波,王明蓉,夏永杨,等.应用基因组重排育种新方法筛选替考拉宁高产菌[J].中国抗生素杂志,2006,31(4):237 -242.
Resistance Screening of Teicoplanin-Producing Strains and Fermented Condition
HU Hai-yan,XIA Feng-geng et al (Guangzhou Institute of Microbiology,Guangzhou,Guangdong 510663)
[Objective]Strain selection and fermentation technology research were studied to limit self repression,so as to increase teicoplanin production.[Method]Taking teicoplanin itself as the selective agent,resistance screeningwasmade on the teicoplanin-producing strainActinoplanesteichomyceticusthrough ultravioletmutagenesis.Fermented condition was studied by adding various adsorbent resins to the culture broth for teicoplanin adsorption.The adsorbed teicoplanin was extracted from the resins via 80%methanol after fermentation.Antibiotic activity was quantified by the cylinder platemethod.[Result] The fermentation level of the obtained strain was 18%higher than that of parent strain.Diaion HP-20 was themost effective adsorbent resin when added at the concentration of 7%(w/V)in the inoculation stage,with a 3.52-fold increase in the quantities of teicoplanin.[Conclusion]It is feasible to limit self repression by using resistance screening and adding adsorbent resin into fermentation broth.The results of this study can provide theoretical basis for the industrial production of teicoplanin.
Teicoplanin;Actinoplanesteicomyceticus;Resistantmutant;Adsorbent resin;Diaion HP-20
S188+.8
A
0517-6611(2014)15-04561-02
胡海艳(1985-),女,湖南醴陵人,工程师,硕士,从事微生物发酵、酶方面的研究。*通讯作者,高级工程师,从事微生物发酵、食品添加剂、药物开发方面的研究。
2014-04-29

