酚/氯仿法和盐析法提取人类外周血基因组DNA方法的比较
宋洁云,刘芳宏,马 军,陈远帆,王海俊
(北京大学儿童青少年卫生研究所,北京 100191)
近年来,基因组关联分析及后续的验证研究在疾病遗传病因探讨方面取得越来越多的成果,在人群中开展大规模的分子遗传学研究已经成为一个重要的研究方向。因此从外周血样本中提取高纯度和产量的基因组DNA对于疾病遗传病因的研究非常必要。酚/氯仿法和盐析法均是目前提取外周血基因组DNA的方法[1]。酚/氯仿抽提方法可以较好地去除蛋白质和色素物质,多项研究均表明通过经典或改良酚/氯仿法都能获得高纯度的 DNA[2-4],但使用有机溶剂提取大量样本的过程可能对操作人员身体造成危害。而盐析法不需要使用有毒的有机溶剂,费用低廉,也有研究证实盐析法获取的DNA可以满足PCR扩增的要求[5,6],但盐析法获取的DNA纯度能否满足后续的分子生物学实验的要求尚不明确。本研究比较两种方法提取的DNA的纯度、产量及后续实验效果。
1 材料与方法
1.1 材料 80份-20℃保存的静脉血凝块(2-3 ml),分为酚/氯仿和盐析法两组进行DNA提取。所用试剂包括:4%CTAB,3×MLB溶液(24 m M Tris-Cl p H=8.0,24 m M EDTA p H=8.0,240 m M NaCl,4.8%SDS,0.048 mg/ml蛋白酶 K,二硫苏糖醇1.44 mg/ml),TE (10 m M Tris-Cl,1m M EDTA,p H=8.0),SE(25 m M EDTA,75 m M NaCl),5M NaCl,Tris-饱和酚,氯仿,异丙醇,无水乙醇,超纯水。所有试剂均为分析纯,购自北京鼎国生物科技有限公司。
1.2 方法
1.2.1 DNA提取
1.2.1.1 酚/氯仿法[7]
(1)将血凝块样本解冻后,捣碎至无明显大块血凝块,加水至12 ml,充分混匀,3 000 r/min离心10 min,弃上清;
(2)沉淀中加入2 ml CTAB,捣碎沉淀,血凝块碎片小于上一步骤,加水至12 ml,充分混匀,3 000 r/min离心10 min,弃上清;重复该步骤;
(3)沉淀中加入少量水,捣碎沉淀,加水至10 ml,3 000 r/min离心10 min,弃上清并晾干沉淀,加入0.5 ml 3×MLB溶液,37℃水浴过夜消化;
(4)转移液体到EP管,加入0.5 ml酚/氯仿/异戊醇(25∶24∶1)混合液,上下颠倒混匀,13 000 r/min离心10 min,吸取上清液到新的EP管;
(5)加入0.5 ml氯仿,上下颠倒混匀,13 000 r/min离心10 min,吸取上清液到新的EP管,重复该步骤;
(6)在上清中加入1.0 ml提前-20℃预冷的无水乙醇,上下颠倒混匀可见絮状物质析出,4℃12 000 r/min离心20 min,小心弃去上清;
(7)用1 ml-20℃预冷的70%乙醇清洗沉淀两次,每次13 000 rpm离心10 min,小心弃去上清;
(8)室温干燥,加入70μl TE缓冲液,充分溶解后-20℃或-80℃保存备用。
1.2.1.2 盐析法[8]
(1)血凝块的处理同酚/氯仿法步骤(1)-(3);
(2)加1 ml SE缓冲液,用旋涡混匀器短暂混匀,放置于55℃水浴摇床10分钟。
(3)加0.5 ml 5M氯化钠溶液,充分混匀。室温4 000 r/min离心15 min。
(4)加入纯乙醇4 ml,盖上静置约30 min。上下缓慢颠倒数次,至DNA絮状物析出。4000 r/min离心20 min,小心弃去上清,保留沉淀;
(5)用-20℃预冷的70%乙醇1 ml左右清洗,弹起沉淀,转移至新的EP管中,13 000 rpm离心10 min。70%乙醇清洗可以视沉淀的颜色而增加次数。
(6)室温干燥,加入70μl TE缓冲液,充分溶解后-20℃或-80℃保存备用。
1.2.2 DNA纯度、浓度和完整性的检测
使用DNA浓度测定仪对DNA的纯度和浓度进行测量。两组分别取50 ng DNA采用1%琼脂糖凝胶电泳检测其完整性。
1.2.3 PCR扩增
选择基因片段(胰岛素诱导基因2,INSIG2)进行扩增,上游引物:5’-TCCACGTCTTATTGACAGCAG-3’,下游引物:5’-GTAGTTCTTCTTCCCAA GGGC-3’,扩增片段长度为259 bp。PCR反应体系为25μl,包含10×缓冲液2.5μl,MgCl2(20 m M)1.875μl,上下游引物(100μmol/L)各0.25μl,脱氧核苷三磷酸(10 m M)0.5μl;模板50 ng,TaqDNA聚合酶(2U/μl)0.5μl。PCR 反应条件:94℃预变性5 min;35个循环(94℃变性30 s,58.5℃退火30 s,72℃延伸30 s),72℃10 min。
PCR扩增完成后,取5μl PCR产物在2.5%琼脂糖凝胶上进行电泳,用凝胶成像系统照相。
1.2.4 基质支持的激光释放/电离飞行时间质谱分析(MALDI-TOF MS)
按照MALDI-TOF MS方法的标准流程对两种不同方法提取的DNA样本进行质谱分析,对基因组DNA的32个单核苷酸多态性(SNP)同时进行分型。
1.3 统计学分析
用SPSS 17.0软件进行统计学分析。
2 结果
2.1 DNA浓度和纯度检测结果
对两种方法提取的基因组DNA的纯度进行比较,结果发现酚/氯仿法提取的基因组DNA纯度高于盐析法(P<0.001),但两组DNA纯度平均值都高于1.80;比较两组的浓度,没有发现两种方法提取的DNA浓度存在差异(P=0.819)。采用1%琼脂糖凝胶电泳,两组DNA条带均没有出现明显的拖尾现象(图1)。

表1 两种方法提取的基因组DNA的纯度和浓度比较(±s)酚/氯仿法(n=40)盐析法(n=40) t值 P值纯度(A260/280) 1.88±0.04 1.82±0.04 7.739 <0.001浓度(ng/μl)1204.05±404.95 1224.52±455.59 -0.229 0.819
2.2 PCR扩增结果比较
将两种不同方法提取的DNA进行PCR扩增,其产物进行琼脂糖凝胶电泳效果如图2。酚/氯仿和盐析法提取的DNA均得到了有效扩增,且扩增效果无明显差异。
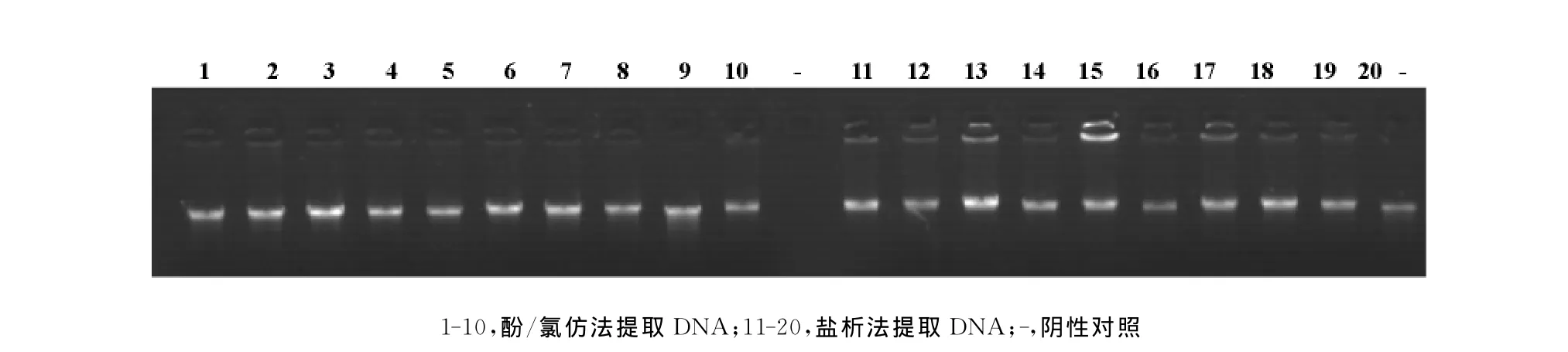
图1 两种方法提取的基因组DNA琼脂糖凝胶电泳图
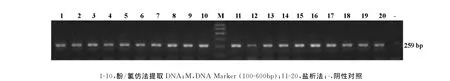
图2 两种方法提取DNA的PCR扩增产物琼脂糖凝胶电泳图
2.3 基质支持的激光释放/电离飞行时间质谱分析(MALDI-TOF MS)结果
将两种方法提取的DNA进行 MALDI-TOF MS检测,如图3所示,以rs2645424多态性的分型结果为例,两组样本在峰高度、峰形状和基线水平等方面均没有明显差异。

图3 不同方法提取DNA的MALDI-TOF MS检测rs2645424多态性结果图
3 讨论
酚/氯仿法和盐析法均是目前提取外周血基因组DNA的方法,本研究使用这两种方法对外周血凝块进行基因组DNA提取,并对提取效果进行了比较。
本研究所使用的酚/氯仿和盐析法在处理血凝块阶段步骤一致,不同之处主要在纯化和分离DNA方法不同。酚/氯仿法利用蛋白质和DNA溶解于不用液相溶液而进行分离,可有效去除蛋白质及色素等物质,使DNA达到较高的纯度;数次使用氯仿进行抽提,多次转移DNA,操作步骤繁琐复杂,处理多个样本时间冗长;酚和氯仿均有挥发毒性,对环境造成诸多危害,长期使用严重危害实验人员的健康。盐析法利用DNA和蛋白质等其它成分在不同浓度的NaCl溶液中溶解度不同以达到分离目的,与酚/氯仿法相比,盐析法不需使用有毒的有机溶剂,只转移DNA一次,操作简便快捷,处理多个样品的时间减少,工作效率提高。
在DNA产量方面,有文献报道盐析法获取的DNA产量较高[9],本实验中盐析法获取的DNA产量稍高于酚/氯仿法,结果不具有统计学意义。酚/氯仿法中使用的市场上购买的饱和酚多不能达到PH 8.0,根据相似相溶原理,酸性酚会使DNA溶于其中,降低提取量[1],而盐析法不需要酚,不会面临相同的问题;除此之外,盐析法简化了从消化液中提取DNA的步骤,减少了DNA转移的次数,从而降低了DNA损失,因此DNA产量较高。但本实验中没有发现盐析法获取的DNA产量明显高于酚/氯仿法,这可能是因为本实验室使用酚/氯仿法提取DNA经验较多,DNA转移中损耗较少。
在DNA纯度方面,酚/氯仿法可有效去除蛋白质及色素等物质,使DNA达到较高的纯度;而盐析法利用高盐浓度中DNA和其它物质溶解度不同提取DNA,因存在盐或其它物质的残留使DNA纯度较低,有研究发现盐析法提取的DNA纯度低于酚/氯仿法[9]。本研究中也发现类似结果,但值得注意的是,盐析法提取DNA纯度也达到1.80的水平,在后续的PCR扩增实验中,盐析法提取的DNA得到了有效扩增,且扩增效果与酚/氯仿法无明显差异。本研究还用两种方法提取的DNA样本进行MALDI-TOF MS检测。MALDI-TOF MS检测方法可对基因多态性进行高通量分型,极大的节省实验时间,并且结果准确可靠,近年来在疾病遗传病因领域广泛应用;但由于其昂贵的造价,保证DNA样本的质量显得尤为重要。本研究发现盐析法提取的DNA样本完全可以满足MALDI-TOF MS检测的要求。
综上所述,本实验比较酚/氯仿法和盐析法提取的外周血基因组DNA,发现盐析法提取的DNA能满足后续的PCR扩增和飞行质谱实验方法质量要求;并且与酚氯仿相比,盐析法操作方法简单,耗时较短,还可避免使用对人体损伤较大的有机溶剂,是一种值得推广的DNA提取方法。
[1]张冬会,史英钦,张文杰.外周血DNA提取方法及其特点[J].中国组织工程研究与临床康复,2007,11(11):2167.
[2]赵嘉惠,张华屏.外周血DNA提取方法的比较及改良[J].山西医科大学学报,2006,37(1):12.
[3]涂向东,江清华,兰风华.三种简易提取全血基因组DNA方法的比较[J].中国实验诊断学,2006,10(3):264.
[4]刘正旺,云美玲,钟江华,等.提取陈旧血液标本中的三种方法比较[J].中国热带医学,2012,12(3):321.
[5]焦 鹏,叶文静,常 起,等.人血细胞DNA无酚提取法[J].基础医学与临床,2007,27(8):918.
[6]贾二娟,朱伟锋,余乐涵.蛋白酶K对盐析法提取全血的影响[J].实验与检验医学,2011,29(3):63.
[7]Miller SA,Dykes DD,Polesky HF,et al.A simple salting out procedure for extracting DNA from human nucleated cells[J].Nucleic Acids Res,1988,16(3):1215.
[8]Grimberg J,Nawoschik S,Bellusciol,et al.A simple and efficient non-organic procedure for the isolation of genomic DNA from blood[J].Nucleic Acids Res,1989,17(20):8390.
[9]胡永华,韩喜荣.从外周血获取DNA样本的方法学研究[J].中华流行病学杂志,2002,23(增刊),145.

