反应体系对荧光定量PCR检测乙肝核酸结果影响的分析
郭 楠,李宝萍,李慧萍,姚兴伟,杨曦明
(北京中医药大学东直门医院 检验科,北京 100700)
乙型肝炎是我国流行较广的一种传染性疾病。患者血清中HBV-DNA拷贝数最直接、可靠的反映HBV的复制情况,是乙型肝炎临床诊断、判断病情及预后,决定治疗监测的主要参考指标。目前国际上公认的具有参比价值的是罗氏公司生产的Roche COBAS Taqman 48 HBV DNA定量试剂(COBAS Taq Man HBV Test)[1-3],但该试剂价格昂贵,且必须采用Roche公司专用的PCR仪。因此各大医院多采用国产试剂进行检测,为降低试剂成本,国产试剂普遍存在反应体系较小的特点,虽简化了核酸提取过程,但可能会对结果的重复性和准确性造成影响。本实验室自建立临床基因扩增检测技术以来,对实时荧光定量PCR用于临床检测时标本处理和反应体系的确立开展了研究,本文主要从以上两方面探讨其对检测结果的影响。
1 材料与方法
1.1 材料
血清标本来自于本院就诊的乙肝患者,收集检测 HBV-DNA结果范围在10-103copies/ml和105-107copies/ml样本各10例。
1.2 试剂与仪器
试剂盒来自上海复星长征医学科学有限公司;实时荧光定量PCR仪为伯乐MJ Research Opticon II;质控品由康彻斯坦生物公司提供。
1.3 方法
1.3.1 按患者HBV-DNA的拷贝数分组 低拷贝数 组 (10-103copies/ml)和 高 拷 贝 数 组 (105-107copies/ml),结果≥500 copies/ml为阳性。
1.3.2 按核酸提取时加样量不同分组 A组:提取液A与待测样本各50μl加入0.5 ml离心管中;B组:提取液A与待测样本各100μl加入0.5 ml离心管中。震荡混匀10秒,13 000转离心10分钟,弃去上清液,于沉淀中加入50μl提取液B震荡10秒,放置恒温金属浴100℃加热10分钟,13 000转离心2分钟,保留上清液为核酸提取物。
1.3.3 按反应体系量不同分组 Ⅰ组反应体系为50μl,其中含有缓冲液30μl、Mg2+5μl、荧光探针5 μl、Taq酶3μl,加入待测样本核酸提取物7μl,混匀;Ⅱ组反应体系为30μl,其中含有缓冲液18μl、Mg2+3μl、荧光探针3μl、Taq酶2μl,加入待测样本核酸提取物4μl,混匀。
1.3.4 统计学分析 采用SPSS13.0统计软件进行数据分析。不同组间数据比较用多因素方差分析;检测结果与加样量和反应体系之间做偏相关分析。P<0.01有统计学意义。
2 结果
高拷贝数组患者的HBV-DNA结果除ⅠB组与ⅡA组之间有明显差异,P<0.01,其余各组间没有因提取体系和反应体系的改变存在明显差异,P>0.05(见表1)。
低拷贝数组患者HBV-DNA结果除ⅡA组与ⅡB组之间没有明显差异,P>0.05;其他各组因提取体系和反应体系的改变存在明显差异,P<0.01(见表2)。
高拷贝数组的检测结果与提取核酸时的加样量及反应体系的量之间呈低度相关,(r=0.170,0.194,P>0.05),差异没有明显统计学意义。
低拷贝数组的检测结果与反应体系的量之间呈中度相关(r=0.744,P<0.01),差异有明显统计学意义;低拷贝数组的检测结果与提取核酸时的加样量低度相关(r=0.256,P>0.05),差异没有明显统计学意义。
3 讨论
在核酸定量技术的发展中,实时荧光定量PCR是发展最快和最有应用价值的技术。在遗传病、感染性疾病或肿瘤的基因诊断,用药监测等方面[4、5],作用越来越大,被广泛的应用于临床。特别是在乙型肝炎病毒检测方面,具有明显的优势,成为分子诊断的重要手段。而HBV-DNA检测结果的准确性和可靠性直接影响乙肝的诊断、治疗方案的确定及疗效的观察。
本实验研究通过改变提取核酸时加入的样本量以及最终的反应体系,发现高拷贝数组中在HBVDNA的浓度与加入的样本量之间及反应体系的量之间均呈低度正相关性,各组间的结果相差不到一个数量级。虽然ⅠB组与ⅡA组之间有明显差异,P<0.01,但是由于结果相差不到一个数量级(算术均数相差为2.3倍),而且临床认为一般量值变化在一个数量级内均可视为没有变化[6],要求患者连续两次结果之间大于2个数量级才认为病毒部分应答,用药有效,因此对临床诊断并无影响。对于低拷贝数组,10例ⅠA组小于1000copies/ml的样本减少反应体系后只有4例检出有反应,由于反应体系的减小,原本低浓度的样本中捕获到病毒DNA的几率大大降低,造成结果存在明显差异,P<0.01;即使增加提取核酸时加入的样本量,仍然有3例检出没有反应,其余7例<500copies/ml,均为阴性,其中5例为假阴性,结果存在明显差异,P<0.01。并不能像在高拷贝数组中通过提取核酸时加大样量来弥补造成的结果下降。
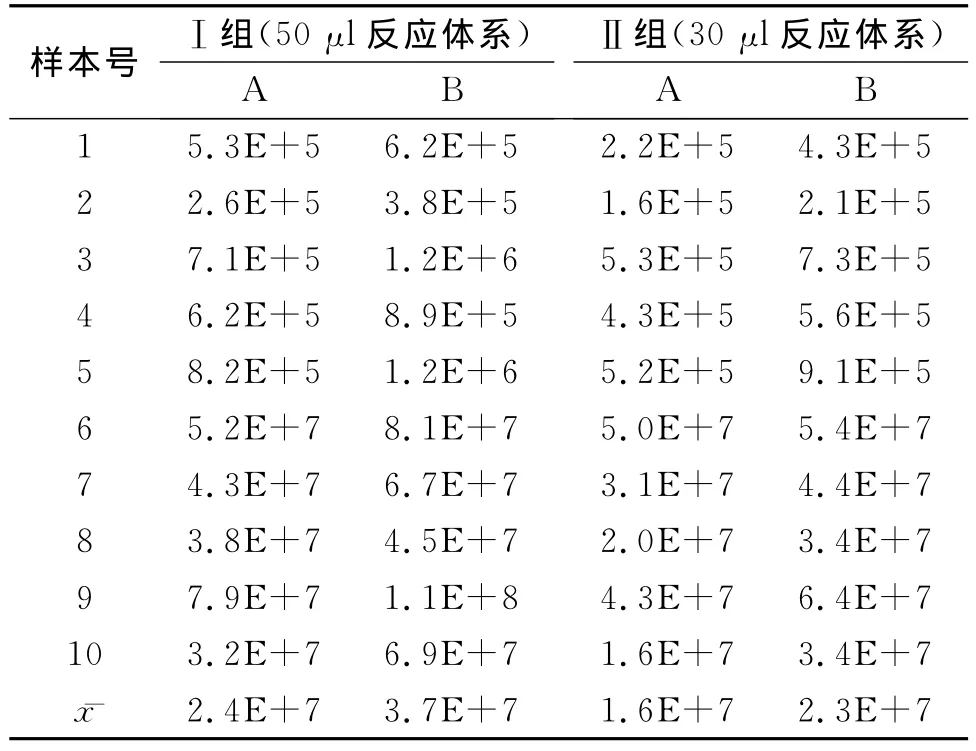
表1 高拷贝数组HBV-DNA定量结果
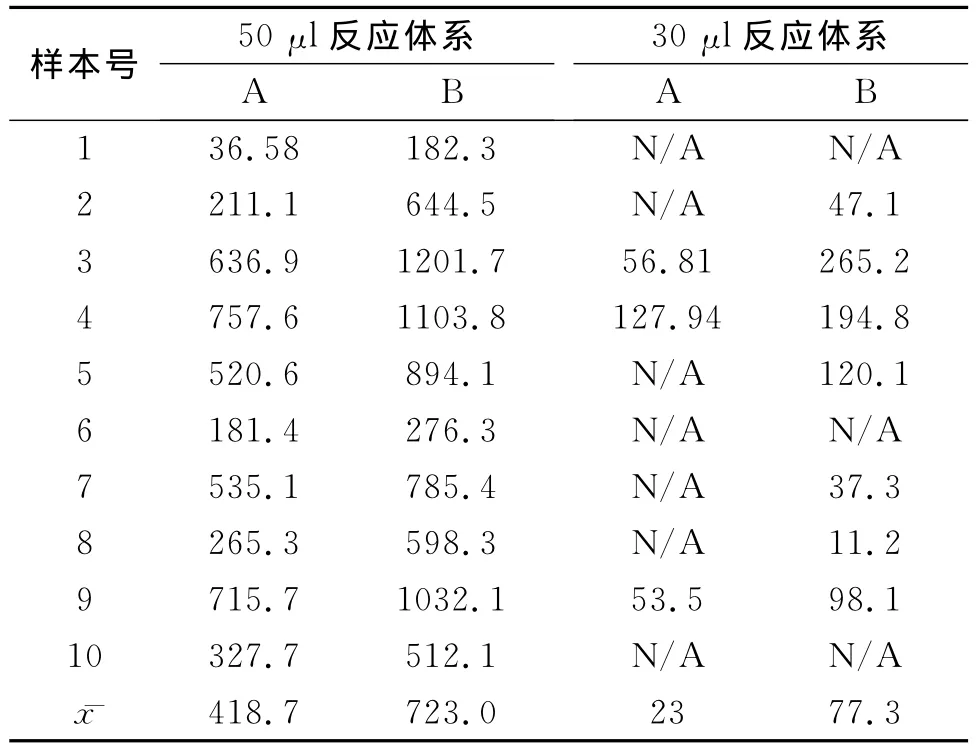
表2 低拷贝数组HBV-DNA定量结果
减小反应体系,可以节约成本,对高拷贝数样本影响小,但对于低拷贝数样本影响很大,可能会造成结果的假阴性。所以在进行HBV-DNA检测时,要确保反应体系加入的核酸提取物足够量,加大反应体系可以保证核酸检出的阳性率。
[1]Allice T.Comparison of the Cobas Ampliprep/Cobas Taq Man HBV Test versus the Cobas Amplicor HBV monitor for HBV-DNA detection and quantification during antiviral therapy[J].New Microbiol,2008,31:27.
[2]Gordillo RM,Gutierrez J,Casal M.Evaluation of the COBAS Taq Man 48 real-time PCR system for quantitation of hepatitis B virus DNA [J].J Clin Microbiol,2005,43:3504.
[3]Sum SS.Comparison of the COBAS Taq Man HBV test with the COBAS Amplicor monitor test for measurement of hepatitis B virus DNA in serum[J].J Med Virol,2005,77:486.
[4]Wang X,LI X,Currie RW,et al.Applicationof realtime polymerase chain reaction to quantitate induced expression of inter-leukin-1 beta mRNA in ischemic brain tolerance[J].J Neurosci Res,2000,59(2):238.
[5]Dekok JB,Ruers TJ,Van Muljen GN.et al.Realtime quantification of human telomerase reverse transcriptase mRNA in tumors and healthy tissues[J].Clin Chem,2000,46(3):313.
[6]李金明.乙型肝炎病毒血清标志物测定及结果解释的若干问题[J].中华检验医学杂志,2006,29(5):385.

