小G蛋白Rac1在马兜铃酸诱导肾小管上皮细胞损伤中的作用及意义
胡丽萍,陆红,白永恒,王斯璐,洪炜龙,林成成,梁勇,林向阳
(温州医科大学附属第一医院,浙江 温州 325000,1.医学检验中心;2.外科实验室)
近年来,有关服用中草药导致的肾脏损害屡见报道,马兜铃酸(aristolochic acid,AA)就是其中之一。在体内,AA引起损伤的主要病理表现为炎症细胞浸润、肾小管上皮细胞凋亡和坏死以及间质纤维化等[1]。目前AA致肾间质纤维化的分子机制尚不明确。我们前期研究显示,TGF-β1可能在AA诱导肾间质纤维化中发挥重要作用[2-3]。最近研究显示,GTPase Rho家族某些成员在调控TGF-β1中具有重要作用[4]。本研究拟通过体外实验观察AA对肾小管上皮细胞的损伤作用,同时探究GTPase Rho的重要成员Rac1蛋白在AA损伤小管上皮细胞过程中可能的作用。
1 材料和方法
1.1 材料 AA(美国Sigma公司);DMEM细胞培养液(美国Hyclone公司);胎牛血清(杭州四季青公司);胰蛋白酶和TRIzol提取液(美国Gibco公司);WST-1和Hoechst 33258染色液(上海碧云天公司);兔抗鼠Rac1抗体(美国Santa Cruz公司);兔抗鼠III型胶原抗体(Bioworld公司);Rac1和TGF-β1 ELISA检测试剂盒(上海西唐生物);RT-PCR试剂(美国Promega公司);MYCYCLER梯度PCR仪(美国BIOROD公司);7500定量PCR仪(美国Applied Biosystens公司);Varioskan Flash全波长多功能扫描仪(美国Thermo Scientific公司);DM4000 B LED荧光正置显微镜(德国Leica公司)。
1.2 方法
1.2.1 细胞培养:大鼠肾小管上皮细胞NRK-52E购自中科院上海生命科学研究院细胞资源中心。NRK-52E细胞在含5%小牛血清的DMEM培养液中,于37 ℃,5% CO2培养箱内培养。取细胞接种于6孔板中,待细胞70%~80%融合时,在培养液中加入AA,对照组加入含有等量溶剂的培养液。继续培养24 h后,用倒置相差显微镜观察细胞形态学变化。
1.2.2 WST-1法检测细胞增殖抑制率:取对数生长期的NRK-52E细胞,用胰酶消化,调整细胞密度为5×107/L,接种于96孔培养板中,每孔加入100μL培养液。待细胞贴壁后,实验组每孔加入浓度为5、10、20、50和100μg/mL的AA,并设6个平行孔,作用24 h,对照组加溶剂;另外,在保持AA作用浓度为10μg/mL的情况下,分别作用24、48和72 h。培养结束前2 h每孔加入10μL WST-1溶液,培养结束后于全波长多功能扫描仪上测量450 nm主波长和690 nm副波长的吸光度值(A值),实验重复3次。按公式计算AA对NRK-52E细胞增殖的抑制率:细胞增殖抑制率(%)=1-(实验组A450值-空白组A690值)/(对照组A450值-空白组A690值)×100%。
1.2.3 Hoechst 33258染色观察细胞凋亡:将预处理的洁净盖玻片置于6孔板内,接种细胞培养过夜,当细胞密度达到70%~80%时,分别加入AA药物1μg/mL和10μg/mL作用24 h,移去培养液,4%多聚甲醛固定10 min,弃固定液,PBS洗两次,Hoechst 33258染液染色5 min,去染色液,PBS洗两次,吸尽液体。滴加抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,荧光显微镜观察,并随机选取位置拍照。
1.2.4 real-time RT-PCR检测TGF-β1 mRNA的表达:采用Trizol试剂提取已处理细胞中的RNA,于260/280 nm测定吸光度值以确定样本纯度和浓度。根据试剂说明书将RNA反转录成cDNA。应用Primer 5.0软件设计TGF-β1 mRNA的特异性引物,以β-actin作为内参,引物由上海生工公司合成。引物序列为TGF-β1:5’-AGGCGGTGCTCGCTTTGT-3’(正向)和5’-GATTGCGTTGTTGCGGTCC-3’(反向);β-actin:5’-CCCATCTATGAGGGTTACGC-3’(正向)和5’-TTTAATGT CACGCACGATTTC-3’(反向)。PCR扩增体系:5μL 2×SYBR Green荧光定量试剂、2μL引物(上、下游各1μL,终浓度200 nmol/L)、2μL反应缓冲液、1 μL cDNA。PCR程序为:95 ℃ 3 min预变性,1个循环;95 ℃ 5 s,60 ℃ 35 s,40个循环。采用相对定量法计算获得结果,溶解曲线分析结果的可靠性。相对表达量=2-△△Ct,ΔΔCt=[Ct目的基因(待测样品)-Ct内参照(待测样品)]-[Ct目的基因(校正样品)-Ct内参照(校正样品)]。
1.2.5 ELISA法检测Rac1和TGF-β1蛋白含量:取对数生长期的NRK-52E细胞,分别以1、5、10μg/mL AA作用24 h,收集培养液。Rac1和TGF-β1含量检测采用双抗体夹心ABC-ELISA法,严格按照Rac1和TGF-β1 ELISA检测试剂盒说明书进行操作。采用BCA法进行蛋白定量,根据与总蛋白比值绘制标准曲线。
1.2.6 细胞免疫荧光检测III型胶原和Rac1含量:将预处理的洁净盖玻片置于6孔板内,接种细胞培养,待细胞贴壁后,加入AA药物10μg/mL作用24 h。轻轻取出细胞爬片放到用过的细胞培养皿里,PBS洗3次,4%冷的多聚甲醛固定20 min,弃固定液,PBS洗3次;0.2% Triton X-100通透10 min,PBS洗3次;血清封闭30 min,PBS洗3次;加一抗,4 ℃湿盒内过夜,PBS洗3次;加二抗,37 ℃湿盒内1 h,PBS洗3次,甘油封片,照荧光片。
1.3 统计学处理方法 采用SPSS13.0软件包进行统计学分析。结果以 ±s表示,两样本比较采用成组t检验,相关分析采用pearson分析法。P<0.05为差异有统计学意义。
2 结果
2.1 WST-1法检测AA对NRK-52E细胞的增殖抑制率
结果显示,保持AA作用24 h情况下,随着AA浓度增加,细胞增殖抑制率明显增加;保持AA 10μg/mL作用浓度不变的情况下,随着作用时间的延长,AA对细胞的增殖抑制率明显增加,提示AA抑制NRK-52E细胞增殖具有浓度和时间的依赖性,见图1。
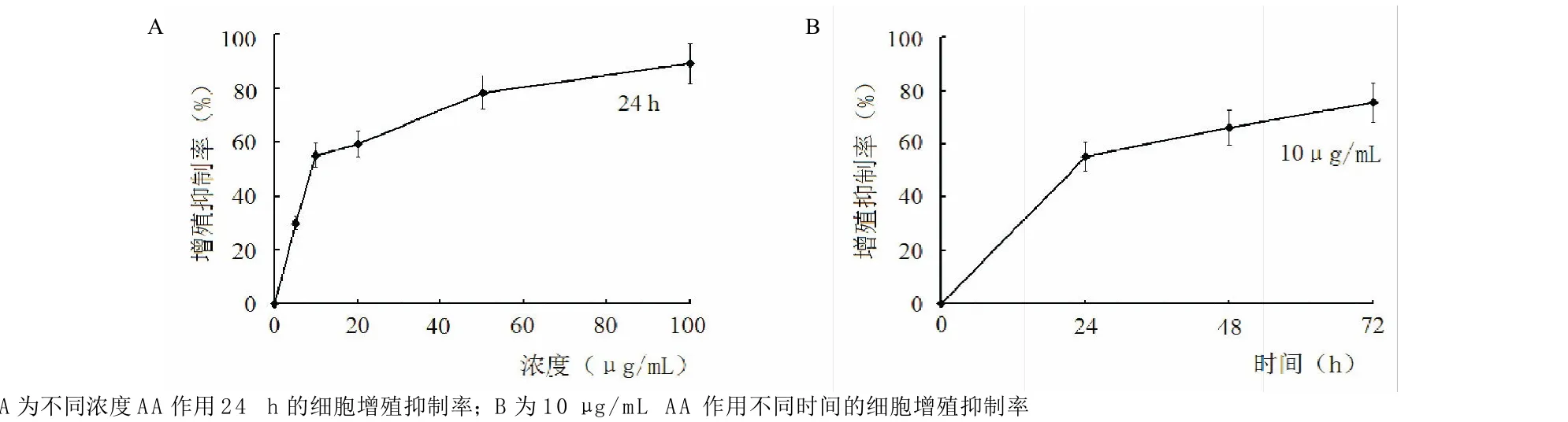
图1 AA对NRK-52E细胞增殖的抑制情况
2.2 Hoechst 33258染色观察AA对NRK-52E细胞凋亡的作用 与对照组细胞相比,AA 1μg/mL干预组的细胞出现凋亡小体,AA 10μg/mL干预组的细胞凋亡特征更明显,且细胞数量明显减少,提示AA能诱导肾小管上皮细胞凋亡,且在作用时间相同的情况下,高浓度AA诱导凋亡的作用更显著,见图2。

图2 Hoechst 33258染色检测AA诱导大鼠NRK-52E细胞凋亡(×400)
2.3 AA对肾小管上皮细胞胶原累积的影响 细胞免疫荧光及其相对定量结果显示,与对照组相比,10μg/mL AA作用NRK-52E细胞后,细胞外基质成分III型胶原的表达明显增多(P<0.05),提示肾小管上皮细胞出现纤维化样改变,见图3。

图3 细胞免疫荧光检测AA诱导大鼠NRK-52E细胞表达III型胶原情况
2.4 AA促进促纤维化因子TGF-β1 mRNA和蛋白的表达 ELISA法检测结果显示,5μg/mL和10μg/mL AA作用24 h后,TGF-β1的表达量较对照组明显升高(P<0.05);real-time RT-PCR结果也显示,10 μg/mL AA干预组中TGF-β1 mRNA的表达量较对照组明显升高(P<0.05)。见表1。

表1 各组间TGF-β1蛋白和mRNA以及Rac1蛋白表达量比较( ±s)
2.5 AA影响肾小管上皮细胞分泌Rac1蛋白 ELISA法检测结果显示,不同浓度AA作用NRK-52E细胞后,Rac1蛋白的表达均升高;细胞免疫荧光染色结果也显示AA促进了小管上皮细胞分泌Rac1蛋白,见表1和图4。
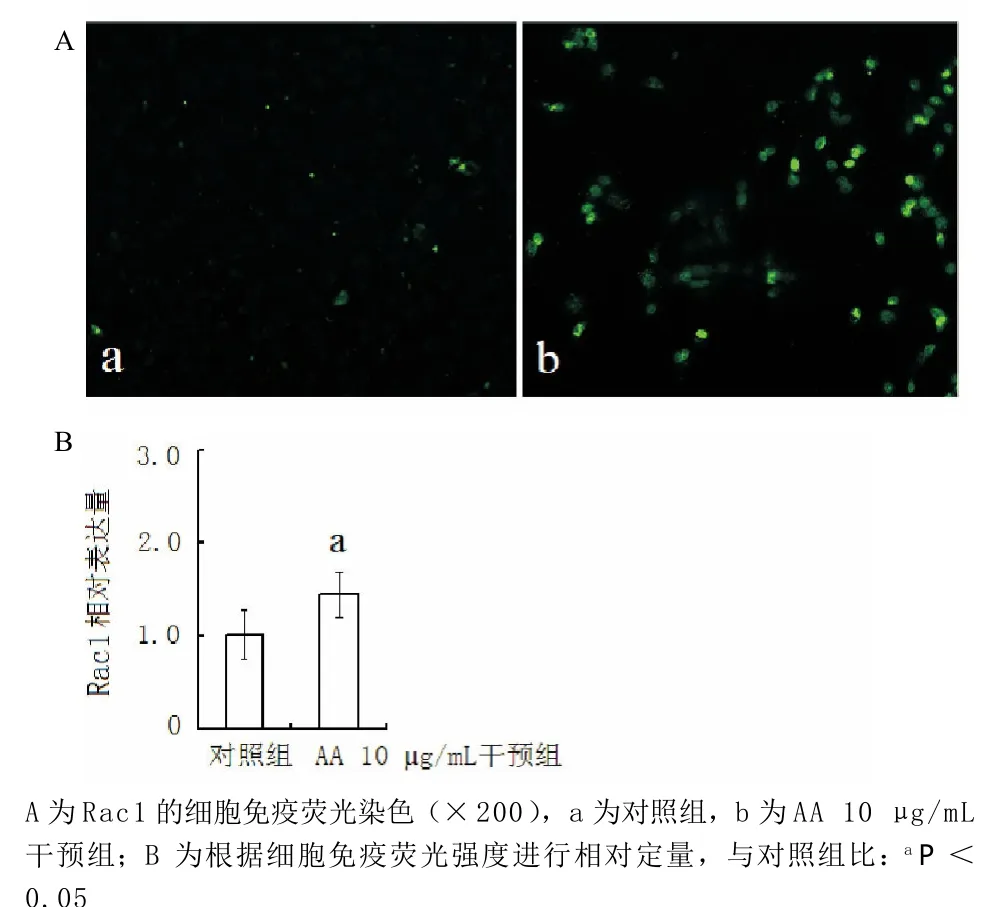
图4 Rac1在AA损伤肾小管上皮细胞过程中的表达改变
2.6 Rac1蛋白与TGF-β1的相关性分析 采用Pearson法分析上清液中Rac1和TGF-β1蛋白含量的相关性,结果发现,Rac1和TGF-β1含量存在明显正相关关系(r=0.967,P=0.007)。
3 讨论
AA是硝基菲类有机酸化合物,在中药马兜铃、广防己、关木通和中成药龙胆泻肝丸、当归四逆丸、大黄清胃丸等中均有检出。使用AA类药物能引起广泛的肾间质纤维化,进而引起急慢性肾功能衰竭,即马兜铃酸肾病。然而,目前对AA诱发肾间质纤维化机制的认识尚不清楚,大致涉及以下几方面[5]:胞质毒学说、肾缺血学说、细胞凋亡学说、肾小管上皮细胞转分化学说。我们的研究显示,AA作用于肾小管上皮细胞,可抑制细胞增殖,诱导细胞凋亡。可能的机制之一为AA导致DNA损伤和细胞周期阻滞于G2/M期,从而诱导细胞凋亡[6]。除了诱导肾小管上皮细胞凋亡外,我们还发现AA可促进III型胶原的表达,引起纤维化样改变。对于这种现象,Yang等[6]认为AA刺激JNK信号通路的活化,进而诱发TGF-β1的表达是主要因素。而我们的研究显示,AA损伤肾小管上皮细胞不仅表现为TGF-β1表达的上调,同时还伴有Rac1蛋白的高表达,提示Rac1蛋白很可能也是AA引起纤维化样改变的一个重要分子机制。
Rho蛋白为小分子鸟苷酸结合蛋白(又称小G蛋白),是Ras蛋白超家族成员。Rac蛋白是Rho家族小G蛋白的成员之一,有Rac1、Rac2、Rac3三种同工形式。Rac1和Rac3在体内广泛分布,而Rac2是一种造血细胞特异的小G蛋白[7]。TGF-β1是一种多功能细胞因子,可通过其蛋白激酶受体介导包括形态发生、胚胎发育、干细胞分化、炎症调节及伤口愈合在内的一系列生物过程,同时还能促进胶原累积,参与纤维化进程[2,8]。TGF-β1参与纤维化形成主要是与其受体结合,激活下游Smad复合体,调节相关基因的转录,即通过经典的Smad信号通路发挥作用[9]。除此之外,TGF-β1还可通过ERK-MAPK信号通路、GTPase Rho等发挥促纤维化功能[4,10]。Rac1作为GTPase Rho家族成员之一,也可能参与TGF-β1促肾纤维化的进程。已有研究表明,TGF-β1的高表达能活化Rac1介导的ERK通路,从而导致肾纤维化[10]。
但是,不同的Rho亚型在胶原累积过程中的作用可能不一样[11]。那么本研究中,Rac1蛋白在肾纤维化进程中到底发挥着怎样的作用?我们同时检测了Rac1蛋白和促纤维化因子TGF-β1的表达,并分析两者相关性。发现AA作用肾小管上皮细胞后,促纤维化因子TGF-β1和III型胶原表达明显增加,Rac1蛋白表达也增加,且与TGF-β1存在明显正相关关系,提示Rac1在AA所致肾间质纤维化中发挥正调控作用。可能的机制是AA损伤肾小管上皮细胞的情况下,Rac1及其介导的下游通路如ERK等,被TGF-β1表达和释放的增加所活化,进一步促进小管上皮细胞分泌表达胶原蛋白,出现纤维化反应。
综上所述,AA诱导胶原累积过程中,伴有Rac1蛋白的高表达,说明Rac1蛋白可能参与了纤维化过程。然而,Rac1蛋白及其相关信号通路在AA所致纤维化病变中的具体功能和定位,还需进一步的研究加以阐释。干预Rac1蛋白的表达可能成为AA致肾间质纤维化治疗的新途径。
[1] Chen D, Tang Z, Luo C, et al. Clinical and pathological spectrums of aristolochic acid nephropathy[J]. Clin Nephrol,2012, 78(1): 54-60.
[2]白永恒, 陆红, 周琴, 等. Sonic hedgehog信号通路在单侧输尿管梗大鼠肾组织中的表达变化及意义[J]. 中国病理生理杂志, 2012, 28(12): 2227-2232.
[3]白永恒, 洪炜龙, 刘彪, 等. Sonic hedgehog信号参与马兜铃酸损伤肾小管上皮细胞的体外实验研究[J]. 中华肾脏病杂志,2013, 29(4): 288-292.
[4] Mu Y, Gudey SK, Landström M. Non-Smad signaling path-ways[J]. Cell Tissue Res, 2012, 347(1): 11-20.
[5] 谢先德. 马兜铃酸致肾损害的特点及防治[J]. 中国药业, 2006,15(11): 55-56.
[6] Yang L, Besschetnova TY, Brooks CR, et al. Epithelial cell cycle arrest in G2/M mediates kidney fibrosis after injury[J].Nat Med, 2010, 16(5): 535-543.
[7] Takai Y, Sasaki T, Matozaki T. Small GTP-binding proteins[J]. Physiol Rev, 2001, 81(1): 153-208.
[8] Santibanez JF, Quintanilla M, Bernabeu C. TGF-β/TGF-β receptor system and its role in physiological and pathological conditions[J]. Clin Sci (Lond), 2011, 121(6): 233-251.[9] Lan HY, Chung AC. Transforming growth factor-βand Smads[J]. Contrib Nephrol, 2011, 170: 75-82.
[10] Hayashida T, Jones JC, Lee CK, et al. Loss of beta1-integrin enhances TGF-beta1-induced collagen expression in epithelial cells via increased alphavbeta3-integrin and Rac1 activity[J]. J Biol Chem, 2010, 285(40): 30741-30751.
[11]Hutchison N, Hendry BM, Sharpe CC. Rho isoforms have distinct and specific functions in the process of epithelial to mesenchymal transition in renal proximal tubular cells[J].Cell Signal, 2009, 21(10): 1522-1531.

