隆突性皮肤纤维肉瘤的影像学诊断价值
陈伟,陈裕,陈梅魁,何家维,付玉川,方必东,刘锟,严志汉
(温州医科大学附属第二医院 放射科,浙江 温州 325027)
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是一种起源于真皮可扩展至皮下组织少见的低度恶性软组织肿瘤,1924年由Darier和Ferrand首次报道,称为“进展和复发性的皮肤纤维瘤”,1925年由Hoffman命名为“DFSP”。DFSP的发病率约为1.8%[1],较易复发,且多次复发恶性程度会趋于增加[2],病灶常突出于皮肤表面,一般能较早发现并进行手术治疗,所以影像学报道相对较少。本研究回顾性分析我院2008年9月-2012年6月间收治的4例行影像学检查并经术后病理证实的DFSP影像学表现,报告如下。
1 临床资料
1.1 一般资料 本组4例DFSP中男3例,女1例,年龄18~69岁,中位年龄41岁。临床表现:2例表现为无痛性逐渐增大的肿块,活动可,分别位于右侧锁骨上窝皮下及小腿下段(见图1-2);1例位于右侧顶部皮下表现为肿块近期进行性增大,出现刺痛感,并有压痛(见图3);另1例位于小腿上段,呈圆形或类圆形,直径约2~5 cm,患者1年半前在基层医院做过肿块切除术,因病灶无肿痛,活动度可且无其他不适,由于临床医生意识淡薄加之基层医院条件有限术后未予病理检查,未做冰冻切片,亦未做相关治疗,今原手术部位又出现两个肿块,考虑术后复发(见图4a-e)。
1.2 检查设备及方法 主要设备包括Siemens公司500 mA摄片机,MR扫描采用荷兰Philips gyroscan intera1.5TMR扫描仪,常规使用SE序列横、矢状位行T1WI(TR 350~500 ms,TE 12~17 ms),FSE序列行矢状面T2WI(TR 2500~4500 ms,TE 75~120 ms)及STIR(脂肪抑制序列)(TR 2500 ms,TE 60 ms,TI 160 ms),矩阵(160~190)×(200~256),层厚3 mm,层间隔3 mm,CT平扫采用荷兰Philips Secura螺旋CT机,层厚和层距均为5 mm,扫描条件均为120 kV,110~140 mAs。
1.3 结果 肿瘤的影像学表现:2例患者行X线检查,均呈略高密度影,与周围软组织分界清晰,内部密度均匀;1例患者行CT检查,病灶呈软组织密度影,周围颅骨未见骨质破坏,边缘清晰,病灶中央未见液化坏死更低密度影;另1例术后复发患者病灶MRI表现为:病灶边缘清晰,内部信号均匀,在STIR序列呈明显高信号影(见图4a),在T1WI呈等低信号(见图4b),在T2WI呈稍高信号(见图4c),增强扫描病灶内部可见不规则强化(见图4d-e)。
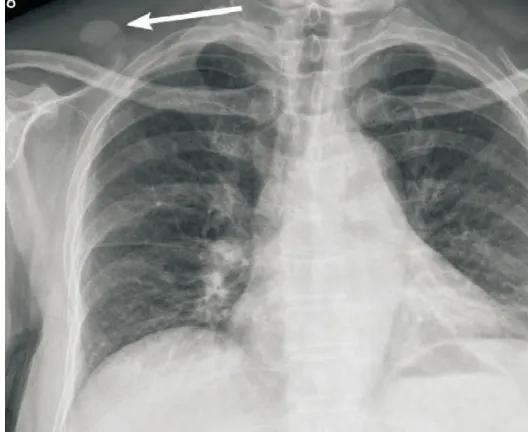
图1 患者女,69岁,DFSP,胸部正位片示右侧肩胛上窝一椭圆形略高密度影(箭头),边界清晰,内部密度均匀
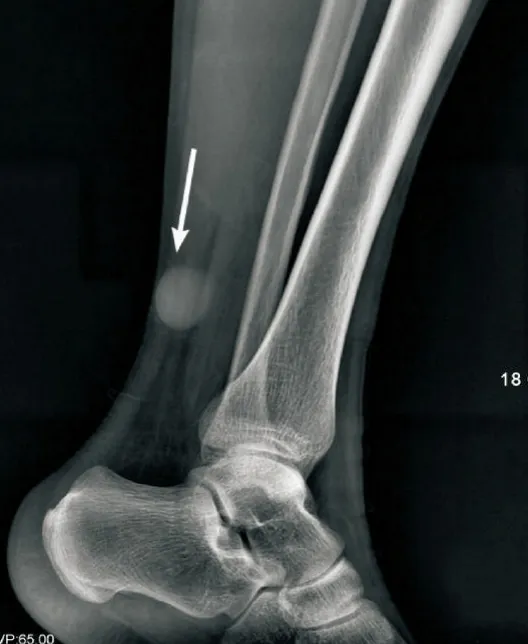
图2 患者男,41岁,DFSP,左侧小腿侧位片示左侧小腿远端后方皮下可见一椭圆形略高密度影(箭头),内部密度均匀,边缘尚清

图3 患者男,35岁,DFSP,头颅CT示右侧顶部头皮下方可见一椭圆形等密度影(箭头),边缘模糊,内部密度尚均匀

图4 患者男,18岁,DFSP,右侧小腿MR示右侧小腿后上方可见两椭圆形异常信号影
2 讨论
2.1 临床和病理特点 DFSP是源于成纤维细胞或组织细胞,起源于真皮缓慢生长的一种少见的低度恶性肿瘤,约占软组织肉瘤的6%[3]。WHO将其与巨细胞纤维母细胞瘤、丛状纤维组织细胞性肿瘤、非典型纤维黄色瘤及血管瘤样纤维组织细胞瘤归入中间型纤维组织细胞肿瘤中[4]。DFSP多见于成年人,20~50岁为发病高峰。本病生长缓慢,病程长,经过一段时间的休眠后迅速增大,形成较大的、不规则隆起的瘤结(隆突性由此得名)。DFSP几乎可发生于身体的任何部位,最常见的部位是躯干,其次是四肢近端,头颈部较少见,本组病例中2例位于四肢,1例位于头颈,1例位于躯干。DFSP多生长缓慢,其早期症状是出现单发的局限性硬固结节,表面呈红色、不易破溃,且可以移动,中晚期病灶会浸润至皮下脂肪、肌肉、筋膜或真皮等邻近组织,出现皮肤萎缩,色素沉着、破溃、蕈样肿块等症状。DFSP具有较高的局部复发率,但极少发生远处转移。
DFSP主要表现为隆起于皮肤表面的肿块,常呈暗红或淡紫色,与表皮紧密相连。肿瘤组织主要位于皮下脂肪组织内,无包膜,边界清楚,肿瘤大体切面多呈灰白色,质硬、细腻,呈类圆形或多个结节融合呈分叶状。镜下可见瘤组织位于真皮层,与表皮有一狭窄的无细胞区分隔,典型的形态为梭形细胞呈车辐状排列,中央区可见致密的胶原纤维束或内皮细胞肿胀的小血管,细胞大小形态较一致,异型性较轻,核分裂一般少见[5]。本组复发病例其肿瘤组织呈编织状排列,细胞长梭形,排列紧密,核分裂易见,>10个/10 HPF,肿瘤组织广泛浸润至皮下脂肪组织。DFSP病理分型以普通型(经典型)为主,同时还存在黏液型、色素型、纤维肉瘤型等亚型[6]。一般认为纤维肉瘤型DFSP恶性程度明显增加,临床医师需更加重视并予以积极治疗[7]。
2.2 DFSP的影像学特征表现 X线由于其密度分辨率低且易重叠,对于软组织肿瘤只能起定位作用,不能定性,本病在X线上表现(见图1-2)呈稍高密度影,边缘清晰。CT机扫描由于密度分辨率及空间分辨率高,可较清晰地显示肿瘤边界、范围、大小及部位,该肿瘤边界尚清晰,多呈结节状或分叶状,肿块在CT上表现为密度稍高于周围软组织密度影。MRI由于有较高的软组织分辨率,其对软组织肿瘤的诊断有很强的优势,但是由于受到价格、医院条件及患者配合等原因的限制,它还不是DFSP的常规诊断方法。因为此类肿瘤具有典型的临床表现和表面定位,且大部分肿块的活动度是好的,所以相对经验不足的临床医生通常易将其误诊为良性软组织肿瘤,而不对其进行MR检查。图4a-e就是1例术后复发患者的MRI图像,一年半前患者第一次做手术时病灶约为绿豆大小,其MRI表现为:在STIR序列病灶呈明显均匀的高信号;图4b为其病灶在T1WI呈等低信号;图4c为其病灶在T2WI呈稍高信号,图4d-e为注射Gd-DTPA后病灶内部呈不均匀强化,边缘尚清晰。
2.3 DFSP的影像鉴别诊断 DFSP的影像鉴别要点:①神经鞘瘤和神经纤维瘤。神经源性肿瘤多沿神经走向梭形生长,与周围神经关系密切,由于神经鞘瘤囊变多见,在T2WI呈明显高信号影,而DFSP在T2WI上呈等信号,增强扫描不均匀强化,神经纤维瘤MR增强扫描呈明显均匀强化表现。②脂肪瘤及脂肪肉瘤。X线表现为结节状低密度影,内部可见脂肪密度,肉瘤边缘不清,内部有液化坏死则呈液性低密度影,在T1WI及T2WI均呈高信号,STIR(脂肪抑制序列)可区分本病,DFSP在STIR序列呈明显高信号,而脂肪瘤及脂肪肉瘤在STIR序列上信号明显降低。③黑色素瘤。病变皮肤多呈蓝黑色,出血、囊变、坏死多见,由于黑色素瘤较易出血,故其X线表现多高于肌肉密度影,MRI易将其与DFSP进行鉴别,主要鉴别点为:黑色素瘤(含有顺磁性的黑色素细胞)在TIWI上呈高信号,在T2WI呈低信号,而DFSP在T1WI呈等低信号,在T2WI呈稍高信号。④血管瘤。在X线上呈低密度影,MRI在T1WI呈等或低信号影,在T2WI呈明显高信号,有些病灶内尚可见条状及斑点状的低信号影(钙化或静脉石),而这些影像表现与DFSP均不符,故也较易与其进行鉴别。
总之,由于在DFSP病灶较小时,临床即可发现并进行外科手术治疗,故有关本病的相关影像学检查资料特别是MRI表现较少见,但DFSP术前容易误诊,尤其是肿瘤位置较深,且向深部组织侵犯及表现不典型者。治疗方法不当极易复发,总的复发率可达50%[8],本组中就有1例(见图4a-e)由于第一次手术前临床医生对本病了解不足,至第二次复发术后经病理检查才诊断为DFSP,如第一次术前即对其进行MRI检查,且能作出正确诊断,则可以选择更加合理的治疗方法,而不必等到多次复发后造成手术和放射治疗的困难而影响治疗效果。另外由于本病随复发次数的增加而恶性程度会趋于增加,所以术前诊断的准确性就显的尤其重要,而加深了解本病的影像特点,特别是MRI影像表现,对本病进行术前准确诊断、选择正确的治疗方法及提高本病治愈率、减少复发率均具有重要意义。
[1] Chang CK, Jacobs IA, Salti GI. Outcomes of surgery for dermatofibrosarcoma protuberans[J]. Eur J Surg Oncol,2004, 30(3): 341-345.
[2] McArthur G. Dermatofibrosarcoma protuberans: recent clinical progress[J]. Ann Surg Oncol, 2007, 14(10): 2876-288.
[3] Kransdorf MJ, Meis- Kindblom JM. Dermatofibrosarcoma protuberans:radiologic appearance[J]. AJR, 1994, 163(2):391-394.
[4] 郭翠萍, 张雪林, 吕晓飞, 等. 隆突性皮肤纤维肉瘤的MRI表现[J]. 中国临床医学影像杂志, 2012, 23(2): 96-99.
[5] 朱忠尧, 陈路, 胡余昌. 隆突性皮肤纤维肉瘤42例临床病理分析[J]. 实用肿瘤学杂志, 2003, 17(1): 58-59.
[6] Sanmartin O, Llombart B, Lopez-Guererro JA, et al. Dermatofibrosarcoma protuberans[J]. Actas Dermosifiliogr,2007, 98(2): 77-87.
[7] SondakVK, CimminoVM, Lowe LM, et al. Dermatofibrosarcoma protuberans: what is the best surgical approach[J].Surg Oncol, 1999, 8(2): 183-189.
[8] RutgersEJ, KroonBB, Albus-Lutter, et al. Dermatofibrosarcomaprotuberans: treatment and prognosis[J]. Eur J Surg Oncol, 1992, 18(3): 241-248.

