糖尿病早期大鼠血清代谢轮廓的变化
朱环,管咪咪,郑涌泉,王娜,宋毅果,王亚强,邓明捷,高红昌
(温州医科大学 药学院代谢组学与医药核磁共振研究所,浙江 温州 325035)
糖尿病(diabetes mellitus,DM)主要分为1型和2型[1]。1型DM是由于胰岛素细胞被破坏而引起的[2]。链脲佐菌素(streptozocin,STZ)能够选择性破坏胰岛β细胞使血糖升高而出现临床DM患者的症状。目前虽有研究DM糖类代谢物变化的报道[3],但DM引起的整体代谢物的变化规律还不清楚。代谢组学是研究生物体内源性代谢物的整体及其受内在或外在因素影响而变化的科学[4],非常适合疾病的代谢轮廓和发病机制研究[5]。因此本研究通过大鼠STZ造模后,再利用基于核磁共振(NMR)的代谢组学方法分析血清的整体代谢特征,这可能为阐明1型DM潜在发病机制提供重要的线索。
1 材料和方法
1.1 实验动物 雄性SD大鼠购自上海斯莱克动物实验有限公司,8周龄,(150±15)g,饲养于温州医科大学实验动物中心SPF级动物房,从早上8:00开始12 h交替照明。所有大鼠适应性饲养1周再进行实验。实验期间大鼠自由饮水、进食。所有的操作程序严格遵守NIH的实验动物饲养和使用手册。
1.2 试剂与仪器 STZ购自Sigma-Aldrich公司;枸橼酸、枸橼酸钠、水合氯醛购于上海国药集团化学试剂有限公司;D2O(99.9%氘代)购于剑桥同位素实验室;纯水由Milli-Q超纯水系统(Millipore,Billerica,MA,USA)生产。Bruker AVANCE III 600 MHz核磁共振谱仪(Bruker BioSpin International AG);低温离心机5415R(eppendorf Inc,Germany)。
1.3 造模方法 实验动物分为对照组和DM组,DM组大鼠注射新鲜配制的STZ枸橼酸钠混悬溶液(70 mg/kg,腹腔注射),对照组大鼠给予同体积的枸橼酸钠混悬溶液(0.10 mol/L,pH 4.5)。给予STZ 3 d后测其血糖水平,选取血糖值大于16.70 mmol/L的大鼠作为DM大鼠。
1.4 血清样品的制备与1H NMR谱数据的获得 大鼠造模5周后禁食12 h,收集血液。将血液进行离心(3000 r/min,4 ℃,15 min),取上清液,保存于-80 ℃冰箱。NMR数据分析之前,血清样品解冻,取200μL血清中加入400μL磷酸缓冲液(0.2 mol/L Na2HPO4/0.2 mol/L NaH2PO4,pH 7.4)以降低pH值的变化,并加入60μL含3-甲基硅烷-2,2’,3,3’-d(4)丙酸钠(TSP)浓度为0.2 mmol/L的重水(D2O)用于锁场。在12000 g,10 min,4 ℃条件下,离心去除样品中的沉淀。取500μL上清液移入直径为5 mm的NMR样品管中。所有的1H NMR谱图均在Bruker AVANCE III 600 MHz超导高分辨核磁共振谱仪上进行检测,采样温度为25 ℃,1H的共振频率为600.13 MHz,配有三共振探头和Z轴的脉冲场梯度。血清样品一维自旋回波谱用CPMG序列来采谱D-[-90°-(τ-180-τ-)n-ACQ,总的自旋回波时间2 nτ为120 ms,用于减弱转动较慢的大分子信号,保留小分子和脂类分子的信号。64次累加和数据采集点为32 K,谱宽12000 Hz,弛豫延迟4 s;在进行傅立叶变换之前,采集的FID信号充零至64 K,并加窗函数0.3 Hz。所有的1H NMR谱图都进行了细致的相位校正和基线调整,并参考乳酸的甲基峰(CH3,δ1.33)来定标。
1.5 NMR波谱数据处理和模式分析 为了得到全部代谢物的信息,使用Bruker Topspin 2.1软件包对采集的1H NMR谱进行相位校正和基线调整,将1H NMR谱从δ10.0~0.4 ppm分别按0.01 ppm和0.0015 ppm为单位进行自动分段积分,为了消除饱和水峰时引起的谱线扭曲,将δ5.2~4.4 ppm区域设为0积分段。为补偿样品之间浓度的差异,对每一段积分值都相对于该谱的所有积分值进行归一化,然后将以0.01 ppm为区间归一化后得到的数据导入SIMCAP+12.0软件包(瑞典Umetrics公司),进行多元统计分析。偏最小二乘判别分析(partial least-squares discriminant analysis,PLS-DA)的所有的样品点都展示在第一和第二个主成分(PC1和PC2)为x、y坐标轴的二维空间中,该图中的每一个点都代表一个血清样品。
1.6 统计学处理方法 归一化后的积分值导入SPSS 13.0软件作统计学分析。两组样品间的比较采用独立样品的t检验。P<0.05为差异有统计学意义。
2 结果
2.1 造模结果 对照组生长发育良好,而DM组大鼠体质量明显下降;对照组大鼠精神状态良好,被毛洁白有光泽,DM组被毛粗糙发黄,黯淡无光泽;对照组大鼠的食量、饮水量、尿量与实验前相比无明显变化,而DM组大鼠明显出现多尿现象,并且饮水量和食量都明显增加,为保证其饮水量的充足,一天需要多次加水。造模成功后,每周我们都对大鼠的随机血糖进行检测,对照组大鼠血糖在正常范围内,波动少,而DM组大鼠的随机血糖均大于16.7 mmol/L,并且随着时间推移血糖日益升高。直至造模后第5周,剩余对照组大鼠数量n=7,DM组大鼠数量n=7。
2.2 血清1H NMR图谱的分析 图1是典型的对照组大鼠和DM大鼠血清的1H CPMG谱,图中标注的代谢物是通过结合文献[6]报道,chemx6.0软件以及我们已有的实验基础[5]完成的。我们检测了以下代谢物:甲酸(formate,δ8.45),苯丙氨酸(phenylalanine,δ7.37),酪氨酸(tyrosine,δ7.18),组氨酸(histidine,δ7.07),α-葡萄糖(α-glucose,δ5.23),β-葡萄糖(β-glucose,δ4.65),甘油(glycerol,δ3.68),甘氨酸(glycine,δ3.56),胆碱(choline,δ3.22),肌酸(creatine,δ3.03),天冬氨酸(aspartate,δ2.87),枸橼酸(citrate,δ2.53),谷氨酰胺(glutamine,δ2.44),N-乙酰糖蛋白(NAG,δ2.02),氧化三甲胺(TMAO,δ3.26),丙酮酸(pyruvate,δ2.37),3-羟基丁酸(3-HB) (3-hydroxybutyrate,δ2.30),乙酰乙酸(acetoacetate,δ2.28),丙酮(acetone,δ2.23),乙酸(acetate,δ1.91),丙氨酸(alanine,δ1.47),乳酸(lactate,δ1.33),缬氨酸(valine,δ1.03),异亮氨酸(isoleucine,δ1.00),亮氨酸(leucine,δ0.96),低密度脂蛋白/极低密度脂蛋白(LDL/VLDL,δ0.86)。
2.3 模式识别分析结果 如图2,我们从PLS-DA得分图上可以发现DM大鼠与对照组大鼠血清样品在第一主成分上能明显区分开(见图2A,R2=87.8%,Q2=78.4%),因此推测DM大鼠与对照组大鼠的代谢轮廓是不同的。从相对应的载荷图(见图2B)可以发现,葡萄糖、胆碱、肌酸、乳酸、3-HB、LDL/VLDL对两组的区分贡献较大。

图1 对照组大鼠(A)和DM大鼠(B) 血清典型的1H CPMG NMR谱
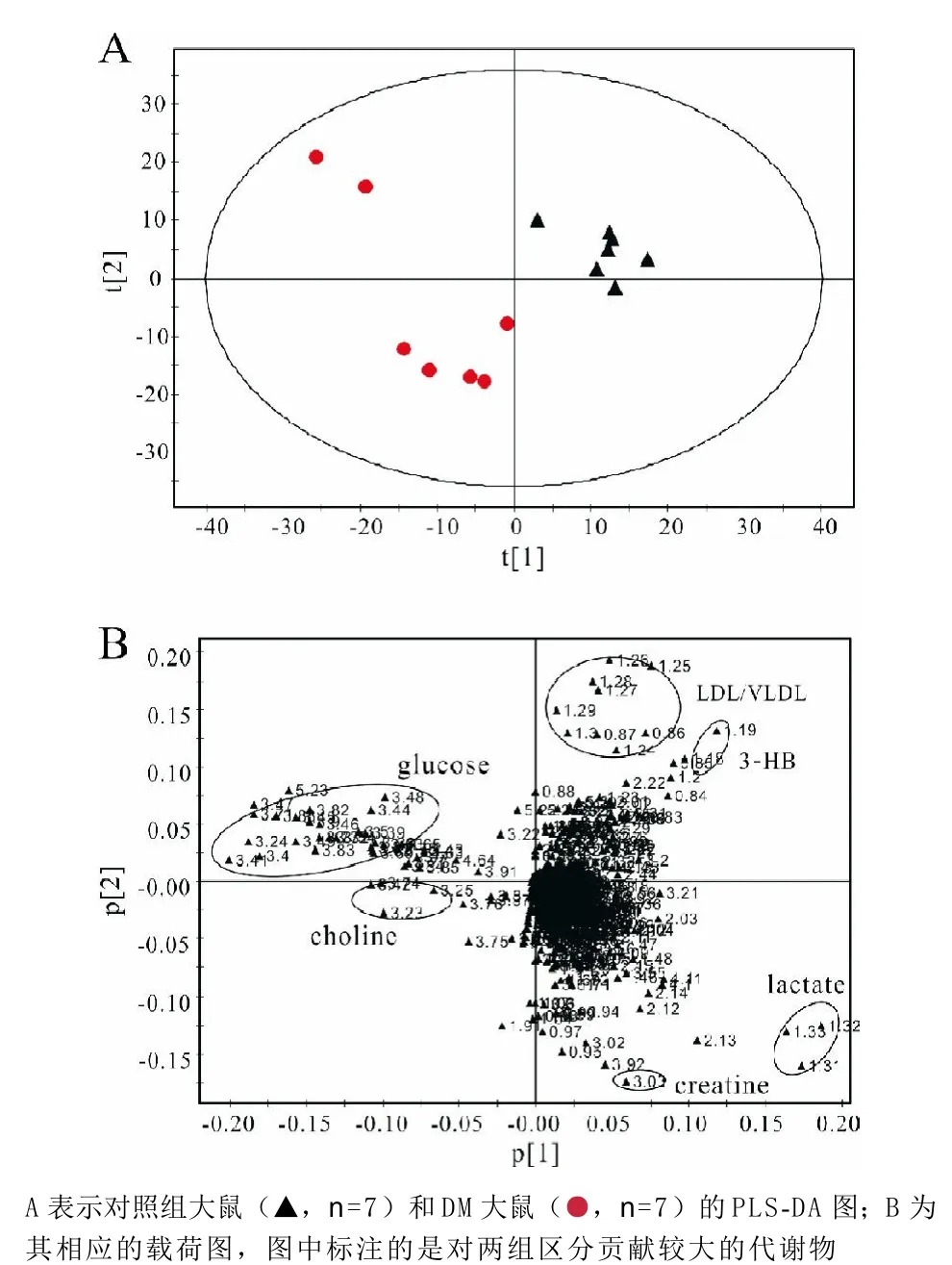
图2 模式识别分析结果
2.4 统计学分析结果 相比对照组大鼠,DM大鼠中β-葡萄糖和甘油水平显著升高(P<0.05,P<0.01);而酪氨酸、甘氨酸、胆碱、谷氨酰胺、丙酮酸、3-HB、乳酸、丙酮和LDL/VLDL显著降低(P<0.01或P<0.05),其他代谢物组间差异不存在统计学意义。详见表1。
3 讨论
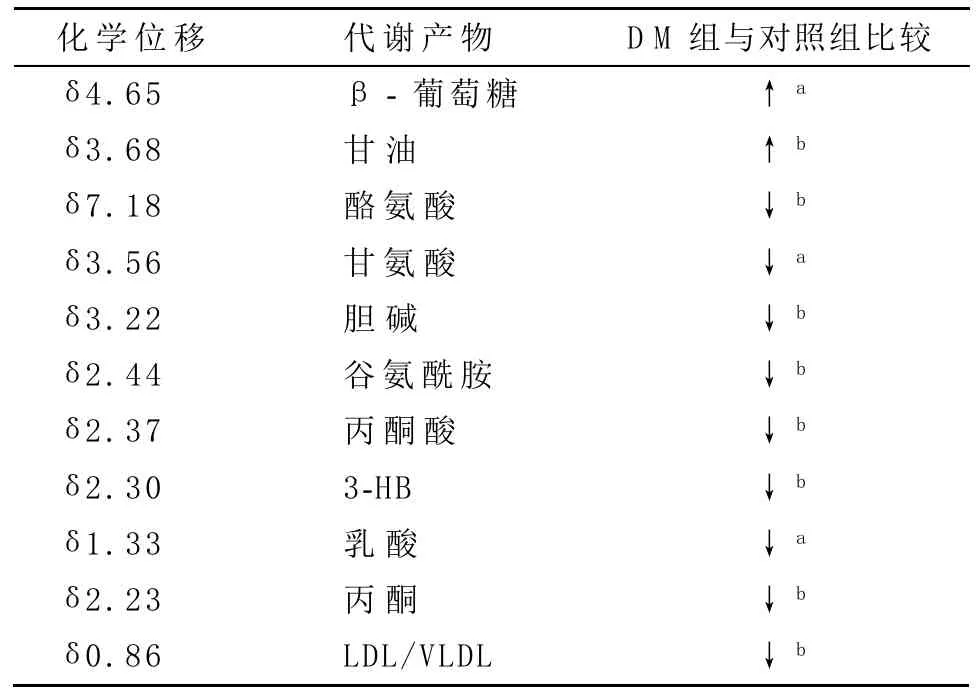
表1 对照组和DM组大鼠t检验统计学分析结果
DM的病理生理机制比较复杂,其疾病基础是糖代谢紊乱、血流动力学异常、胰岛素抵抗和炎性递质活化,但是关于其发病机制仍知之甚少。研究表明1型DM动物缺乏胰岛素,因而导致对葡萄糖摄取和利用不足[7]。在本研究中,与对照组大鼠相比,DM早期大鼠β-葡萄糖含量明显升高(血糖明显升高的重要原因),推测是由于机体对葡萄糖等营养物质的摄取利用不足所造成的,说明DM大鼠的糖代谢紊乱,符合DM的已知病因和诊断[8]。以上观点从3-HB的降低得以印证,当葡萄糖来源受限时,3-HB将被作为一种能源替代物[9],它能够作为能量物质以应对DM机体对葡萄糖利用的不足。此外,为了应对葡萄糖利用不足而导致的能量缺乏,乳酸会被氧化成丙酮酸而进入三羧酸循环(TCA),从而提供大量的能源,这可能就是DM大鼠乳酸显著性降低的原因之一。丙酮酸,作为重要的糖酵解产物,能被转化为乙酰辅酶A进而参与TCA。本研究中观察到DM大鼠丙酮酸显著性降低,反映出DM早期大鼠TCA程度会增强,从而导致丙酮酸的大量消耗,加速机体将蛋白质和脂肪转换为丙酮酸。能源物质利用的不足,加之TCA程度的增强而致机体能量大量流失,正是DM大鼠机体迅速消瘦的重要原因。
甘氨酸为体内非必需氨基酸,由葡萄糖转变而来,本研究中发现DM大鼠甘氨酸显著性降低,这可能正是机体对葡萄糖的利用不足所致。谷氨酰胺是人体含量最丰富的氨基酸,作为糖代谢和氨基酸代谢的重要中间体,谷氨酰胺能够减轻急性肾小管损伤[10]。因此,其浓度降低反映出DM早期机体能为减轻高血糖肾损伤而做出反应。含苯基的化合物主要是由肠道内的菌群代谢产生(如酪氨酸),主要是食物中的多酚和食物蛋白分解出来[11],酪氨酸的减少表明DM大鼠肠道内的菌群代谢发生紊乱。另外,DM大鼠在饮食、消化、吸收各方面受到影响,这可能也是各种氨基酸含量普遍降低的原因[12]。
胆碱是细胞膜的组成成分并参与脂类代谢[13]。DM大鼠胆碱的降低,可能由于DM发病过程中的炎症反应导致机体细胞再生受到抑制。甘油主要的产生器官是肝脏,巨噬细胞和血管平滑肌细胞能够将其吸收并清除[14],DM大鼠甘油的显著性降低,是由于体内产生大量的巨噬细胞对DM炎症做出的保护性反应。DM大鼠血清中LDL/VLDL含量减少,这提示DM肝细胞内正常的脂类代谢被破坏。然而也有文献报道LDL/VLDL含量在DM中是升高的[7],这可能是由于其检测的样品是尿液或者动物处于不同的DM时期所致。酮体包括丙酮、乙酰乙酸和3-HB,也是脂肪酸的代谢产物。实验中我们观察到DM大鼠丙酮和3-HB显著性降低,这与文献[15]报道的Zucker肥胖大鼠代谢结果一致。这些酮体浓度降低提示了DM导致的线粒体功能障碍会引起脂肪酸氧化作用紊乱。
本研究应用代谢组学方法展示了DM早期大鼠血清的代谢物变化,揭示了其糖代谢、氨基酸代谢以及脂类代谢发生紊乱的分子机制,这为进一步研究DM的代谢特征提供了线索。
[1] 张莹莹, 于捷, 周旋, 等. 复方降糖茶对STZ 诱导的糖尿病大鼠的治疗作用及其可能机制[J]. 温州医学院学报, 2011, 41(3): 224-227.
[2] Li Y, Hamasaki T, Teruya K, et al. Suppressive effects of natural reduced waters on alloxan-induced apoptosis and type 1 diabetes mellitus[J]. Cytotechnology, 2012, 64(3): 281-297.
[3] Zhang X, Wang Y, Hao F, et al. Human serum metabonomic analysis reveals progression axes for glucose intolerance and insulin resistance statuses[J]. J Proteome Res, 2009, 8(11): 5188-5195.
[4] 夏建飞, 梁琼麟, 胡坪, 等. 代谢组学研究策略与方法的新进展[J]. 分析化学, 2009, 37(1): 136-143.
[5] Gao H, Dong B, Liu X, et al. Metabonomic profiling of renal cell carcinoma: high-resolution proton nuclear magnetic resonance spectroscopy of human serum with multivariate data analysis[J]. Anal Chim Acta, 2008, 624(2): 269-277.
[6] Zhang H, Jia J, Cheng J, et al.1H NMR-based metabonomics study on serum of renal interstitial fibrosis rats induced by unilateral ureteral obstruction[J]. Mol Biosyst, 2012, 8(2):595-601.
[7] Zhao L, Gao H, Lian F, et al.1H-NMR-based metabonomic analysis of metabolic profiling in diabetic nephropathy rats induced by streptozotocin[J]. Am J Physiol Renal Physiol,2011, 300(4): 947-956.
[8] 孙永宁, 冯雯, 刘忠. 糖尿病肾阴虚证模型大鼠血液标本的代谢组学研究[J]. 山东中医药大学学报, 2010, 34(1): 80-82.
[9] Lei R, Wu C, Yang B, et al. Integrated metabolomic analysis of the nano-sized copper particle-induced hepatotoxicity and nephrotoxicity in rats: a rapid in vivo screening method for nanotoxicity[J]. Toxicol Appl Pharmacol, 2008, 232(2): 292-301.
[10]Hu YM, Pai MH, Yeh CL, et al. Glutamine administration ameliorates sepsis-induced kidney injury by downregulating the high-mobility group box protein-1-mediated pathway in mice[J]. Am J Physiol Renal Physiol, 2012, 302(1): 150-158.
[11]Nowak A, Libudzisz Z. Influence of phenol, p-cresol and indole on growth and survival of intestinal lactic acid bacteria[J]. Anaerobe, 2006, 12(2): 80-84.
[12] 尤丽, 巴吐尔·买买提明, 哈木拉提·吾甫尔. 基于核磁共振的肾虚痰瘀型2型糖尿病患者血清代谢组学研究[J].科技导报, 2012, 30(8): 25-29.
[13]Sun YJ, Wang HP, Liang YJ, et al. An NMR-based metabonomic investigation of the subacute effects of melamine in rats[J]. J Proteome Res, 2012, 11(4): 2544-2550.
[14]Kwan BC, Kronenberg F, Beddhu S, et al. Lipoprotein metabolism and lipid management in chronic kidney disease[J].J Am Soc Nephrol, 2007, 18(4): 1246-1261.
[15]Zhao X, Dey A, Romanko OP, et al. Decreased epoxygenase and increased epoxide hydrolase expression in the mesenteric artery of obese Zucker rats[J]. Am J Physiol Regul Integr Comp Physiol, 2005, 288(1): 188-196.

