大肠癌原代细胞培养方法的探索
袁航,屠世良
(浙江省人民医院 肛肠外科,浙江 杭州 310014)
由体内直接取出组织或细胞进行培养叫原代培养。原代培养细胞离体时间短,性状与体内相似,适用于肿瘤发生机制、抗肿瘤药物检测、癌分子生物学等研究。较之目前国内大肠癌细胞研究多采用细胞株的方式,原代培养更符合体内生理状态,其实验数据更具有说服力。但原代培养因成功率低,时间、试剂、人力成本高等原因,未能被广泛应用。本研究通过综合国内外大肠癌细胞原代培养方法的报道,对各种培养方法加以改进利用,寻求更优化更高效的原代培养方法,以期为大肠癌基础研究做准备工作。
1 材料和方法
1.1 实验标本 标本来自手术切除的未经放射治疗和抗肿瘤化学药物治疗的新鲜无菌人大肠癌组织。大肠癌诊断以肿瘤组织的病理学检查为依据。取材按肿瘤大体类型、肿瘤分化程度、取材位置分类。
按肿瘤大体类型:①肿块增生型:主要向肠腔内生长,呈球状或半球状;②溃疡浸润型:中央部坏死,形成大溃疡,边缘外翻呈蝶形,或癌组织沿肠壁浸润生长,有明显纤维组织反应。
按肿瘤分化程度:癌细胞排列呈腺管状或腺泡状,按Broder法分为高分化(I级)、中分化(II级)、低分化(III级)和未分化(IV级)癌。取材时按照I~II级、III~IV级进行分类。
按取材位置:①肿瘤中央;②肿瘤周边。按以上分类标准配对,即有8个取材方案。
1.2 试剂及仪器 RPMI 1640培养液(含100 U/mL青霉素、100 U/mL链霉素、10μg/mL胰岛素、生长激素100μg/L)、DMEM细胞培养基、Hanks洗液(含1000 U/mL青霉素、1000 U/mL链霉素、3μg/mL两性霉素)、胎牛血清、眼科剪、眼科镊、细胞计数板、自制鼠尾胶原铺制的培养瓶、CO2培养箱、倒置相差显微镜(Olympus)、超净工作台。
1.3 实验方法
1.3.1 不同取材标本对原代培养的影响:对培养条件采用正交设计进行研究[1]。如表1所示,按之前8个取材方案在2个不同标本中重复实验1次,进入表格内按不同方案培养,即组织块培养法+RPMI 1640培养基,组织块培养法+DMEM培养基,胶原酶消化法+RPMI 1640培养基,胶原酶消化法+DMEM培养基。注意取材部位非常重要,体积较大的肿瘤组织中有退变或坏死区,取材时尽量避开,要挑选活力较好的部位。予培养3、7 d观察培养基中细胞分布情况,以组织块周围细胞生长来判断原代细胞生长情况。

表1 采取正交设计的实验方案
1.3.2 不同培养方法对原代培养的影响:对手术切取的组织分别用组织块培养法和胶原酶消化法进行原代培养。①组织块培养法:将手术切除的肿瘤组织放入转移用RPMI 1640培养基(添加10倍常规抗生素的用量)中,尽快转移到实验室进行操作。在超净工作台上将癌组织取出,置于无菌平皿中,用无菌眼科剪、眼科镊去除坏死组织、脂肪组织和血凝块,选择肉眼观察瘤组织表面无溃烂的组织,将其置于15 mL离心管中,Hanks洗液冲洗去除红细胞及表面污物。使用无菌眼科剪镊将组织块剪成1 mm3小块,置于无菌塑料离心管中,用Hanks洗液重悬,吸弃上清,重复用RPMI 1640培养液重悬,清洗离心分离,吸弃上清,用滴管将小组织块均匀地排布在培养瓶底部,先将培养瓶底朝上放置,培养一段时间后将培养瓶正放,继续培养,以组织块周围有细胞生长为培养成功的标准。②胶原酶消化
法:将组织碎块移入15 mL玻璃离心管中,加入5~10 mL IV型胶原酶消化液,放入37 ℃水浴中,不断振荡,连续观察1 h,直至组织碎块弥散开为止,收集细胞悬液,将细胞悬液通过200目无菌的不锈钢筛网,移除大的细胞团块,已过筛网的液体转移入25 cm2预先铺好鼠尾胶原的培养瓶中,于培养箱中培养。
1.3.3 不同培养基对原代培养的影响:重复1.3.2步骤,不同的是将用RPMI 1640培养基(包括转移用RPMI 1640)处改用DMEM培养基(添加相同浓度胰岛素、生长激素),培养瓶瓶底均用鼠尾胶原包被。
1.3.4 不同纯化方法对原代培养的影响:对之前培养无污染且细胞绝对数量相对较多的标本进行纯化。成纤维细胞的混合生长是影响肿瘤细胞生长的主要原因,因此需要去除成纤维细胞。①胰酶消化法:此法利用细胞对胰酶消化敏感性的差异,达到细胞纯化的目的。国外许多学者的经验表明,当肿瘤组织块贴壁后,其癌细胞成片生长,形成集落,常常抑制了杂细胞的生长[2-3],但也存在少量的杂细胞。因此,我们暂不对贴壁的细胞进行纯化,当细胞培养至15~20 d后组织块(包括无活性的肿瘤细胞、破碎细胞和成纤维细胞等)自动脱落,弃去漂浮的组织块后对贴壁的细胞进行纯化。取出培养瓶,弃掉培养基,加入5 mL PBS冲洗后,吸除PBS。加1.5 mL 0.25%的胰酶,前后旋转培养瓶4~5次,使胰蛋白酶包被所有瓶内细胞,放入37 ℃细胞培养箱中2 min。取出培养瓶在倒置显微镜下观察,可见部分细胞首先变圆、脱落被消化下来,这时停止消化。这些首先被消化下来的细胞为成纤维细胞,吸除成纤维细胞及消化液。加入5 mL培养液,用吸管吹打细胞,收集细胞悬液。离心后弃上清。加入PBS洗涤细胞沉淀,再离心弃上清,再加入培养液继续培养。②机械刮除法:用不锈钢丝末端插橡胶刮头或裹少许脱脂棉制成,高压灭菌后备用。用不脱色笔在培养瓶皿的背面圈下生长肿瘤细胞的部位;弃掉培养液,把无菌胶刮伸入瓶皿中,肉眼或显微镜下,刮除无标记空间;再用Hanks液冲洗1~2次,洗除被刮掉的细胞;继续培养,如发现成纤维细胞残留,重复刮除至完全除掉为止。③反复贴壁法:根据肿瘤细胞比成纤维细胞贴壁速度慢的特点,并结合使用不加血清的营养液,把含有两类细胞的细胞悬液反复贴壁,使两类细胞分离,操作方法与传代相同,具体如下:待细胞生长达一定数量后,倒出旧培养液,用胰酶消化后,Hanks液冲洗2次,加入不含血清的培养液,吹打制成细胞悬液;取三个培养瓶编号为A、B、C;首先把悬液接种入A瓶中,置温箱中静止培养5~20 min后,轻轻倾斜培养瓶,让液体集中瓶角后慢慢吸出全部培养液,接种入B瓶后,向A瓶中补充少许完全培养液置温箱中继续培养;培养B瓶中培养细胞5~20 min后,按处理A瓶的方法,把培养液注入C瓶中,再向B瓶中补加完全培养基。三个培养瓶内均含有培养液,在温箱中继续培养。如操作成功,次日观察可见A瓶主要为成纤维细胞,B瓶两类细胞相杂,C瓶主要为癌细胞。必要时可反复处理多次,直至癌细胞纯化为止。
1.3.5 细胞成活率的检查:将培养不同时间的细胞于倒置显微镜下进行形态学观察,注意细胞的生长情况。必要时行细胞活力测定(采用台盼蓝染色法),确定群体细胞中存活的细胞数。
1.3.6 培养细胞的鉴定:取已处理的细胞爬片,蒸馏水冲洗,PBS浸泡,H2O2去离子水孵育,以消除内源性过氧化物酶活性;滴加适当比例稀释的一抗,4 ℃过夜;PBS冲洗。采用免疫细胞化学法标记癌胚抗原(carcino-embryonic antigen,CEA)、上皮细胞角质蛋白20(homo sapiens keration 20,CK 20)、外周血上皮膜抗原(epithelial membrane antigen,EMA)。
2 结果
2.1 不同取材标本对原代培养的影响 所有取材、转移、组织块处理、换液等操作均由同一位具有丰富细胞培养经验的实验员操作。
2.1.1 肿瘤大体类型:肿块增生型、溃疡浸润型各32例。结果发现肿块增生型肿瘤组织厚实,取材范围大,难度相对较小,污染率低。溃疡浸润型肿块易污染。肿块增生型前3 d内8例未污染,但7 d后2例换细胞液时发生污染,4例发现杂细胞优势生长,肿瘤细胞数量极少,2例培养出肿瘤细胞并顺利传代。溃疡浸润型培养大部分污染,3例起初(7 d内)未污染但14 d后换液传代时污染2例,1例发现杂菌优势生长。
2.1.2 肿瘤分化程度:I~II级和III~IV级各32例,各有5例和6例未污染。低分化级别短期生长可表现出明显活力,细胞数稍多于中分化,但从长期生长结果来看未发现细胞数可明显增多。2例培养出肿瘤细胞并顺利传代,1例分化为II级,1例分化为III级。
2.1.3 取材位置:肿瘤中央取材和肿瘤周边取材各32例。结果发现,肿瘤中央取材肿瘤细胞容易取得坏死物而培养失败,但如取得肿块深部组织则细胞活力好,2例培养出满意细胞均为肿块增生型中央深部取材获得。
2.2 不同培养方法对原代培养的影响 组织块培养法进行肿瘤细胞培养,细胞一般2~3 d后从组织块周围爬出,见图1。倒置显微镜下形态学观察,组织块边缘可见有细胞游出,继续培养待组织块脱落纯化后,可见肿瘤细胞生长,细胞呈不规则形、多角形。2例培养成功的细胞均采用组织块培养法。胶原酶消化法培养的细胞,仅有少量细胞贴壁,继续培养一段时间,细胞数目不理想。
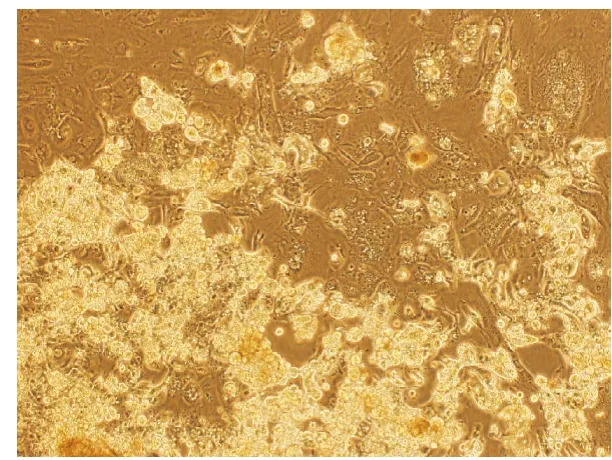
图1 组织块培养法培养20 d可见肿瘤细胞游出
2.3 不同培养基对原代培养的影响 我们对培养3、7 d的组织块进行了观察,发现用RPMI 1640培养基培养的组织块,细胞游出。而用DMEM培养基培养的组织块,组织块周边发现极少量细胞游出生长,后继续培养未能继续生长。
2.4 不同细胞纯化方法对原代培养的影响 使用机械刮除法和反复贴壁法纯化细胞时,成纤维细胞清除效果不好,继续培养后发现培养瓶中成纤维细胞又可大量生长,再培养一段时间,瓶底满是成纤维细胞,观察不到肿瘤细胞的生长。而胰酶消化法纯化细胞能收到较好的效果,鉴定后的肿瘤细胞密度相对较高。见图2。
2.5 培养细胞的鉴定 通过免疫细胞化学法检测CEA、CK 20、EMA,证明培养细胞为上皮组织来源。见图3-5。

图2 35 d后胰酶消化法纯化肿瘤细胞

图3 CEA染色结果(×400)

图4 CK 20染色结果(×400)

图5 EMA染色结果(×400)
3 讨论
通过大肠癌原代培养获得的肿瘤细胞是理想的研究大肠癌肿瘤发生、发展机制的载体。但原代培养程序复杂,无菌要求严格,细胞生长受到培养基、操作方法、器械消毒、培养环境的无菌条件等诸多因素影响。缺乏经验的实验员进行细胞培养时往往会出现细胞污染率高的情况,而有经验的实验员往往困扰于细胞的生长活力及纯化提取等阶段,这其中每一阶段都决定着最终实验的成败。
3.1 强化无菌操作 无菌操作体现在每一步细微操作中,包括玻璃瓶、培养皿、试管、移液器等的清洗、消毒、保存,培养液的配置,双抗等试剂的添加等,任何环节出现纰漏均会使实验带菌,导致培养失败,而大肠癌新鲜标本又只能做到相对无菌,因此培养基中加入有效抗生素可有效防止污染[4-6]。本实验中,RPMI 1640培养液含青霉素和链霉素,DMEM细胞培养基、Hanks洗液含青霉素、链霉素和两性霉素。且从本实验结果看,肿块增生型肿瘤组织的取材污染率相对较低,我们推测是因为肿块取材余地大,更容易取得深部、中央部肿瘤组织,所以可以尽量避免接触肠道细菌导致的污染。
3.2 病理取材的规范化 无污染、足够细胞量是进行细胞培养的基本条件。切取标本应避免切取脂肪组织及坏死组织,应挑选癌细胞集中和细胞活力较好的部位。取材后应尽快送检,不能立即送检的标本,可将组织块先放入细胞培养液中,置于冰浴或0~4 ℃冰箱中,以免肿瘤细胞发生自溶或凋亡。中央部取材肿瘤细胞容易取得坏死物而致培养失败,但如取得肿块深部组织则细胞活力好。本研究2例培养出满意细胞均为肿块增生型中央深部取材获得。分化差的肿瘤细胞理论上活力应相对较好,而在实践中,低分化肿瘤细胞短期生长可表现出明显活力,细胞数稍多于中分化,但从长期生长结果来看未发现细胞数明显增多,这可能与离体后细胞环境改变或营养供给不足等有关。
3.3 细胞培养方法 目前培养细胞的获取来源有多种,国外有报道[7]称移植瘤培养细胞系成功率高于从患者体内取得肿瘤细胞的培养方法。培养方法也有多种,国内常用的有组织块培养法[8]和胶原酶消化法[6]。我们的实验结果显示组织块培养法相对容易获得成功。组织块大小适中,换液前静置,不要让组织块滑落漂浮,待组织块贴壁稳定后再补加液体比较重要。培养液最好用营养较高的胎牛血清,浓度高些,加入胰岛素或生长激素等促细胞生长因子。
RPMI 1640与DMEM培养基是细胞培养中常用的培养基,孰优孰劣并无定论。本实验对培养3、7 d的组织块进行了观察,发现用RPMI 1640培养基培养的组织块,细胞游出,而用DMEM培养基培养的组织块,周边发现极少量细胞游出生长,后继续培养未能继续生长。查阅文献[9]发现HCT116、lovo、SW480和colo205等结肠癌细胞系均使用了RPMI 1640培养基。另外,培养瓶中以生长基质包被给肿瘤细胞一定的生长依赖,可以促使其更好地爬出组织块,鼠尾胶原是不错的选择。
3.4 细胞的纯化方法 原代培养非常容易受到成纤维细胞的污染,需及时清除。本实验采用胰酶消化法进行细胞的纯化,利用了不同细胞对胰酶的敏感性不同,成纤维细胞首先被消化下来,从而达到纯化的目的,鉴定后的肿瘤细胞密度相对较高。与其他细胞纯化方法相比,使用胰酶消化法花费少,实验过程操作简单。这可能是目前多数细胞培养实验选择胰酶消化法的原因。
综上,肿瘤细胞的原代培养是非常细致和有难度的基础工作,本实验通过不同方法培育出2例细胞数满意的大肠癌细胞,并对实验结果进行了初步的分析,为继续进行细胞培养实验积累了有益的经验。
[1] 张怀勤, 季亢挺, 杨德业. 内皮祖细胞培养条件的正交设计研究[J]. 温州医学院学报, 2005, 35(4): 261-264.
[2] Oh JH, Ku JL, Yoon KA, et al. Establishment and characterization of colorectal-carcinoma cell lines[J]. Int J Cancer,1999, 81(7): 902.
[3] Takeda A, Maeda M, Iseki H, et al. Establishment and characterization of the human SaTM-1 anal canal squamous cell carcinoma cell line derived from lymph node metastasis[J].Int J Mol Med, 2009, 24(4): 465-472.
[4] Vierck JL, Byrne K, Mir PS, et al. Ten commandments for preventing contamination of primary cell cultures[J]. Methods Cell Sci, 2000, 22(1): 33-41.
[5] Ku JL, Shin YK, Kim DW, et al. Establishment and characterization of 13 human colorectal carcinoma cell lines:mutations of genes and expressions of drug-sensitivity genes and cancer stem cell markers[J]. Carcinogenesis, 2010, 31(6):1006-1009.
[6] Failli A, Consolini R, Legitimo A, et al. The challenge of culturing human colorectal tumor cells: establishment of a cell culture model by the comparison of different methodological approaches[J]. Tumori, 2009, 95(3): 343-347.
[7] Virginie DM, Marc P, Sophie R, et al. Establishment of human colon cancer cell lines from fresh tumors versus xenografts: comparison of success rate and cell line features[J]. Cancer Res, 2007, 67(1): 398-407.
[8] 吴海亚, 戴元荣, 尹娟. 改良组织贴块法培养大鼠气道平滑肌细胞[J]. 温州医学院学报, 2010, 40(6): 571-573.
[9] Wang XY, Lai ZS, Yeung CM, et al. Establishment and characterization of a new cell line derived from human colorectal laterally spreading tumor[J]. World J Gastroenterol, 2008,14(8): 1204-1211.

