溶血磷脂酸上调ROS水平诱导HeLa-S3细胞迁移及相关机制的探讨
姚慕崑,刘 玮,任萍萍,吴希美
(1.浙江省立同德医院,浙江 杭 州 310012;2.浙江大学医学院临床一系浙江,3.浙江大学医学院药理学系,杭州 310058)
溶血磷脂酸(lysophosphatidic acid,LPA)在某些肿瘤的转移中具有一定的作用[1],如LPA与其受体可促进乳腺癌向骨的转移[2],同时其抑制剂可有效的逆转肿瘤细胞的迁移[3],但目前对LPA促进肿瘤转移的机制还不清楚,因此本文采用LPA处理He-La-S3人宫颈癌细胞,观察其对HeLa-S3细胞的迁移能力以及胞内ROS水平的影响,并进行相关机制的探讨。
1 材料与方法
1.1 试剂 HeLa S3人宫颈癌细胞(美国ATCC);二甲亚砜(DMSO)、AMD3100、溶血磷脂酸、牛血清白蛋白(BSA)、TritonX-100、LY294002、NAC(美国Sigma公司);HeLa S3专用培养基(美国biohermes公司);胰蛋白酶(美国Gibco公司);GAPDH、辣根过氧化物酶(HRP)标记鼠二抗、兔二抗单克隆抗体(美国 SANTA CRUZ公司);Akt(lot 9272)、P-Akt(Ser473,lot 9271)、PAK1(lot 2602)、P-PAK1(Thr423,lot 2601)多克隆抗体(美国 Cell Sigaling Technology公司)。
1.2 细胞传代培养 将HeLa S3细胞接种于60 ml的细胞培养瓶中,用HeLa S3专用培养基进行培养。培养2~3 d后,待细胞生长为致密单层时,移除培养基,用PBS清洗细胞3次,并采用0.25%胰蛋白酶(37℃预热)消化细胞1 min,至倒置显微镜观察成圆形时,加入少量含血清的HeLa S3专用培养基终止整个消化过程,室温下离心(1 500 r·min-1×5 min),弃上清,收集细胞沉淀。并向沉淀中加入专用培养基,按照5×108·L-1的密度将HeLa S3细胞接种到培养瓶中,置于37℃、5%CO2细胞培养箱中进行培养。
1.3 细胞迁移实验 收集对数期的HeLa S3细胞,经胰酶消化处理后,以5×105的细胞密度接种到96孔培养板中,使用专用培养基培养24 h(含血清),使用移液器吸头沿培养板底部作简单“一”字形1 mm宽的人工划痕,并采用倒置显微镜观察并拍摄划痕边缘区域及相对距离;对细胞进行药物处理12 h后,并通过比较处理前后划痕边缘相对距离的差值来测定迁移能力。
1.4 ROS荧光检测 将高压灭菌处理过的盖玻片(22 mm×22 mm)置于6孔培养板底部,将HeLa S3细胞以3×108cells·L-1的密度接种到含专用培养基的6孔培养板中,置于37℃细胞培养箱进行常规培养;观察并当细胞完全展开贴壁后,改为无血清处理24 h;给予20 μmol·L-1的 LPA 处理不同的时间段,并与无血清培养基稀释好的CM-H2DCFDA(5 μmol·L-1),在细胞培养箱中孵育(37℃×30 min);整个孵育过程需避光并采用PBS清洗和4%多聚甲醛固定(1 h),放置荧光显微镜下观察。确定LPA的最强刺激时间 A,然后采用200 μmol·L-1NAC预处理1 h,LPA处理时间A,并重复以上步骤。
1.5 全蛋白提取 将细胞用预冷PBS清洗细胞2次,吸干后加预冷全蛋白提取缓冲液0.5 ml,冰上裂解细胞15 min;采用细胞刮刀刮取细胞后并多次吹打细胞使其悬浮,并将细胞悬液转移至EP管中,冰上振荡处理15 min;在4℃离心(12 000 r·min-1×20 min),取上清,并采用BCA法测定蛋白浓度,-70℃保存备用。
1.6 Western blot实验 将上步提取的蛋白样品按照一定的比例与加样缓冲液混合,加热(100℃×5 min)后离心3 min,取上清加样后进行蛋白电泳;采用10%SDS-PAGE进行电泳,浓缩胶和分离胶的电压分别为80 mV和100 mV;采用半干转法进行转膜(20 V);采用5%脱脂蛋白封闭,Blot缓冲液洗膜(5 min×3次);加入一抗孵育(1 ∶300),Blot缓冲液洗膜后,在加入二抗(1∶3 000),同样也采用Blot缓冲液洗膜,采用ECL法来显色处理,胶片曝光后观察蛋白的条带。然后将膜上洗脱,重复上述步骤,进行GAPDH蛋白的条带显影,并采用Gel-Pro analyzer进行各显影条带的光密度分析。
1.7 统计学处理 采用SPSS 16.0软件进行统计学分析,且所有数据均以±s的形式表示,采用成组t检验分析两组之间的差异,采用单因素方差分析(one way ANOVA)进行多组之间比较。
2 结果
2.1 LPA刺激对HeLa-S3细胞迁移和ROS的影响 分别给予细胞为期15、30、60、75、120 min的20 μmol·L-1LPA刺激发现,LPA可促进 HeLa-S3细胞ROS的合成,且差异具有统计学意义,见Fig 1。在给予200 μmol·L-1NAC(ROS 生成抑制剂)预处理60 min后,发现LPA促进胞内ROS生成被抑制,同时细胞的迁移能力减弱,与LPA单纯处理差异有统计学意义(P<0.05),见 Fig 2、3。
2.2 LPA刺激对Akt磷酸化的影响 LPA刺激后,Akt的Ser473磷酸化位点被持续的激活,在15 min 达到峰值,P-Akt(Ser473)/Akt在 5、15、30、60 min差异均有显著性(P<0.05);Akt蛋白总量在各时间点的表达无显著性差异(P>0.05)(Fig 4),各组蛋白条带的灰度值见Tab 1。
2.3 LPA刺激对PAK1磷酸化的影响 LPA刺激后,P-PAK1(Thr423)/PAK1水平升高,且与对照组差异有显著性(P<0.05);且采用LY294002(PI3K抑制剂)预处理(15 min)可抑制P-PAK1(Thr423)/PAK1 的上调(Fig 5,Tab 2)。
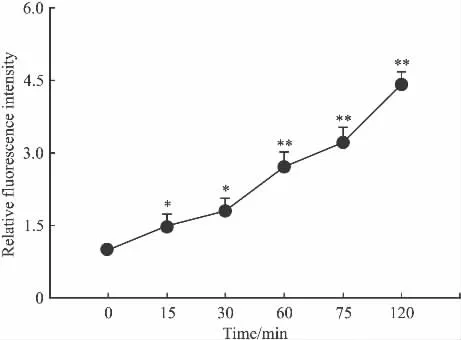
Fig 1 Intracellular ROS level of different time points treated by LPA
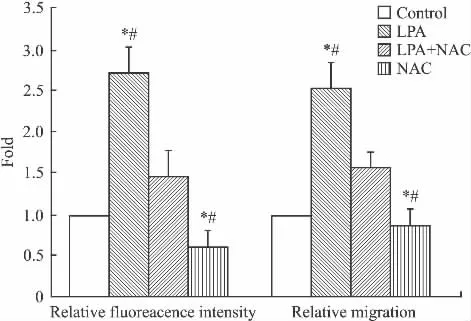
Fig 2 Influence on intracellular ROS level andmigration ability of pretreatment with NAC
2.4 LY294002预处理对LPA诱导细胞迁移的影响 单独使用LPA可增加HeLa-S3细胞的迁移,而LY294002预处理可抑制LPA诱导细胞迁移的作用,且单独使用LY294002预处理(15 min)可降低细胞的迁移(Fig 5)。
3 讨论
研究表明,LPA可通过多种途径来促进肿瘤的发生与侵袭[4-5],常见的方式:(1)抑制肿瘤细胞凋亡,促进原位增殖,如研究发现LPA可抑制癌细胞Caspases的活性[6],加速 p53 的凋亡[7]以及上调Bcl-1的表达[8],造成原癌基因在同抑癌基因的对抗中占优势;(2)通过提供肿瘤生长所需的营养物质来促进肿瘤血管的生成[9];(3)提高肿瘤的迁移能力等[10];肿瘤高侵袭能力是导致肿瘤手术切除效果不理想,生存率低的首要因素,因此需要对肿瘤迁移的相关机制进行研究。
本研究发现LPA刺激可促进宫颈癌HeLa-S3细胞的迁移,在20μmol·L-1的LPA处理下发现细胞内的ROS生成增高,在采用抗氧化剂NAC处理后,发现LPA上调胞内ROS生成的作用减弱,以上这些结果表明LPA能诱导细胞内ROS的产生。很多研究表明ROS在癌细胞的增殖以及由EGF诱导的癌细胞迁移中均有重要的作用[11],这与本研究的结果一致,提示LPA可能通过促进ROS的生成来促进HeLa-S3细胞的迁移,采用NAC预处理后,发现LPA促进HeLa-S3细胞的迁移的能力受到抑制,这与前面的推断一致,因此认为LPA促进HeLa-S3细胞的迁移是通过ROS来发挥作用的。

Fig 3 Original pictures of intracellular ROS and cell migration in different treatment

Tab 1 Optical density of Akt protein on different time points treated by LPA
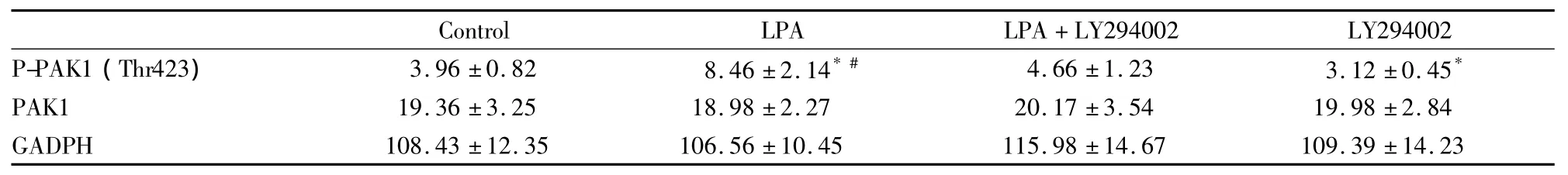
Tab 2 Optical density of PAK1 protein in four groups

Fig 4 Influence on phosphorylation of Akt on different time points treated with LPA
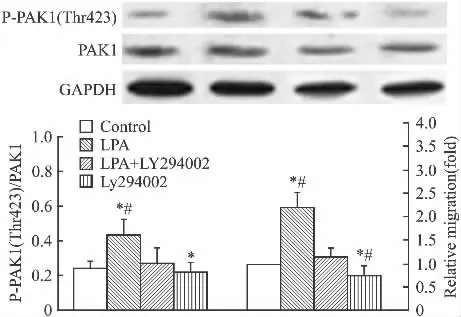
Fig 5 Influence on P-PAK1/PAK1 level and migration ability of pretreatment with LY294002
以往的研究表明[12],大多数的肿瘤细胞PI3K/Akt/PAK1是激活的,而且在肿瘤细胞的迁移中发挥着重要的作用。本研究发现在LPA预处理后,Akt呈时间依赖性激活,且在5 min~60 min被明显激活,而通过对其下游的PAK1研究表明,其水平也被明显的激活,而给予PI3K的抑制剂LY294002处理后,PAK1(Thr423)磷酸化水平降低,活性受到抑制,因此推测LPA可能通过激活PI3K/Akt/PAK1信号通路来促进细胞的迁移,而采用LY294002将此信号通路的上游PI3K抑制后,发现肿瘤细胞的迁移能力遭到抑制。因此认为PI3K/Akt/PAK1信号通路在LPA上调ROS水平诱导HeLa-S3细胞的迁移上具有重要的作用。
综上所述,LPA通过上调ROS来促进HeLa-S3细胞的迁移,且可能的机制是激活PI3K/Akt/PAK1信号通路,为肿瘤细胞的迁移和治疗提供新的思路和靶点。
[1]Ye X .lysophospholipid signaling in the function and pathology of the reproductive system[J].Hum Reprod Update,2008,14(5):519-36.
[2]Du J,Sun C,Hu Z,et al.Lysophosphatidic acid induces MDAMB-231 breast cancer cells migration through activation of PI3K/PAK1/ERK signaling[J].PLoS One,2010,5(12):e15940.
[3]Goldsmith Z G,Ha J H,Jayaraman M,et al.Lysophosphatidic acid stimulates the proliferation of ovarian cancer cells via the gep protooncogene Gα[J].Genes Cancer,2011,2(5):563-75.
[4]Liu Z G,Yu Z C,Yu Y P,et al.Lysophosphatidic acid level and the incidence of silent brain infarction in patients with nonvalvular atrial fibrillation[J].Int J Mol Sci,2010,11(10):3988-98.
[5]Murph M M,Hurst-Kennedy J,Newton V,et al.Lysophosphatidic acid decreases the nuclear localization and cellular abundance of the p53 tumor suppressor in A549 lung carcinoma cells[J].Mol Cancer Res,2007,5(11):1201-11.
[6]Saunders J A,Rogers L C,Klomsiri C,et al.Reactive oxygen species mediate lysophosphatidic acid induced signaling in ovarian cancer cells[J].Free Radic Biol Med,2010,49(12):2058-67.
[7]Zhang R,Wang J,Ma S,et al.Requirement of Osteopontin in the migration and protection against Taxol-induced apoptosis via the ATX-LPA axis in SGC7901 cells[J].BMC Cell Biol,2011,12:11.
[8]Rivera-Lopez C M,Tucker A,Lynch K R.Lysophosphatidic Acid(LPA)and angiogenesis[J].Angiogenesis,2008,11(3):301-10.
[9]Ozak M,Haga S,Zhang H Q,et al.Inhibition of hypoxia/reoxygenation-induced oxidative stress in HGF-stimulated antiapoptotic signaling:role of PI3-K and Akt kinase upon Rac1[J].Cell Death Differ,2003,10(5):508-15.
[10]张亚宏,甘 莹,郭子华.紫草素通过ROS/p38信号通路诱导人宫颈癌HeLa细胞凋亡[J].中国药理学通报,2011,27(6):864-7.
[10]Zhang Y H,Gan Y,Guo Z H.Involvement of ROS/p38 signal pathway in shikonin-induced apoptosis in HeLa cells[J].Chin Pharmocol Bull,2011,27(6):864-7.
[11]Huo Y N,Qiu W Y,Pan Q,et al.Reactive oxygen species(ROS)are essential mediators in epidermal growth factor(EGF)-stimulated corneal epithelial cell proliferation,adhesion,migration,and wound healing[J].Experimental Eye Res,2009,89(6):876-86.
[12]Osaki M,Oshimura M,Ito H.PI3K-Akt pathway:Its functions and alterations in human cancer[J].Apoptosis,2004,9(6):667-76.

