卡立泊来德对K562细胞诱导的血管生成的影响
高 伟,马 丽,张洪菊,张玉娟,常国强,王 建,李华文,庞天翔
(中国医学科学院、北京协和医学院、血液学研究所、血液病医院,实验血液学国家重点实验室,天津 300020)
血管生成不仅在实体肿瘤中,而且在血液恶性肿瘤中发挥非常重要的作用[1]。在急性髓系白血病和急性淋系白血病骨髓标本中可以观察到明显的血管密度增加[2-3]。血管生成是受正性和负性调节因子共同调节的,通过这两类因子的相互平衡来维持正常的血管生成[4]。当这种平衡被破坏,促血管生成因子占主导时便发生病理性血管新生从而促进肿瘤的发生。血管内皮生长因子(VEGF)是最常见的强力促血管生成因子,在肿瘤血管新生中发挥重要的作用。钠氢交换蛋白1(NHE1)是一种在哺乳动物中广泛表达的膜蛋白,其主要功能是调节细胞内的pH值(pHi)。越来越多的实验表明钠氢交换蛋白蛋白1在肿瘤的发生发展过程中发挥至关重要的作用[5-8]。其新的抑制剂 cariporide具有更高的特异性和相对较小的毒副作用,已经被加拿大和美国用于治疗心肌缺血/再灌注损伤[9]。本研究通过观察cariporide处理后K562上清液对脐静脉内皮细胞增殖、迁移以及成管能力的影响,探讨其在K562细胞诱导血管生成方面的作用及可能机制。
1 材料与方法
1.1 药品与试剂 K562细胞由本实验室保存;RPMI 1640培养液为 Gibco公司产品;胎牛血清和M199培养基为Hyclone公司产品;cariporide购自Sigma公司;Transwell小室购自Millipore公司;Matrigel(生长因子减少型)购自BD公司;双羧乙基碳氧荧光素四乙酰氧甲酯(BCECF-AM)荧光染料和尼日利亚菌素(Nigericin)均购于Calbiochem公司;人VEGF酶联免疫吸附法(ELISA)试剂盒购自R&D公司。
1.2 仪器 Forma 371型恒温培养箱为Thermo公司产品;CK型倒置光学显微镜为日本Nikon公司产品;激光扫描共焦显微镜(TCS SP2)为德国LEICA公司产品;Synergy H4型酶标仪为美国Biotek公司产品。
1.3 K562上清液的制备及ELISA检测 取对数生长期的K562细胞1.5×106加于无血清的RPMI 1640培养液中,分别加入或者不加入10 μmol·L-1的 cariporide,置于37℃、5%CO2的细胞培养箱中培养72 h,离心收集上清液备用。按照ELISA试剂盒说明书分别检测两种上清液中VEGF的含量。
1.4 HUVEC 细胞的培养参照Jeffe等[10]的方法用0.3%的胰酶消化脐静脉内皮,将收集的细胞加于M199培养基中,其中含20%胎牛血清、青霉素(100 kU·L-1)链霉素(100 mg·L-1),置于37 ℃、5%CO2的细胞培养箱中培养。
1.5 MTT法检测cariporide对K562细胞上清液诱导的HUVEC增值的影响 取对数生长期的HUVEC,按每5×103接种于96孔板中,分别加入1∶1的cariporide处理和不处理的K562细胞上清液和M199培养液培养48 h,加入5 g·L-1的 MTT工作液每孔20 μl,孵育4 h,离心后弃上清,加入 DMSO每孔100 μl,震荡10 min使结晶充分溶解,使用酶标仪在波长570 nm时检测吸光度值,实验重复3次。
1.6 Transwell检测cariporide对K562细胞上清液诱导的HUVEC迁移的影响 HUVEC细胞以1×109·L-1的密度重悬在无血清的 M199培养液中,以100 μl体积接种于 transwell小室的上室,下室加入500 μl的1∶1的cariporide处理和不处理的K562细胞上清液和M199培养液,培养箱内常规培养12 h。取出小室,用棉签擦去上室内的非迁移细胞,倒置,风干,用0.1%结晶紫对小室背面迁移的细胞进行染色,PBS洗净多余染液。33%醋酸脱色,分光光度计测定吸光值。
1.7 基质胶血管形成法检测cariporide对K562细胞上清液诱导的HUVEC成管的影响 将基质胶在4℃融化过夜,按照每孔50 μl加入96孔板中,37℃孵育30 min使之凝固。将HUVEC重悬在1∶1的cariporide处理和不处理的 K562细胞上清液和M199培养液中,每孔加入150 μl含有1×104HUVEC细胞的的细胞悬液,继续培养6 h观察血管形成,并在40倍显微镜下拍照记录。
1.8 细胞内 pH值测定 参照王若君等[11]的方法,分别检测Cariporide处理前后K562细胞的细胞内pH值。
1.9 统计学处理 采用SPSS 15.0软件进行统计分析,两样本均数比较用t检验。
2 结果
2.1 cariporide对K562上清液诱导的HUVEC增殖的影响 MTT检测结果显示(Fig 1),cariporide处理组的OD值与对照组的OD值比较差异具有统计学意义(P<0.05),cariporide明显抑制 K562细胞上清液诱导的HUVEC增殖。
2.2 Cariporide对 K562上清液诱导的 HUVEC迁移的影响 Transwell实验显示(Fig 2),cariporide处理明显抑制K562细胞上清液诱导的HUVEC迁移,实验组的OD值与对照组OD值比较差异具有统计学意义(P<0.05)。
2.3 Cariporide对K562上清液诱导的 HUVEC成管能力的影响 Fig 3结果显示,cariporide处理组与对照组相比,HUVEC形成的管状结构分支数量和长度均减少,cariporide明显抑制K562细胞上清液诱导的HUVEC成管能力。
2.4 Cariporide对K562细胞内pH的影响 Cariporide处理后,K562细胞的细胞内pH由7.12±0.07下降到6.95±0.08,差异具有统计学意义。
2.5 Cariporide对K562分泌VEGF能力的影响ELISA结果显示(Fig 4),cariporide处理后,K562细胞分泌VEGF能力明显下降(P<0.05)。
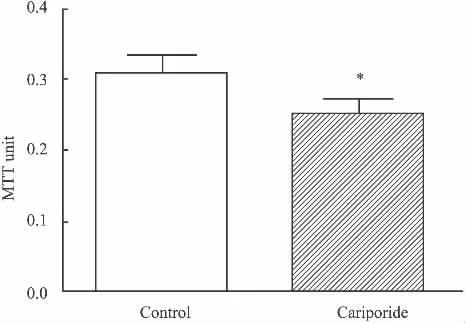
Fig 1 Effect of CM from cariporide treated K562 cells on HUVEC proliferation(±s,n=5)

Fig 2 Effect of CM from cariporide treated K562 cells on HUVEC migration(±s,n=5)
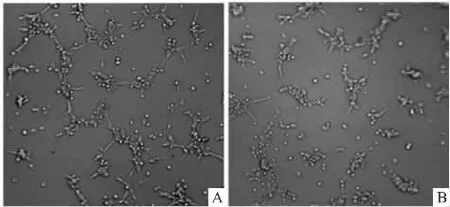
Fig 3 Effect of cariporide on HUVECs in vitro tube formation

Fig 4 Inhibitory effect of cariporide treatment on the secretion of VEGF(±s,n=5)
3 讨论
所有的实体肿瘤生长都需要经历没有血管支持的和随后的需要血管支持的两个阶段。由于血液恶性肿瘤主要是在骨髓和淋巴器官积累,所以人们最初以为血管生成对于血液恶性肿瘤并不是不可或缺的。然而,由于骨髓和淋巴结血管密度增加有助于为恶性细胞提供营养和氧气,骨髓的内皮细胞和基质细胞可以以旁分泌的方式分泌细胞因子和生长因子为恶性细胞的增殖和存活提供支持。越来越多的临床研究表明血管生成与血液恶性肿瘤的疾病进展,诊断以及预后息息相关。钠氢交换蛋白1(NHE1)是一种在哺乳动物中广泛表达的膜蛋白,之前的研究表明NHE1在髓系白血病细胞系中高度激活以维持细胞内碱性的pH值[12]。
肿瘤血管生成是由内皮细胞、肿瘤细胞与其微环境相互作用的结果,其中内皮细胞的增殖、迁移和分化是新生血管形成过程的关键环节,VEGF在这一过程中发挥了关键的作用[13-14]。我们的实验结果表明,应用NHE1特异性的抑制剂cariporide处理后,K562细胞上清液对HUVEC的增殖、迁移、分化的诱导作用都明显下降。Cariporide是一种毒副作用很小的特异抑制剂,其IC50在0.03-3.4 mmol·L-1,我们实验室之前的研究结果表明在本实验中采用的10μmol·L-1浓度对K562细胞基本没有细胞毒性,cariporide处理后引起这种抑制作用的原因是cariporide抑制NHE1的钠氢交换活性,造成细胞内酸化,从而引起VEGF的分泌减少。
综上所述,应用NHE1特异性抑制剂cariporide可以抑制K562细胞上清液诱导血管生成的能力。这种抑制作用主要是通过降低细胞内pH值和减少VEGF分泌引起的。本研究有助于进一步了解血液恶性肿瘤血管生成的机制,为临床上的预防和治疗提供理论基础。
[1]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-6.
[2]Zhang Y,Pillai G,Gatter K,et al.Expression and cellular localization of vascular endothelial growth factor A and its receptors in acute and chronic leukemias:an immunohistochemical study[J].Hum Pathol,2005,36(7):797-805.
[3]Kalmanti L,Dampaki K,Dimitriou H,et al.A morphometric approach for the evaluation of angiogenesis in acute lymphoblastic leukemia of childhood[J].Leuk Res,2005,29(6):673-7.
[4]Carmeliet P,Jain R K.Angiogenesis in cancer and other diseases[J].Nature,2000,407(6801):249-57.
[5]Lin Y,Chang G,Wang J,et al.NHE1 mediates MDA-MB-231 cells invasion through the regulation of MT1-MMP[J].Exp Cell Res,2011,317(14):2031-40.
[6]Jin W,Li Q,Lin Y,et al.Reversal of Imatinib resistance in BCR-ABL-positive leukemia after inhibition of the Na+/H+exchanger[J].Cancer Lett,2011,308(1):81-90.
[7]Malo M E,Fliegel L.Physiological role and regulation of the Na+/H+exchanger[J].Can J Physiol Pharmacol,2006,84(11):1081-95.
[8]芦 颖,李庆华,庞天翔.肿瘤细胞内pH值改变与肿瘤多药耐药的关系[J].中国药理学通报,2007,23(9):1128-30.
[8]Lu Y,Li Q H,Pang T X.The relationship between tumor intracellular pH and tumor multiple drug resistance[J].Chin Pharmacol Bull,2007,23(9):1128-30.
[9]李庆华,庞天翔,马 丽,等.Cariporide对肿瘤细胞增殖和血管内皮生长因子表达的影响[J].天津医药,2007,35(11):837-9.
[9]Li Q H,Pang T X,Ma L,et al.Effects of cariporide on tumor proliferation and VEGF expression[J].Tianjin Med J,2007,35(11):837-9.
[10]Jaffe E A,Nachman R I,Becker C G,et al.Culture of human endothelial cells derived from umbilical veins:identification by morphologic and immunologic criteria[J].J Clin Invest,1973,52(11):2745-56.
[11]王若君,常国强,李庆华,等.细胞内酸化逆转HL-60、MSC和脐血CD34+细胞耐药的研究[J].中国实验血液学杂志,2011,19(3):666-70.
[11]Wang R J,Chang G Q,Li Q H,et al.Reversal of multidrug resistance in HL-60,MSC and CD34+cells from umbilical cord blood by sustained intracellular acidification[J].J Exper Hematol,2011,19(3):666-70.
[12]Rich I N,Worthington-White D,Garden O A,et al.Apoptosis of leukemic cells accompanies reduction in intracellular pH after targeted inhibition of the Na+/H+exchanger[J].Blood,2000,95(4):1427-34.
[13]Kim K J,Li B,Winer J,et al.Inhibition of vascular endothelial growth factor-induced angiogenesis suppresses tumour growthin vivo[J].Nature,1993,362(6423):841-4.
[14]吴家明,陆 茵,郜 明,等.血管生成实验模型研究进展[J].中国药理学通报,2008,24(1):11-4.
[14]Wu J M,Lu Y,Gao M,et al.The advances of angiogenesis assay models[J].Chin Pharmacol Bull,2008,24(1):11-4.

