重组人成纤维细胞生长因子21降糖作用研究
张 健,李婷婷,唐 禄,田海山,,林灼峰,李海燕,王晓杰,,,李校堃, ,
(1.吉林农业大学生物反应器与药物开发教育部工程研究中心,吉林长春 130021;2.温州医学院药学院,浙江
温州 325035;3.吉林农业大学生命科学学院,吉林长春 130021;4.浙江格鲁斯特生物科技有限公司,浙江温州 325000)
成纤维细胞生长因子21(fibroblast growth factor 21,rhFGF21)是成纤维细胞生长因子家族中的一员[1],可与 FGF 受体家族成员中的 1、3、4 结合[2-3]。大量研究证明rhFGF21是和糖脂代谢有关的因子,它可以调控多种内分泌功能[4]。rhFGF21能明显增加鼠3T3-Ll脂肪细胞及人脂肪细胞对葡萄糖的吸收[5],但与胰岛素的作用机制不同,细胞对葡萄糖的摄取作用既不靠增加外源性肝素调节也不依赖于胰岛素,其降血糖作用缓慢持久,大剂量给药也不会引起低血糖反应。糖尿病是世界上发病率最高的疾病,胰岛β细胞功能受损是2型糖尿病发病的生理基础之一。研究证明rhFGF21对于胰岛β细胞具有保护作用[6]。目前胰岛素是治疗糖尿病的主要药物,但是长期使用胰岛素会产生胰岛素抵抗[7-8]和破坏胰岛 β细胞,而 rhFGF21具有调节内分泌和保护胰岛β细胞的功能,长期给药能够降低血液中胰岛素的水平,增强机体对胰岛素的敏感性,使其有望成为治疗2型糖尿病的备选药物。本研究通过检测rhFGF21在细胞水平上及动物模型中对葡萄糖吸收和血糖浓度的影响,初步探讨rhFGF21对糖代谢的影响,为研究rhFGF21分子机制打下基础。
1 材料与方法
1.1 材料
1.1.1 药品、细胞系及动物模型 重组人成纤维细胞生长因子21冻干粉(浙江省生物制药重点实验室制备);人肝细胞系(HL-7702);前脂肪细胞系(3T3-L1);大鼠成肌细胞(L6细胞,中国科学院典型培养物保藏委员会细胞库);ob/ob♂小鼠(南京青紫兰科技有限公司)
1.1.2 主要试剂及仪器 CO2培养箱(Thermo CELLBB15);胰蛋白酶(Sigma);胎牛血清、RPMI-1640培养基(Hyclone)、二甲基亚砜 D MSO(GIBCO),葡萄糖检测试剂盒(长春汇力生物技术有限公司)。
1.2 方法
1.2.1 细胞培养
1.2.1.1 HL-7702细胞培养 用含20%胎牛血清的RPMI 1640培养基,于37℃、5%CO2条件下培养,隔天换液,细胞融合度达到80%左右,用0.25%的胰蛋白酶消化,备用。
1.2.1.2 L6细胞培养及分化 用完全培养基(含10%胎牛血清的高糖DMEM培养基)培养,取对数生长期的细胞接种于12孔板,每孔100 000个细胞,待细胞融合度约70%时,换含2%胎牛血清的高糖DMEM的分化液,直至长出肌管,约14 d左右分化为成熟肌纤维。
1.2.1.3 3T3 L1 细胞培养及分化 用完全培养基(含10%胎牛血清的高糖DMEM培养基),在37℃,CO2浓度为5%的培养箱中培养3T3-L1细胞。2 d换1次细胞培养液,在融合度达到80%时接种于24孔板,每孔5 000个细胞,培养48 h后换分化液一(5 ml DMEM完全培养基中含有0.5 mmol·L-1IBMX,胰岛素10 mg·L-1),48 h再换分化液二(5 ml DMEM完全培养基中含有胰岛素10 mg·L-1),培养48 h换5 ml DMEM完全培养基,约8~10 d分化为成熟脂肪细胞。
1.2.2 rhFGF-21诱导HL-7702细胞葡萄糖吸收影响 取对数生长期的HL-7702细胞接种于24孔板中,每孔为 6 00 μl,3.0× 1 04个细胞,于 3 7℃、5%CO2条件下培养24 h,换含1%胎牛血清的 R PMI 1640培养基饥饿培养24 h,更换为1%胎牛血清RPMI 1640培养基稀释的浓度为200 mg·L-1的RHFGF21,每孔600 μl,3 个复孔,依次 2 倍梯度稀释,共做7个稀释浓度。24 h后用葡萄糖氧化酶(GOD-POD)法检测培养液中的葡萄糖含量,以未接种细胞空白复孔的葡萄糖均值做参比,测定各孔葡萄糖含量。根据公式:葡萄糖吸收增加量=(空白对照组葡萄糖含量-样品组葡萄糖含量)/空白对照组葡萄糖含量×100%。
1.2.3 rhFGF21诱导小鼠3T3-L1细胞葡萄糖吸收影响 将分化好的脂肪细胞,用0.5%胎牛血清高糖培养基饥饿24 h,加入梯度浓度的RHFGF21,24、48 h测定葡萄糖含量。
1.2.4 rhFGF21对L6肌细胞葡萄糖吸收的影响12孔板成熟L6肌纤维细胞以含0.5%胎牛血清的高糖DMEM培养基饥饿24 h,换以含0.5%胎牛血清、含不同rhFGF21浓度的培养液,孵育24 h后,用葡萄糖氧化酶(GOD-POD)法检测培养液中的葡萄糖含量,以未接种细胞空白复孔的糖含量均值为基础值,测定各孔葡萄糖吸收量变化。
1.2.5 rhFGF-21对ob/ob小鼠血糖的影响ob/ob小鼠普通饲料饲养;恒温,恒湿,明暗周期12 h,自由进食饮水;每天上午定时称体重及饲料消耗。rhFGF21 用量为 0.6 μg·g-1和 2.5 μg·g-1,取 5 只ob/ob小鼠,皮下注射 rhFGF21(每天 0.6 μg·g-1)连续7 d,分别在d 0、d 3、d 7给药后1 h检测空腹血糖(生理盐水组比)。取5只ob/ob小鼠,皮下注射 rhFGF21(每天0.6 μg·g-1),连续9 d,末次给药后1 h开始口服糖耐量实验(空腹2 h,测0 min血糖,灌胃给予2 mg·g-1的葡萄糖溶液,分别于给予葡萄糖溶液后30、60、120 min检测血糖)。取5只ob/ob小鼠,皮下注射 rhFGF21(每天 2.5 μg·g-1)连续7 d,在d 0、d 3、d 7给药后1 h检测餐后血糖。
1.2.6 统计学处理 上述细胞实验均重复3次,取其均值,采用GraphPad Prism 5软件进行统计学分析,定量数据以±s表示。
2 结果
2.1 rhFGF21促进HL-7702细胞葡萄糖吸收rhFGF21处理 HL-7702细胞后,在3.9 mg·L-1~100 mg·L-1间rhFGF21促进HL-7702细胞葡萄糖的吸收且呈现浓度-效应关系,EC50值为18.8 mg·L-1,与对照组相比差异有显著性(P<0.01)(见Fig 1)。
2.2 rhFGF21促进3T3-L1细胞葡萄糖吸收 rh-FGF21作用于脂肪细胞结果提示,在12.6 mg·L-1~100 mg·L-1间rhFGF21促进分化的3T3-L1细胞葡萄糖的吸收且呈现浓度-效应关系,EC50值为39.5 mg·L-1,与对照组相比差异有显著性(P<0.05)(见 Fig 2)。
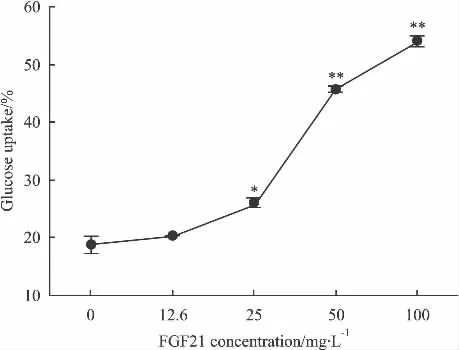
Fig 2 Effect of rhFGF21 on glucose uptake in differentiated 3T3-L1 cells
2.3 rhFGF21促进L6细胞葡萄糖吸收 rhFGF21从0.3mg·L-1到 250 mg·L-1可促进 L6 肌细胞对葡萄糖的消耗,EC50值为58.5 mg·L-1,与对照组相比差异有显著性(P<0.05),呈现浓度-效应关系(见Fig 3)。
2.4 rhFGF-21对ob/ob♂小鼠空腹血糖的作用rhFGF-21按照每天0.6 μg·g-1的剂量颈部皮下注射连续7 d,分别在d 0、d 3、d 7给药后1 h检测血糖。如图显示,与生理盐水组比,给FGF-21后3 d、7 d,血糖呈降低趋势,但差异未达统计学意义(见Fig 4)。
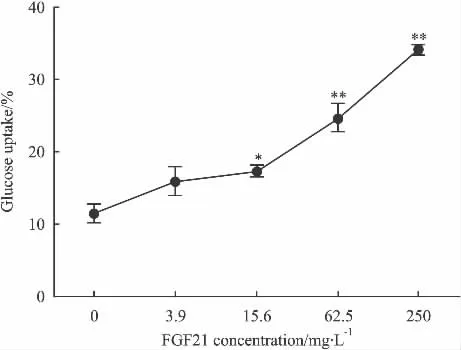
Fig 3 Effect of rhFGF21 on glucose uptake in L6 cells

Fig 4 Effect of rhFGF21 on fasting blood glucose of ob/ob male mice
2.5 rhFGF-21改善ob/ob♂小鼠糖耐量 皮下注射 rhFGF-21(每天 0.6 μg·g-1),连续 9 d,末次给药后1 h开始OGTT。如图显示,FGF-21(每天0.6 μg·g-1)对ob/ob小鼠的糖耐量有一定的改善作用(见 Fig 5)。
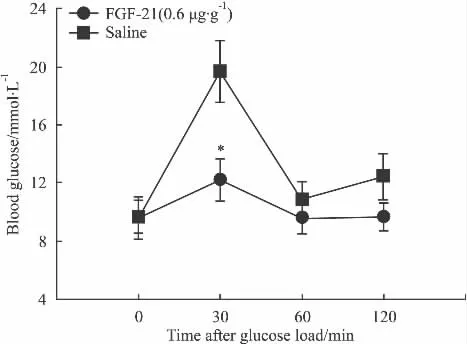
Fig 5 Effect of rhFGF21 on OGTT blood glucose of ob/ob mice
2.6 rhFGF-21对ob/ob♂小鼠餐后血糖的作用FGF-21按照每天2.5 mg·g-1的剂量颈部皮下注射连续7 d,在d 0、d 3、d 7给药后1 h检测餐后血糖。给药后3 d,血糖有所下降,P=0.051。给药后7 d,产生明显的降血糖作用(P<0.05),见Fig 6。

Fig 6 Effect of FGF-21(2.5 μg·g -1)on postprandial blood glucose of ob/ob mice
3 讨论
成纤维细胞生长因子-21(rhFGF21)是成纤维细胞生长因子家族的一个新成员,最早是从小鼠胚胎中分离出来的一种可分泌蛋白;成年小鼠rhFGF21的mRNA在肝脏内大量表达,在胸腺中低水平表达,而在其他组织中尚未发现。人类的FGF21氨基酸序列与FGF19和FGF23较为相近,其同源性分别为35%和24%。因此,FGF21、FGF19和FGF23被归类为FGFs家族的一个亚家族。由于这个亚家族成员与糖脂代谢有着密切的关系,所以近年来在国际上成为糖尿病和肥胖等代谢疾病研究的热点基因,其中人们最为关注FGF21。FGF21与其他FGF家族不同,不与肝素结合 ,也不会促进细胞分裂作用。美国Lilly公司已经开展FGF21用于糖尿病治疗药物的开发,目前正处在Ⅱ期临床阶段。本课题组利用基因工程分泌表达技术已经获得rhFGF21纯品,为FGF21新药研究奠定了良好基础。
基因工程重组蛋白的生物学活性是反映药物质量及功效的重要指标,因此建立稳定、灵敏的活性测定方法对于产品的生产及质量检测具有重要意义,同时也是指导临床用药剂量重要的指标。在过去的实验报道中大多数选择3T3-L1脂肪细胞作为检测葡萄糖吸收的细胞模型,该方法需要高糖诱导,低糖分化,将前脂肪细胞3T3-L1分化成脂肪细胞,再用rhFGF21刺激3T3-L1细胞。该方法造膜较难,试验周期长,结果重现性较差。本实验同时选用人肝细胞系(HL-7702);前脂肪细胞系(3T3-L1);大鼠成肌细胞(L6细胞)进行葡萄糖吸收试验,旨在确定作为rhFGF21活性检测用细胞株,并进一步确证rhFGF21体外降糖[9-10]效果及其作用的靶器官。实验结果表明rhFGF21可有效调控3种细胞模型的葡萄糖吸收,在肝细胞模型中,在3.9 mg·L-1~100 mg·L-1之间,rhFGF21促进HL-7702细胞葡萄糖的吸收且呈现浓度-效应关系,与对照组相比差异有显著性(P<0.05);在大鼠成肌细胞模型中,在0.3 mg·L-1~250 mg·L-1之间,rhFGF21 促进 L6 肌细胞对葡萄糖的消耗,与对照组相比差异有显著性(P<0.05);在脂肪细胞模型中,在12.6 mg·L-1~100 mg·L-1之间,rhFGF21促进分化的3T3-L1细胞对葡萄糖的吸收[5]且呈现浓度-效应关系,与对照组相比差异有显著性(P<0.05);ob/ob小鼠血糖实验证明,rhFGF-21可降低ob/ob鼠空腹及餐后血糖,同时改善葡萄糖耐受量。本实验结果表明,rhFGF21对肝细胞,脂肪细胞,骨骼肌细胞均具有促进葡萄糖吸收的作用,肝细胞,脂肪细胞,骨骼肌细胞是rhFGF21作用的靶器官,同时,动物实验进一步确证了rhFGF21降低血糖,改善葡萄糖耐受量的作用,本实验对于开展rhFGF21药效学实验及改善葡萄糖吸收机制研究起到积极的借鉴作用。
[1]Nishimura T,Nakatake Y,Konishi M,et al.Identification of a novel FGF,RHFGF21,preferentially expressed in the liver[J].Biochim Biophys Acta,2000,1492(1):203-6.
[2]Huang X,Yu C,Jin C,et al.Forced expression of hepatocyte2 specific fibroblast growth factor 21 delays initiation of chemically induced hepatocarcinogenesis[J].Mol Carcinog,2006,45(12):934-42.
[3]Ogawa Y,Kurosu H,Yamamoto M,et al.Beta Klotho is required for metabolic activity of fibroblast growth factor 21[J].Proc Natl Acad Sci USA,2007,104(18):7432-7.
[4]王会岩,张耀方,万晓珊,等.人成纤维细胞生长因子-21分泌型表达及鉴定[J].吉林农业大学学报,2009,31(3):255-7,72.
[4]Wang H Y,Zhang Y F,Wan X S,et al.Identification and expression of secretary human fibroblast growth factor(FGF)-21[J].J Jilin Agric Univ,2009,31(3):255-7,72.
[5]Kharitonenkov A,Shiyanova T L,Koester A,et al.FGF 21 as a novel metabolic regulator[J].J CIin Invest,2005,115(6):1627-35.
[6]Wente W,Efanov A M,Brenner M,et al.Fibroblast growth factor-21 improves pancreatic beta-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and Akt signaling pathways[J].Diabetes,2006,55(9):2470-8.
[7]Li Y B,Weng J P,Xu W,et al.The effects of short-term continuous subcutaneous insulin infusion treatment on beta-cell function in newly diagnosed type 2 diabetic patients[J].Chin J Diabetes,2003,11(1):10-5.
[8]Li H Z,Wang M,Liu X H,et al.The effects of short-term intensive insulin treatment on pancreaticβcell function in newly diagnosed type 2 diabetic patients[J].J Chin Phys,2004,6(1):82-3.
[9]Hong W,Qiang L,Stephen R F.Identification of a domain within peroxisome proliferator activated receptor gamma regulating expression of a group of genes containing fibroblast growth factor 21 that are selectively repressed by SIRT1 in adipocytes[J].Mol Cell Biol,2008,28(1):188-200.
[10]Hiroshi K,Mihwa C,Yasushi O,et al.Tissue-specific expression of betaKlotho and fibroblast growth factor(FGF)receptor isoforms determines metabolic activity of FGF19 and RHFGF21[J].J Biol Chem,2007,282(37):26687-95.

