二-(4-氯苯甲酰异羟肟酸)二正丁基合锡(DBDCT)对大鼠离体胸主动脉环的舒张作用及机制
杨彩红,张轩萍,吴博威,李青山
(山西医科大学1.药理学教研室、2.生理学教研室、3.药学院,山西 太 原 030001)
随着很多肿瘤预后的改善,患者生存率的提高,对多个正常器官和组织产生毒副反应成为限制抗肿瘤药物用量、阻碍疗效发挥的主要问题,研发高效低毒的抗肿瘤药物成为首选。本课题组将芳香异羟肟酸作为配体与有机锡合成,得到的系列芳香异羟肟酸类化合物已证实都具有高效广谱的抗癌活性[1-2]。其中二-(4-氯苯甲酰异羟肟酸)二正丁基合锡(DBDCT)这一全新结构化合物作用尤为突出,使用 DBDCT对荷瘤裸鼠实验结果表明,它们对SGC7901胃腺癌、Bel-7402肝癌等实体瘤有明确治疗作用[3],显示了高效广谱抗癌活性。在研究DBDCT的一般药理学实验中,发现DBDCT在体给药可使血压下降。DBDCT是否通过直接舒张血管作用而降低血压?本研究选用大鼠离体胸主动脉环,观察DBDCT对去甲肾上腺素和氯化钾诱发的血管收缩的影响,并用多种工具药探讨其可能的机制。
1 材料与方法
1.1 药物与试剂 二-(4-氯苯甲酰异羟肟酸)二正丁基合锡(DBDCT)由山西医科大学药学院药物合成实验室提供。纯度高于98%。
左旋硝基精氨酸甲酯(NG-nitro-L-arginine methyl ester,L-NAME)、吲哚美辛(Indomethacin,Indo)、溴化四乙胺(tetraethylammonium bromide,TEA)、格列苯脲(glibenclamide,Gli)、4-氨基吡啶(4-aminopyridine,4-AP)、去甲肾上腺素(norepinephrine,NE)、氯化钡(BaCl2)、HEPES和EGTA均购自Sigma公司。其余化学试剂均为国产分析纯。
1.2 仪器 BL-420F生物机能实验系统购自成都泰盟科技有限公司;HSS-1B数字式超级恒温浴锅购自成都仪器厂;张力换能器(JH-2)购自高碑店市新航机电设备有限公司。
1.3 实验动物 清洁级健康Sprague-Dawley(SD)大鼠(由山西医科大学实验动物中心提供),♂,2~3月龄,体质量250~300 g。
1.4 溶液配制 DBDCT溶剂配方:丙二醇 ∶柠檬酸缓冲液∶无水乙醇=4∶5∶1,柠檬酸缓冲液用生理盐水配制,pH为3.40。
生理盐溶液(physiological salt solution,PSS),其成分为(mmol·L-1):NaCl 144,KCl 5.8,MgCl21.2,CaCl22.5,Glucose 11.1,HEPES 5。
60 mmol·L-1-K+PSS,其成分为(mmol·L-1):NaCl 89.8,KCl 60,MgCl21.2,CaCl22.5,Glucose 11.1,HEPES 5。
Free-Ca2+PSS,其成分为(mmol·L-1):NaCl 144,KCl 5.8,MgCl21.2,Glucose 11.1,HEPES 5,EGTA 0.5。
上述营养液均用1 mol·L-1NaOH将pH值调至7.4,预热至37℃。实验中所述浓度均为浴管内试剂的终浓度。
1.5 实验方法
1.5.1 动脉环制备 参考文献方法[4],取出胸主动脉,迅速置入4℃预冷、氧饱和、pH值为7.4的PSS中,将动脉剪成2~3 mm的血管环,水平悬挂在10 ml浴管内,连接张力换能器,经BL-420F计算机生物信号采集分析系统记录血管环的张力变化。浴管内含有通以100%O2、pH值为7.4、37℃的 PSS,前负荷调为2 g,平衡1 h,使之维持基础张力在2 g的恒定水平,每20 min换1次营养液。所有动脉环用60 mmol·L-1KCl PSS液多次刺激,当标本对刺激收缩稳定后,即连续2次同样的刺激所引起的收缩幅度差别小于5%时,开始正式实验。
1.5.2 去内皮动脉环制备 将修剪干净的胸主动脉环两端固定,用与血管内径相适的棉棒从管腔擦过,连续2次。血管环悬挂稳定1 h后,用60 mmol·L-1KCl PSS液刺激,达到坪值后加入ACh(10-5mol·L-1)检验血管内皮的完整性,舒张幅度不超过收缩幅度的5%时认为内皮去除完全。
1.5.3 大鼠胸主动脉环舒张作用测定 采用内皮完整或去内皮的大鼠胸主动脉环,经60 mmol·L-1KCl PSS液刺激,待张力平衡后,用PSS液冲洗,使血管环张力恢复到刺激前的稳定张力水平后,加入NE(10-6mol·L-1)或 KCl(60 mmol·L-1)预收缩,然后加入 5×10-6mol·L-1的 DBDCT,对照组加入等容量的溶剂,描记张力曲线。以加入10-6mol·L-1NE 或 60 mmol·L-1KCl诱发的血管环的最大收缩幅度为100%,计算施加DBDCT后血管舒张幅度占最大收缩幅度的百分比,即加药后舒张幅度与 10-6mol·L-1NE 或 60 mmol·L-1KCl诱发的血管环最大收缩幅度的百分比。
1.5.4 L-NAME、Indo、4-AP、Gli、TEA、BaCl2对 DBDCT效应的影响 采用内皮完整大鼠胸主动脉环,待张力平衡后,用 NE(10-6mol·L-1)或 KCl(60 mmol·L-1)预收缩血管,达到坪值后,分别加入LNAME(10-4mol·L-1)、Indo(10-5mol·L-1)、4-AP(10-3mol·L-1)、Gli(10-5mol·L-1)、TEA(10-2mol·L-1)或 BaCl2(10-3mol·L-1),血管环张力进一步改变达到坪值后,加入5×10-6mol·L-1的DBDCT;对照组为收缩达坪值后,直接加入5×10-6mol·L-1的 DBDCT。记录相应血管环张力并计算变化值,以 10-6mol·L-1NE 或 60 mmol·L-1KCl诱发的血管环的最大收缩幅度为100%,比较两组最大舒张百分比变化的差异。
1.5.5 DBDCT对血管平滑肌外钙内流和内钙释放的影响 采用内皮完整的成年大鼠离体胸主动脉环,血管稳定后加入 NE 10-6mol·L-1,血管环收缩达坪值后洗脱,平衡1 h,然后用无钙 PSS液(含EGTA 0.5 mmol·L-1)冲洗 3 次,并孵浴 3 min。DBDCT 组加入DBDCT 5×10-6mol·L-1,对照组加入溶剂,孵浴 20 min,然后加入 NE 10-6mol·L-1,可见血管环产生迅速而短暂的收缩,待其舒张并平稳后,向各管内加入 CaCl22.5 mmol·L-1,可见血管环再次收缩并达峰值。记录相应血管环张力并计算变化值,以10-6mol·L-1NE诱发的血管环的最大收缩幅度作为100%,比较两组无钙液中NE和CaCl2最大收缩百分比的变化值。
1.5.6 统计学处理 以NE或KCl诱发的收缩幅度作为100%,计算加入DBDCT后的张力变化百分比。比较各组间在相同浓度时张力变化的差异。结果以±s表示,采用SPSS软件系统进行统计学分析,用两样本t检验进行显著性检验。
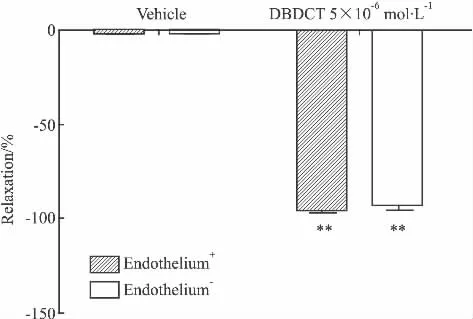
Fig 1 Effect of DBDCT,vehicle on the contraction induced by NE(10 -6mol·L-1)in isolated thoracic aorta rings with intact endothelium(Endothelium+)or endothelium-denuded(Endothelium-)(±s,n=6)
2 结果
2.1 DBDCT对NE或KCl预收缩大鼠离体胸主动脉环张力的作用以及内皮对其作用的影响 DBDCT 对 NE(10-6mol·L-1)、KCl(60 mmol·L-1)预收缩的离体胸主动脉环均产生明显的舒张作用。DBDCT 5×10-6mol·L-1对 NE(10-6mol·L-1)预收缩的离体胸主动脉环的舒张作用可从溶剂组的(0.47±0.63)%增大至(94.40±2.23)%,DBDCT 5×10-6mol·L-1对 KCl(60 mmol·L-1)预收缩血管环的舒张作用则为(11.69±1.76)%,与溶剂组相比,两组张力变化差异均有统计学意义(P<0.01)。DBDCT 对 NE(10-6mol·L-1)、KCl(60 mmol·L-1)预收缩的去内皮离体胸主动脉环也具有明显的舒张作用,与内皮完整组相比,张力变化无统计学差异(P>0.05)。见Fig 1,2。
2.2 L-NAME、Indo对DBDCT减弱NE收缩胸主动脉环的影响 L-NAME、Indo孵浴后,DBDCT对NE诱发的血管张力变化与无阻断药时比较,差异均无统计学意义(P>0.05)。在NE预收缩的血管环上,加入 L-NAME 后,DBDCT 5×10-6mol·L-1的舒张百分比为(112.65±13.12)%;对照组不加LNAME,直接加入 DBDCT 5×10-6mol·L-1,两组比较差异无统计学意义(P>0.05)。加入Indo后,DBDCT的舒张百分比为(93.59±3.48)%,与对照组比较差异无统计学意义(P>0.05)。见Fig 3。
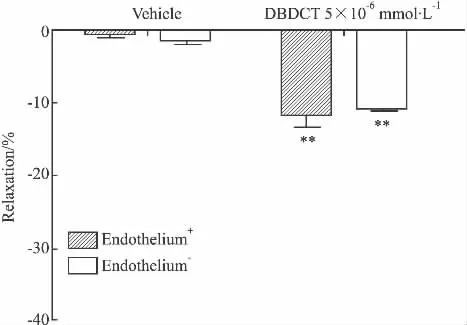
Fig 2 Effect of DBDCT,vehicle on the contraction induced by KCl(60 mmol·L -1)in isolated thoracic aorta rings in rats with intact endothelium(Endothelium+)or endothelium-denuded(Endothelium-)(±s,n=6)
2.3 4-AP、Gli、TEA、BaCl2对 DBDCT 减弱 NE 收缩胸主动脉环的影响 4-AP、Gli孵浴后,DBDCT对NE诱发的血管张力变化与无阻断药时比较,差异均无统计学意义(P>0.05)。在NE预收缩的血管环上,加入 4-AP 后,DBDCT 5×10-6mol·L-1的舒张百分比为(100.90±9.51)%;加入Gli后,DBDCT的舒张百分比为(92.25±2.90)%,与对照组不加阻断药直接加入DBDCT比较差异均无统计学意义(P>0.05)。见Fig 3。
TEA、BaCl2孵浴后,DBDCT的舒张作用减弱,差异有统计学意义(P<0.05)。在NE预收缩的血管环上,分别加入 TEA 或 BaCl2,DBDCT 5×10-6mol·L-1的舒张百分比分别为(42.21 ±2.50)%和(42.43±3.12)%;与对照组比较差异有统计学意义(P<0.05)。见Fig 3。
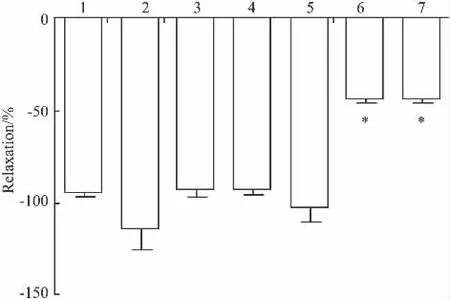
Fig 3 Effects of L-NAME(10 -4mol·L -1),Indo(10 -5mol·L -1),Gli(10 -5mol·L -1),4-AP(10 -3mol·L -1),TEA(10 -2mol·L -1),BaCl2(10 -3mol·L -1)on the relaxation induced by DBDCT in isolated thoracic aorta rings pre-contracted with NE(10-6mmol·L-1)(±s,n=6)
2.4 L-NAME、Indo对 DBDCT 减弱 KCl收缩胸主动脉环的影响 L-NAME、Indo孵浴后,DBDCT对KCl诱发的血管张力变化与无阻断药时比较,差异均无统计学意义(P>0.05)。
在KCl预收缩的血管环上,加入L-NAME后,DBDCT 5×10-6mol·L-1的舒张百分比为(17.40±3.28)%;对照组不加L-NAME,直接加入DBDCT 5× 10-6mol·L-1,其舒张百分比为(11.69 ±1.76)%,两组比较差异无统计学意义(P>0.05)。在KCl预收缩的血管环上,加入Indo后,DBDCT 5×10-6mol·L-1的舒张百分比为(15.15 ±3.05)%,与对照组不加阻断药直接加入DBDCT比较差异无统计学意义(P>0.05)。见Fig 4。
2.5 4-AP、Gli、TEA、BaCl2对 DBDCT 减弱 KCl收缩胸主动脉环的影响 4-AP、Gli孵浴后,DBDCT对KCl诱发的血管张力变化与无阻断药时比较,差异均无统计学意义(P>0.05)。在KCl预收缩的血管环上,加入 4-AP 后,DBDCT 5×10-6mol·L-1的舒张百分比为(13.77±3.22)%,加入Gli后,DBDCT 5×10-6mol·L-1的舒张百分比为(16.32 ±2.91)%,与直接加入DBDCT不加阻断药比较,差异无统计学意义(P>0.05)。见Fig 4。
同上方法,TEA、BaCl2孵浴后,DBDCT的舒张作用减弱,差异有统计学意义(P<0.05)。在KCl预收缩的血管环上,加入TEA或BaCl2后,DBDCT 5×10-6mol·L-1的舒张百分比分别为(8.94 ±1.09)%和(8.82±1.26)%,与不加BaCl2或TEA直接加入DBDCT比较差异均有统计学意义(P<0.05)。见Fig 4。
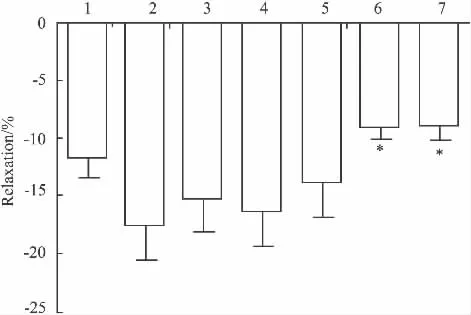
Fig 4 Effects of L-NAME(10 -4mol·L -1),Indo(10 -5mol·L-1),TEA(10 -2mol·L -1),4-AP(10 -3mol·L -1),BaCl2(10 -3mol·L -1),Gli(10 -5mol·L -1)on the relaxation induced by DBDCT in isolated thoracic aorta rings pre-contracted with KCl(60 mmol·L-1)(±s,n=6)
2.6 DBDCT对NE在无钙液中的缩血管效应的影响 在无钙 PSS液中,分别加入 DBDCT 5×10-6mol·L-1及同剂量溶剂,孵浴20 min后,加入 NE 10-6mol·L-1,血管环产生迅速而短暂的收缩,溶剂组和 DBDCT 5×10-6mol·L-1组的 NE 的收缩百分比分别为(20.44±1.60)%和(1.89 ±0.32)%,DBDCT组与溶剂组比较差异有统计学意义(P<0.01),见Fig 5。待其舒张并平稳后,加入CaCl22.5 mmol·L-1,血管环再次收缩,溶剂组和DBDCT组的收缩百分比分别为(91.87±2.16)%和(1.60±0.48)%,DBDCT组与溶剂组比较差异有统计学意义(P<0.01)。见Fig 5。
3 讨论
本实验表明,DBDCT对内皮完整和去内皮血管环均有舒张作用,且其舒张作用在内皮完整和去除内皮离体动脉血管环差异无显著性,提示DBDCT对血管的舒张作用可能主要是直接作用于血管平滑肌。一氧化氮(NO)和前列环素(PGI2)是典型的内皮释放的血管活性物质,具有强大的舒张血管的作用。进一步的研究表明,在使用NOS抑制剂L-NAME和环氧合酶抑制剂Indo处理血管后,发现在NE或KCl预收缩的基础上DBDCT舒张血管作用未被阻断,提示NO途径和PGI2可能未参加DBDCT的舒张血管作用。这些结果均证实DBDCT对血管的舒张作用与内皮舒血管因子的释放无关,而可能是直接作用于血管平滑肌。
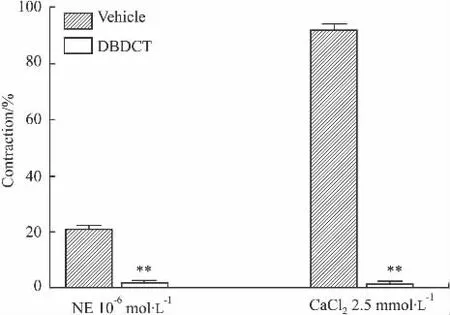
Fig 5 Effects of DBDCT(5×10-6mol·L-1)on NE(10 -6mol·L -1)induced contractions of the rat thoracic aorta rings in free-Ca2+PSS and CaCl22.5mmol·L -1(±s)
K+通道在调节血管平滑肌张力中具有重要作用,激活血管平滑肌上的K+通道,可引起细胞膜超极化,从而抑制细胞外钙内流,引起血管舒张[5]。据文献报道:在血管平滑肌上主要有4种钾离子通道,即电压依赖性钾通道(KV),内向整流钾通道(Kir),钙激活钾通道(KCa)和 ATP敏感钾通道(KATP)[6]。本实验结果显示,TEA、BaCl2可以抑制DBDCT的舒血管作用,Gli、4-AP对DBDCT的舒血管作用无明显影响。提示,KCa及Kir通道参与了DBDCT的舒血管作用,KATP和KV通道可能未参与其舒血管作用。
Ca2+是引起血管平滑肌收缩的关键因子[7],血管平滑肌收缩所需要的Ca2+源于细胞外内流和细胞内释放。钙内流的途径主要通过电压依赖性钙通道(voltage dependent calcium channel,VDC)、受体操纵性钙通道(receptor operated calcium channel,ROC)、钙释放激活的钙通道以及其他离子载体(Na+/Ca2+交换体、漏通道等)[8]。NE 诱导的血管收缩是作用于血管平滑肌上的α1肾上腺素受体,引起受体调控的钙通道开放,Ca2+内流,但主要通过三磷酸肌醇(IP3)刺激内贮Ca2+的释放引起血管平滑肌收缩[9]。KCl使血管平滑肌细胞膜去极化而刺激血管收缩,其机制主要是使VDC开放,从而促使细胞外液中或与细胞膜疏松结合的Ca2+内流[10],从而引起平滑肌收缩。在本实验中,DBDCT可抑制KCl引发的血管收缩,表明DBDCT引起的血管环舒张可能通过抑制VDC介导的细胞外钙内流而舒张血管。DBDCT抑制NE引发的血管收缩,提示其可能抑制肌浆网钙释放和(或)抑制ROC。NE在无Ca2+PSS液中引起的短暂收缩是细胞内Ca2+释放的结果,加入CaCl2后引起血管平滑肌进一步收缩被认为是细胞外Ca2+内流而产生的[11]。我们采用无Ca2+液和复Ca2+液的实验方法,发现DBDCT能抑制NE在无Ca2+液中所引起的血管平滑肌短暂收缩和复Ca2+后的持久收缩,证明DBDCT可能通过影响外钙内流和内钙释放发挥其舒血管作用。
综上所述,本实验结果提示DBDCT对NE和KCl诱发的大鼠胸主动脉环的收缩具有明显的减弱作用,该作用无内皮依赖性,与内皮生成的NO和PGI2均无关,而可能是直接作用于血管平滑肌,与激活KCa和Kir通道,抑制钙内流和肌浆网钙释放。
[1]Li Q,da Silva M F,Pombeiro A J.Diorganotin(IV)derivatives of substituted benzohydroxamic acids with high antitumor activity[J].Chem Euro J,2004,10(6):1456-62.
[2]Shang X,Cui J,Wu J,et al.Polynuclear diorganotin(IV)complexes with arylhydroxamates:Syntheses,structures andin vitrocytotoxic activities[J].J Inorg Biochem,2008,102(4):901-9.
[3]Li Y,Liu J,Li Q.Mechanisms by which the antitumor compound di-n-butyl-di-(4-chlorobenzohydroxamato)tin(IV)induces apoptosis and the mitochondrial-mediated signaling pathway in human cancer SGC-7901 cells[J].Mol Carcinog,2010,49(6):566-81.
[4]郭芬芬,任俊杰,王 君,等.度洛西汀对大鼠胸主动脉环舒张功能的影响[J].中国药理学通报,2011,27(9):1249-53.
[4]Guo F F,Ren J J,Wang J,et al.Effect of duloxetine on vasodilatation of rat isolated thoracic aortas[J].Chin Pharmacol Bull,2011,27(9):1249-53.
[5]Nelson M T,Quayle J M.Physiological roles and properties of potassium channels in arterial smooth muscle[J].Am J Physiol,1995,268(4 Pt 1):C799-822.
[6]高 敏,汪 海.血管平滑肌ATP敏感性钾通道研究进展[J].中国药理学通报,2004,20(8):845-9.
[6]Gao M,Wang H.Progress in vascular smooth muscle ATP-sensitive potassium channel[J].Chin Pharmacol Bull,2004,20(8):845-9.
[7]Bolton T B,Gordienko D V,Pucovský V,et al.Calcium release events in excitation-contraction coupling in smooth muscle[J].Novartis Found Symp,2002,246:154-68.
[8]张 乐,朱永平.不同分型钙通道阻滞剂在吗啡成瘾中的作用[J].中国药理学通报,2011,27(2):152-5.
[8]Zhang L,Zhu Y P.The role of calcium-channel blockers in morphine addiction[J].Chin Pharmacol Bull,2011,27(2):152-5.
[9]Kudoh A,Kudoh E,Katagai H,Takazawa T.Norepinephrine-induced inositol 1,4,5-trisphosphate formation in atrial myocytes is regulated by extracellular calcium,protein kinase C,and calmodulin[J].Jpn Heart J,2003,44(4):547-56.
[10]Jackson W F.Ion channels and vascular tone[J].Hypertension,2000,35(1 Pt 2):173-8.
[11]陶 亮,关永源,葛 慧,等.酪氨酸蛋白激酶在不同 α1肾上腺素受体亚型Ca2+调控中的作用[J].中国药理学通报,2000,16(4):387-91.
[11]Tao L,Guan Y Y,Ge H,et al.α1Adrenoceptor subtypes activates Ca2+movement through stimulating a tyrosine protein kinase pathway in HEK293 cells[J].Chin Pharmacol Bull,2000,16(4):387-91.

