木犀草素联合芦丁抗6-羟多巴胺诱导的帕金森病大鼠震颤及神经保护作用
何国荣,成银霞,穆 鑫,李晓秀,于 昕,王月华,方莲花,杜冠华
(1.中国医学科学院北京协和医学院药物研究所,“药物靶点研究与新药筛选”北京市重点实验室,北京 100050;2.烟台大学药学院药理学教研室,山东烟台 264005)
帕金森病(Parkinson’s disease,PD)是中脑黑质进行性退变而引起的神经退行性疾病,PD的发生与年龄老化、环境毒素以及遗传易感性等因素有关。药物治疗是目前治疗PD的主要方法,较为有效的是以左旋多巴为代表的多巴胺(dopamine,DA)替代疗法,然而,长期应用左旋多巴会出现运动波动和运动障碍等副作用,使用后期还会加速PD自然病程。针对其他靶点的药物也存在疗效不理想、副作用大等缺陷[1]。因此,寻找疗效确切且副作用小的药物成为抗PD药物研究的热点。
木犀草素(luteolin)广泛分布在金银花、菊花、青兰、紫苏、白毛夏枯草等植物中,具有抗氧化、抗炎、抗过敏、抗肿瘤、抗菌、抗病毒等药理作用,临床用于治疗肿瘤,肝炎,肌萎缩性脊髓侧索硬化症等。近期研究发现木犀草素能够抑制神经元氧化应激损伤,具有神经保护作用[2-4]。芦丁(rutin)又名芸香苷,是主要存在于芸香全草、豆科植物槐的花蕾、果实、金丝桃科植物红旱莲全草及蓼科植物荞麦籽苗中的一种黄酮类化合物。研究表明芦丁具有止血、降压、抗炎、抗病毒、舒张血管、抑制脑梗死等多方面的生物学活性,其复方制剂对心脑血管疾病有明显的治疗作用,特别是血管性痴呆[5-6]。这些研究结果提示,木犀草素和芦丁均对神经退行性疾病可能有较好的疗效。
本实验室前期建立了6-羟基多巴胺(6-hydroxydopamine,6-OHDA)损伤 SH-SY5Y细胞模型和促PC12细胞分化模型,对天然产物库内样品进行活性筛选,发现木犀草素和芦丁组合物(mixture of luteolin and rutin,MLR)能剂量依赖性地减轻6-OHDA诱导的细胞损伤和促PC12细胞分化。本研究采用脑室内注射6-OHDA制备PD大鼠模型,进一步考察MLR对模型大鼠的行为及中脑神经元损伤的改善作用,并从抑制炎症、保护神经元及恢复神经元功能等方面探讨MLR可能的作用机制,为其应用于PD临床治疗提供实验依据和理论基础。
1 材料与方法
1.1 材料
1.1.1 动物 Sprague Dawley(SD)大鼠,2~3月龄,♂,体质量180~200 g,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2007-0001。动物饲养条件为:温度(22±1)℃,相对湿度:55%-65%,通风干燥,12 h光照周期。
1.1.2 仪器 MP8001脑立体定位仪(深圳瑞沃德生命科技有限公司),DXP-2大小鼠转棒仪和DZIL-2大鼠自主活动程序自动控制仪(中国医学科学院药物研究所),BL-420E+生物机能实验系统(成都泰盟科技有限公司),5810R型高速低温离心机(美国Eppendorf公司),SM900冰冻切片机(美国Leica公司),X71正置荧光显微镜(日本OLYPUS公司)。
1.1.3 试剂与药品 MLR(美国 SYNORx,Inc.生产,批号:062107,含木犀草素和芦丁各50%)。美多芭片(上海罗氏制药有限公司生产,批号:SH 0502)。6-OHDA、DA、阿 朴 吗 啡 (apomorphine,APO)、小鼠抗大鼠酪氨酸羟化酶(trysine hydroxylase,TH)抗体,购自Sigma-aldrich公司;多巴胺转运体(dopamine transport protein,DAT)抗体、胶质纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)、购自Santa Cruz公司,羊抗小鼠IgG、卵白素-生物素过氧化物酶复合物(Avidin Biotin-peroxidase Complex,ABC)试剂盒、3,3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色剂,购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 模型建立 健康♂ SD大鼠,3%的戊巴比妥钠(50 mg·kg-1,ip)麻醉,头颅水平位固定在脑立体定位仪上,在左侧相当于前脑内侧束(medial forebrain bundle,MFB)区的颅骨表面钻孔,直径约2.5 mm。清理脑膜后,行MFB两点注射6-OHDA(4 g·L-1),(1)TB:-2.3 mm,AP:-4.4 mm,ML:1.2 mm,V:-7.8 mm;(2)TB:+3.4 mm,AP:-4.0 mm,ML:0.8 mm,V:-8.0 mm。在三维推动器的引导下两点各注射 6-OHDA 3 μl,注射速度 1 μl·min-1,注射完毕后留针10 min,缓慢退针。术后连续3 d肌注青霉素20万U·d-1以防感染。大鼠清醒后置于笼内正常环境饲养。
1.2.2 模型评价 术后1周大鼠给予APO(0.5 mg·kg-1,sc),于直径40 cm的有机玻璃桶中观察其运动变化,每周1次,连续测试2周,若大鼠恒定向右旋转,且旋转圈数>280 r/40 min,则视为造模成功,经过上述方法筛选,获得58只合格模型动物。
1.2.3 分组与给药 将造模成功的58只PD大鼠随机分为模型组、美多芭组(50 mg·kg-1,ig)、MLR低(125 mg·kg-1,ig)、中(250 mg·kg-1,ig)、高剂量(375 mg·kg-1,ig)组,另取手术并注射生理盐水,经检测无旋转运动的大鼠10只为假手术组,模型组10只,其他每组各12只,共6组。分组后即给予相应药物,假手术组与模型组大鼠灌胃给予蒸馏水2 ml,每日1次,连续3周。
1.2.4 行为学检测 模型动物分组后每隔7 d进行旋转行为检测。于给药后30 min给予APO(0.5 mg·kg-1,sc)诱发旋转,记录40 min 内的旋转次数(方法同“1.2.2”)。
1.2.5 大鼠肌电测定 清醒大鼠固定于实验台上,使用BL-420E+生物信号采集器记录肌电。将肌电记录电极固定在大鼠右侧臀部肌肉,电极间隔约1 cm,参考电极接地,记录震颤引起的肌电活动(electromyography,EMG),震颤的程度采用EMG频率和幅度表示。分别记录1 min内大鼠震颤的频率和幅度,共3次,取平均值。
1.2.6 免疫组织化学检测 每组取5只大鼠,3%戊巴比妥钠(50 mg·kg-1,ip)麻醉后开胸,动脉插管,以生理盐水冲洗血液后灌注含0.04多聚甲醛的0.1 mol·L-1的磷酸缓冲液(PBS,pH 7.2 ~7.4)固定组织,断头取全脑固定4 h,以含0.3的蔗糖的多聚甲醛固定液内脱水,待组织下沉后修整组织块,取中脑腹侧作连续冰冻冠状切片,片厚为20 μm。切片首先与一抗(TH,1 ∶500;DAT,1 ∶200;GFAP,1∶400)4℃孵育过夜;然后分别与生物素标记的二抗(1∶300)反应1 h以及卵白素-生物素复合物反应2 h,最后用含有DAB的缓冲液显色。
神经元计数方法:随机选取每只大鼠脑切片5张,分别在右侧黑质(substantia nigra,SN)阳性细胞密集区中央部分取4个互不重叠的高倍视野,计数视野内TH、DAT、GFAP免疫反应阳性神经元数目。
1.2.7 外周神经传导速度测定 另取正常大鼠18只,随机分为3组,每组6只,0.1的水合氯醛(300 mg·kg-1,ip)麻醉,俯卧固定。分离坐骨神经干,刺激电极置于游离的坐骨神经干近心端;引导电极置于坐骨神经干远心端,两电极相距约1 cm。采用BL-420E+型生物机能实验系统,刺激信号0.6 mv,0.02 ms,单刺激,信号记录采集间隔为0.01 s,1 kHz滤波,引导信号放大50倍,计算神经肌肉动作电位潜伏期,神经传导速度计算公式为:
V=刺激电极到引导电极的距离(mm)/潜伏期(ms)。
将0.1 g·L-1的普鲁卡因溶液(Procaine)和0.1 g·L-1的MLR溶液直接滴在坐骨神经上,观察药物对坐骨神经信号传导速度的影响,以生理盐水组(normal saline,NS)作为对照组。每5 min给予一次电刺激并记录电信号传导速度,记录30 min。
2 结果
2.1 行为学观察 假手术组大鼠无异常行为,模型组大鼠可见活动明显减少、反应迟钝、肢体震颤、嗅探、偏斜、弓背、尾僵直、竖毛等异常行为。给予美多芭2 h内大鼠僵住行为明显,随后缓解,给药一段时间后大鼠的异常行为有所改善;MLR各给药组大鼠在给药后没有僵住行为产生,持续给药可改善模型大鼠出现的上述异常行为。
以APO诱导大鼠旋转,其中,假手术组大鼠旋转圈数无变化;模型组大鼠测定旋转圈数维持360 r/40 min左右,美多芭(madopar)组于给药后第1周旋转圈数有所增加,其后2周恢复到给药前水平,大鼠运动变化给药前后差异无显著性;MLR低、中、高剂量组给药后大鼠旋转圈数也无差异。各组大鼠给药前后旋转情况见Fig 1所示。
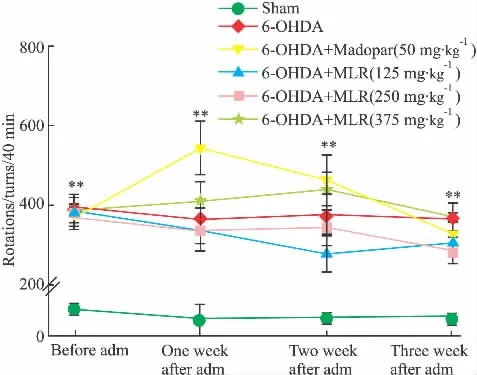
Fig 1 Rotational behavior in 6-OHDA unilaterally lesioned rats(±s,n=10)
2.2 肌电活动 假手术组大鼠静息状态EMG无明显可检测信号,模型组大鼠可见连续的阵发性簇状电信号(P<0.01),其节律与大鼠震颤活动的节律相一致,表现出PD模型大鼠的特殊症状特征。各给药组给药前EMG值与模型组无差异,给药后40 min,与模型相比,阵发性簇状电信号出现的频率和幅度均明显降低,且具有剂量依赖性;其中,MLR中、高剂量组改善模型动物震颤的作用优于阳性对照药美多芭组(Fig 2)。
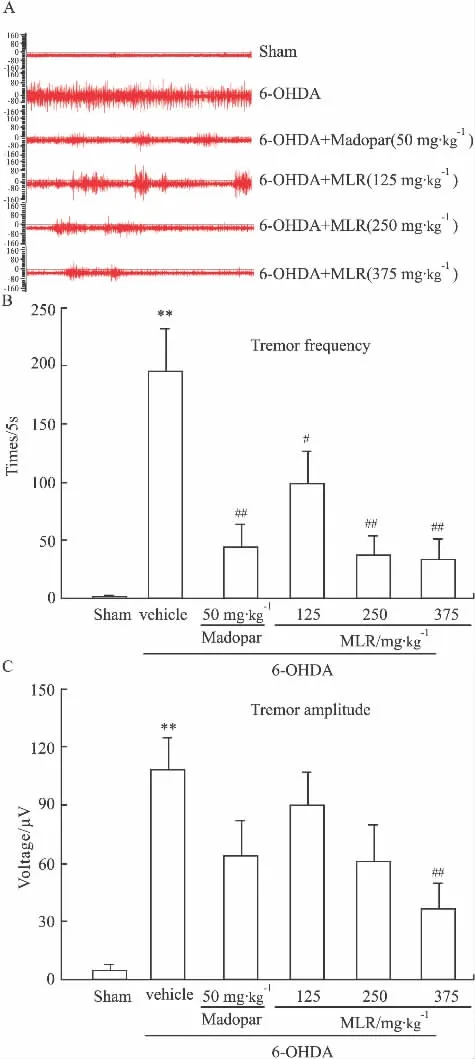
Fig 2Tremor in 6-OHDA unilaterally lesioned rats(±s,n=10)
2.3 免疫组织化学分析
2.3.1 大鼠损毁侧黑质TH表达 假手术组大鼠SN的TH免疫阳性神经元形态清晰,TH表达高,免疫活性强,细胞胞体和纤维染色较深,有明显可见的免疫阳性突起;6-OHDA偏侧损伤大鼠毁损侧SN TH免疫阳性神经元的数目较假手术组下降95%(P<0.01),免疫活性差,胞质着色淡,细胞轮廓不清晰。MLR各给药组神经元数目较模型组有所增加,中、高剂量组的作用与阳性对照药美多芭相似(P<0.01),TH免疫阳性神经元的数目较模型组增加,MLR高剂量组TH免疫阳性神经元的数目约为模型组的499.14%(Fig 3)。
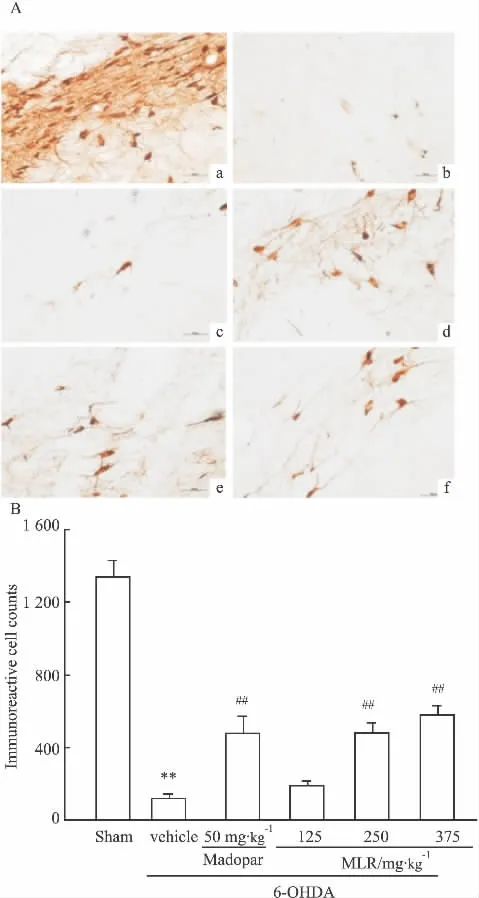
A:Representative photographs showing.sham(a),6-OHDA(b),6-OHDA+madopar(c),6-OHDA+MLR(125mg·kg-1)(d),6-OHDA+MLR(250 mg·kg-1)(e),6-OHDA+MLR(375 mg·kg-1)(f);B:Summary of the effect of MLR on 6-OHDA induced TH immunoreactive neurons in the SN.**P<0.01 vs sham group,##P<0.01 vs 6-OHDA group
2.3.2 大鼠损毁侧黑质DAT表达 DAT主要位于神经元轴突和末梢的质膜上。假手术组DAT表达高,免疫活性强,胞质浓染,细胞轮廓较清晰。模型组DAT表达明显降低(P<0.01),免疫活性差,胞质着色浅,细胞形态模糊。各给药组均可改善6-OHDA所致DAT免疫阳性神经元数目的减少,MLR作用好于阳性对照药美多芭,但差异未见显著性(P>0.05)(Fig 4)。
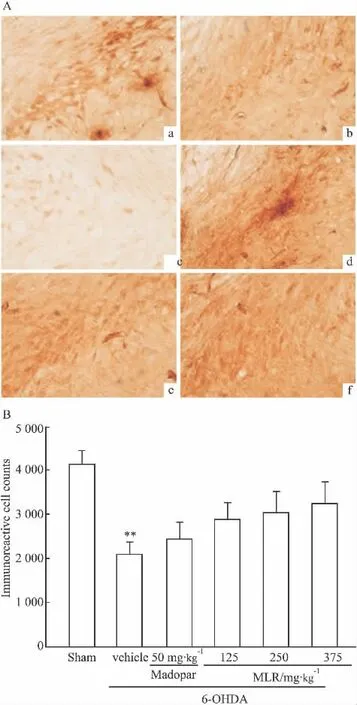
Fig 4 DAT positive neurons immunoreactivity in the SN of rats(±s,n=5)(×400)
2.3.3 大鼠损毁侧黑质GFAP表达 假手术组GFAP表达较低,胞质着色淡,模型组GFAP表达显著增加(P<0.01,比假手术组增加了188.59%),胞质着色加深,各给药组均可降低GFAP免疫阳性星形胶质细胞的数目(P<0.01),MLR高剂量组GFAP免疫阳性星形胶质细胞的数目比模型组降低了43.68%(Fig 5)。
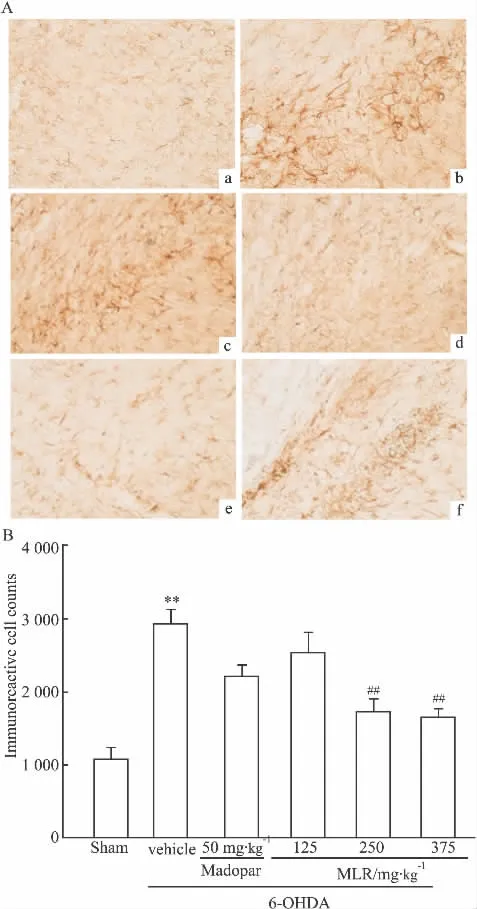
Fig 5 GFAP positive astrocyte immunoreactivity in the SN of rats(±s,n=5)(×400)
2.4 外周神经传导速度 在给予生理盐水时,大鼠坐骨神经传导速度保持在0.4~0.8 m·s-1之间;而给予普鲁卡因溶液5 min,坐骨神经传导速度迅速增加,然后传导速度明显下降。给予MLR后,神经传导速度没有变化,提示MLR可能对神经传导速度没有影响(Fig 6)。
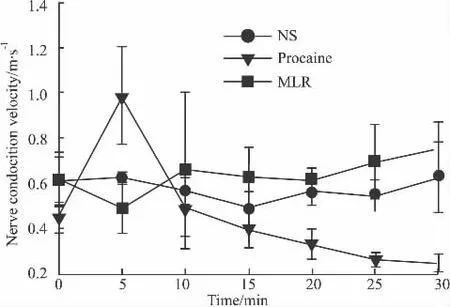
Fig 6 The peripheral nerve conduction velocity in normal rats(±s,n=6)
3 讨论
静止性震颤是PD主要临床特征之一。目前认为,PD患者静止性震颤主要与基底神经节-丘脑-皮层传递环路有关。黑质-纹状体多巴胺能神经纤维变性使这一环路中具有节律性放电活动的神经元活动增强并同步化,最后通过运动皮质的节律性兴奋而产生震颤。目前,临床针对静止性震颤主要采用DA替代疗法、抗胆碱药物、选择性乙酰胆碱受体拮抗剂等进行治疗,由于不良反应明显、难以控制疾病病理进程等原因,亟需研发疗效明显、毒副作用小的抗 PD 药物[1,7-8]。
本研究结果显示,MLR各给药组大鼠旋转圈数在给药前后没有变化,与模型组相比差异也无显著性,表明MLR对APO诱导的大鼠旋转运动没有影响,提示MLR抑制震颤的作用不是通过多巴胺受体产生的。行为学观察证实,MLR对大鼠的运动障碍有改善趋势。但是,目前还缺少可靠的量化指标对运动障碍进行评价。本研究首次将EMG检测用于评价PD模型大鼠的震颤程度。结果表明,美多芭和MLR各剂量对大鼠震颤频率和幅度有明显的抑制作用,且MLR各给药组具有良好的量效关系。该检测方法的建立为抗PD药物药效学研究与作用机制考察提供了更有效的评价技术。
静止性震颤即可以是中枢性震颤也可以是外周性震颤。在减轻震颤方面,MLR是否直接抑制外周神经传导速度,目前仍不清楚。因此,考察了MLR对正常大鼠外周神经传导速度的影响。实验结果表明MLR抑制大鼠震颤与外周神经没有直接关系。
本研究中,6-OHDA定位注射造成黑质星形胶质细胞数目增多,这与已有的研究报道一致。随着病程的进展,激活的星形胶质细胞释放大量促炎因子导致神经元变性死亡[9-10]。前期研究发现,木犀草素和芦丁的神经保护作用均与其抗氧化、抗炎作用相关[3-6]。本实验显示,MLR可明显增加TH 阳性细胞数目,并改善细胞状态。另外,GFAP阳性计数与TH阳性计数相关性分析显示,GFAP细胞数与TH细胞数呈负相关,表明星形胶质细胞反应性增生与DA能神经元凋亡有关,而MLR可明显降低GFAP阳性细胞数,提示MLR能够抑制星形胶质细胞释放促炎因子。
在PD发病过程中,各种损伤因素最终通过引起神经细胞损伤及凋亡导致功能障碍,到目前为止还没有任何一种药物或治疗方式能够完全阻断PD的进程。本研究证实,连续给药3周,MLR可以剂量依赖性减轻大鼠震颤频率和幅度,表明MLR在减轻模型动物震颤方面具有独特的优势。此外,MLR能够减轻6-OHDA造成的DA能神经元损伤、抑制星形胶质细胞释放促炎因子,部分恢复DA能神经元功能,延缓PD病理进程。本研究为其进一步临床应用提供了重要的基础实验数据。
(致谢:感谢Thomas P.Lahey先生和 SYNORx,Inc公司提供实验样品及在研究过程中给予的帮助。)
[1]Chen J J.Pharmacologic safety concerns in Parkinson’s disease:facts and insights[J].Int J Neurosci,2011,121(Suppl 2):45-52.
[2]祝德秋,刘皋林.木犀草素的药理作用研究进展[J].中国药房,2010,21(19):1807-10.
[2]Zhu D Q,Liu G L.Progress in the pharmacological effects of luteolin[J].China Pharm,2010,21(19):1807-10.
[3]陈瑶玥,暨荀鹤,郭礼和.木犀草素对大鼠皮层神经元氧化损伤的保护作用[J].中国药理学通报,2008,24(3):382-6.
[3]Chen Y Y,Ji X H,Guo L H.Luteolin protected cultured cortical neurons from oxidative stress-induced damage[J].Chin Pharmacol Bull,2008,24(3):382-6.
[4]Qi L,Pan H,Li D,et al.Luteolin improves contractile function and attenuates apoptosis following ischemia-reperfusion in adult rat cardiomyocytes[J].Eur J Pharmacol,2011,668(1-2):201-7.
[5]臧志和,曹丽萍,钟 玲.芦丁药理作用及制剂的研究进展[J].医药导报,2007,26(7):758-60.
[5]Zang Z H,Cao L P,Zhong L.Progress in pharmacological effects and praeparatum of rutin[J].Herald Med,2007,26(7):758-60.
[6]Lao C J,Lin J G,Kuo J S,et al.Microglia,apotosis and interleukin-1 beta expression in the effect of Sophora japonica L on cerebral infarct induced by ischemia-reperfusion in rats[J].Am J Chin Med,2005,33(3):425-38.
[7]Hallett M.Parkinson’s disease tremor:pathophysiology[J].Parkinsonism Relat Disord,2012 18(Suppl 1):S85-6.
[8]Dekundy A,Lundblad M,Danysz W,Cenci MA.Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds:further validation of the rat dyskinesia model[J].Behav Brain Res,2007,179(1):76-89.
[9]Sharma,V,Mishra,M,Ghosh,S,et al.Modulation of interleukin-1beta mediated inflammatory response in human astrocytes by flavonoids:implications in neuroprotection[J].Brain Res Bull,2007,73(1-3):55-63.
[10]Giacalone M,Di Sacco F,Traupe I,et al.Antioxidant and neuroprotective properties of blueberry polyphenols:a critical review[J].Nutr Neurosci,2011,14(3):119-25.

