siRNA沉默β-arrestin2促进肝星状细胞凋亡
宋 杨,孙妩弋,胡姗姗,汪庆童,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药理学教育部重点实验室,抗炎免疫药物安徽省工程技术研究中心,安徽合肥 230032)
肝纤维化是诸多慢性肝病发展至肝硬化过程中所共有的病理变化,是影响慢性肝病预后的重要环节。肝纤维化的主要病理特征是细胞外基质(extracellular matrix,ECM)在肝内的过量沉积[1]。目前认为,活化的肝星状细胞(hepatic stellate cells,HSC)是肝纤维化ECM的主要来源细胞。HSC在多种因素刺激后被激活转换成为肌成纤维样细胞,细胞大量增殖,合成ECM,并在肝内过量沉积,发生肝纤维化[2]。促进活化的HSC凋亡是防治肝纤维化的重要途径,HSCs的凋亡被认为是肝纤维化自我修复的中心环节。凋亡途径不但可以减少增生活化的HSC数量,使ECM分泌减少,而且凋亡的细胞可在数小时内被周围的细胞所吞噬,很少引起微环境的炎症损伤,是一种理想的清除增生HSC的方式[3]。
β-arrestins对绝大部分G蛋白偶联受体(G protein coupled receptor,GPCR)介导的信号转导通路具有调节作用。越来越多的研究表明,β-arrestin除了调节GPCR信号通路以外,β-arrestin作为调节分子也在其他多种细胞内信号通路中发挥重要作用[4-5]。有研究表明,β-arrestin2 在细胞增殖中起重要调节作用[6-7],β-arrestin2 还有抗细胞凋亡的作用,其能通过多种信号通路介导和调节细胞凋亡[8-9]。然而,β-arrestin2 对肝纤维化 HSC 凋亡的影响尚未见相关报道。本课题组在肝纤维大鼠的肝组织中β-arrestin2表达明显增强的先前研究基础上(另文发表),采用脂质体转染技术,将体外合成的靶向 β-arrestin2的小干扰 RNA(small interfering RNA,siRNA)导入肝星状细胞株HSC-T6中,选择性沉默β-arrestin2基因,观察其对Bcl-2和Bax表达和HSC凋亡的影响,初步探讨siRNA β-arrestin2促HSC凋亡作用。
1 材料
1.1 细胞株 HSC-T6细胞为永生化大鼠肝星状细胞株,由上海肝病中医药研究所提供。
1.2 主要材料与试剂 Lipofectamine 2000为Invitrogen公司产品;抗 β-arrestin2抗体:购自 Santa cruz公司;抗 Bcl-2、Bax、β-actin 抗体:北京中杉金桥生物技术有限公司;预染蛋白质分子量标准:MBI Fermentas公司;辣根酶标记山羊抗小鼠IgG(H+L):北京中杉金桥生物技术有限公司产品;氟化聚偏乙烯(polyvinylidene fluoride,PVDF)微孔转移膜:Millipore公司;SuperSignal West Femto Kit(超敏感底物发光试剂盒):Pierce公司,4℃保存。所有siRNA均由上海吉玛制药技术有限公司合成。RT-PCR引物由Invitrogen(上海)贸易有限公司合成;DMEM、FBS:GIBco公司产品;逆转录聚合酶链反应(RTPCR)试剂盒:Fermentas公司产品;凋亡试剂盒:贝博生物公司。
1.3 仪器 Olympus IX-71型光学显微镜(日本);流式细胞仪(美国Beckman公司,FC500型);SpotAdvanced显微摄像系统(美国);电泳仪(DYY-10,北京六一仪器厂);Image-Pro plus图像处理系统;PCR仪(美国Biorad公司,My Cycler)。
2 方法
2.1 HSC-T6细胞培养和传代 HSC-T6细胞采用含有10% 胎牛血清的DMEM培养基,置37℃、5%CO2培养箱中培养。当细胞生长达80%融合时,用0.25%胰蛋白酶消化传代。转染前24 h将处于对数生长期的HSC-T6细胞以5×105/孔接种于6孔板中。
2.2 siRNA瞬时转染HSC-T6细胞株
2.2.1 靶向 β-arrestin2的 siRNA设计与合成 根据β-arrestin2全基因序列设计4个siRNA序列如下:siRNA-1:正义链 5'-AGCGUGACUUUGUGGAUCATT-3', 反 义 链 5'-UGAUCCACAAAGUCACGCUTT-3';siRNA-2:正义链5'-GACCGGAAAGUGUUUGUGATT-3',反义链 5'-UCACAAACACUUUCCGGUCTT-3';siRNA-3:正义链5'-GACCGACUGCUGAAGAAGUTT-3',反义链5'-ACUUCUUCAGCAGUCGGUCTT-3';siRNA-4:正义链 5'-UCGAGCCUUCUGUGCCAAATT-3',反义链 5'-UUUGGCACAGAAGGCUCGATT-3'。
2.2.2 实验分组 实验共分3组:(1)空白对照组,以等体积的无牛血清无双抗DMEM培养液代替转染液,作为转染前β-arrestin2水平;(2)阴性对照组,以转染scrambled RNA的细胞观察β-arrestin2表达的变化;(3)siRNA β-arrestin2 组(R1、R2、R3、R4),转染针对β-arrestin2的siRNA,特异性干扰目的基因β-arrestin2的表达。
2.2.3 转染 常规培养HSC-T6细胞至细胞密度达80%时,用无牛血清无双抗培养液分别稀释Lipofectamine 2000和siRNA至所需浓度(siRNA终浓度为20 μmol·L-1,分装,-20℃保存),室温静置 5 min。将稀释后的siRNA与Lipofectamine 2000小心混匀,室温再静置20 min,使形成稳定的siRNA-脂质体混合物。随后弃去培养液,将上述混合物加入待转染细胞,6 h后更换为完全培养液继续培养。
2.3 RT-PCR检测 β-arrestin2 mRNA的表达 使用TRizol试剂提取细胞总RNA,并进行逆转录反应。PCR引物为 β-arrestin2:5'-CCACGTCACCAACAATTCTG(上游),5'-TTGGTGTCTTCGTGCTTGAG-3'(下游);内参 GAPDH 5'-TCAAGAAGGTGGTGAAGCAG-3'(上 游),5'-AGGTGGAAGAATGGGAGTTG-3'(下游)。PCR条件:94℃ 5 min;94℃ 30 s;58℃ 30 s;72℃ 30 s;72℃ 10 min;4℃ 10 min(循环30次)。PCR产物经2%琼脂糖凝胶电泳检测。
2.4 Western blot检测 β-arrestin2、Bcl-2、Bax 蛋白的表达 收集细胞,加蛋白裂解液抽提细胞蛋白。Lowry法蛋白定量,每泳道20 μl蛋白上样进行SDSPAGE,在转移缓冲液中,以200 mA的电流转移到PVDF膜上。后封闭2 h,再加入抗β-arrestin2、Bcl-2、Bax单抗,4℃孵育过夜。洗涤后,继以辣根过氧化物酶结合的二抗室温孵育2 h,ECL试剂盒显色。用Image-Pro plus图像处理系统分析计算蛋白印迹值。
2.5 细胞凋亡的检测 采用AnnexinV/PI双染色法。消化收集各组细胞,PBS重悬细胞。按照试剂盒说明进行操作,流式细胞仪进行检测。图中右上象限为凋亡晚期或坏死细胞区,左下象限为活细胞区,右下象限为早期凋亡细胞区。测定3次,计算各组细胞的平均凋亡率。
2.6 统计学处理 采用SPSS 17.0统计学软件,数据以±s表示,采用方差分析比较各组间差异。
3 结果
3.1 siRNA β-arrestin2 对 β-arrestin2 基因表达的抑制作用 RT-PCR结果经计算机灰度扫描并与内参照比较分析后显示,在转染siRNA3后HSC-T6 βarrestin2 mRNA较空白对照组和阴性对照组mRNA水平分别下降70% ±1.76%和69% ±1.93%,而在转染siRNA1、siRNA2和siRNA4后mRNA下降不明显。提示 siRNA3 β-arrestin2 对 β-arrestin2 mRNA表达有抑制作用。阴性对照组灰度与空白对照组比较差异无统计学意义(P>0.05),见Fig 1。
3.2 siRNA β-arrestin2 对 HSC-T6 细胞 β-arrestin2蛋白表达的抑制作用 Western blot分析结果显示,HSC-T6在转染siRNA2和siRNA3后β-arrestin2蛋白表达被抑制了29.00% ±1.68%和68.43% ±2.88%,而阴性对照组及空白对照组细胞的β-arrestin2蛋白表达无明显变化,与 β-arrestin2 mRNA下降趋势基本相同(见Fig 2)。
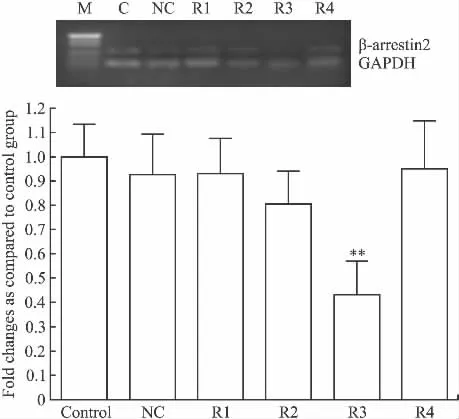
Fig 1 Transcriptional expression of the β-arrestin2 in the stable HSC-T6 cells transfected with β-arrestin2 siRNA
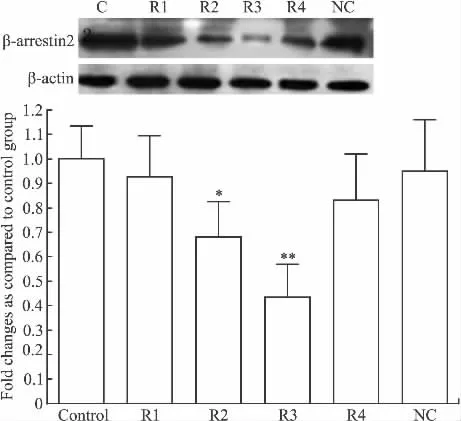
Fig 2 Protein level of the β-arrestin2 in the HSC-T6cells transfected with β-arrestin2 siRNA
3.3 siRNA β-arrestin2 对 HSC Bcl-2 和 Bax 表达的影响 Fig 3结果表明,转染siRNA3的HSC-T6细胞β-arrestin2 Bcl-2表达被抑制了32.58% ±3.46%(P<0.01),Bax的表达增加了38% ±3.72%(P<0.01),而阴性对照组与空白对照组细胞比,Bcl-2和Bax表达无变化。
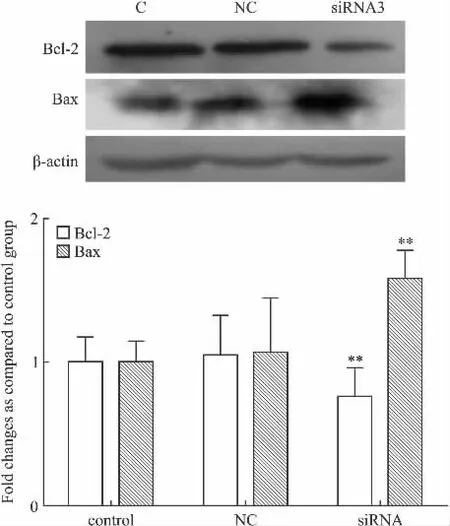
Fig 3 Effects of silencing HSCs β-arrestin2 gene on the expression of Bcl-2,Bax
3.4 siRNA β-arrestin2 对 HSC-T6 细胞凋亡的影响 流式细胞术分析表明,正常组细胞的凋亡率为3.5%,阴性对照细胞的凋亡率为4.7%。与未转染组相比,转染siRNA β-arrestin2处理组细胞凋亡率明显增加达37.5%(Fig 4)。
4 讨论
HSC的激活及ECM的大量产生是肝纤维化的中心环节,因此,寻找促进HSC凋亡的途径是防治肝纤维化的重要策略。大多数研究表明[10-11],活化的HSC主要通过凋亡途径消除,是纤维化消退的主要机制。Bcl-2基因家族在调节细胞凋亡中发挥重要作用。Bcl-2是重要的凋亡抑制基因,Bax是Bcl-2基因家族中重要的凋亡促进基因,其基因产物Bcl-2、Bax是重要的凋亡调控蛋白。Bcl-2和Bax互为负相关,Bcl-2/Bax比例高低决定了细胞凋亡的方向即抑制凋亡或是促进凋亡[12-13]。
Arrestins是一种分子量为48~55 ku的可溶性蛋白。在脊椎动物中,Arrestins家族包括两种仅表达在视网膜杆状和锥状体感光细胞的Arrestin 1、Arrestin 4,和广泛表达于各组织的β-arrestins,包括βarrestin1和β-arrestin2(也称作Arrestin 2和Arrestin 3)。β-arrestins为多功能蛋白,不仅能引起GPCRs的脱敏和内吞以调节GPCRs信号转导,还可以调节其他一些非GPCRs跨膜受体的信号转导途径调节细胞的增殖,凋亡等多种功能活动[14-16]。本课题组先前研究了β-arrestins在大鼠肝纤维化发展过程中的变化,结果发现随着肝纤维化的发展,β-arrestin2表达明显增加,而β-arrestin1表达无明显变化。结果提示β-arrestin2在肝纤维化的发生发展中起着重要的作用。
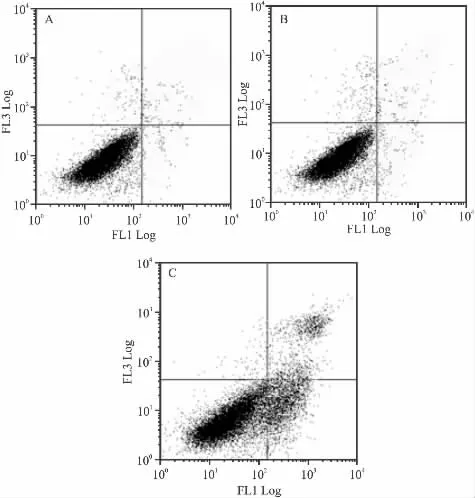
Fig 4 Effects of siRNA β-arrestin2 on the apoptosis of HSC-T6
β-arrestin2不仅参与调节GPCRs信号转导,而且作为支架蛋白调节许多信号通路发挥其抗凋亡的作用[17-18]。有研究表明在非活化和活化的CD4+T细胞中β-arrestins促进Bcl-2的表达[19]。另有研究表明[20],在DEN诱发的小鼠肝癌模型中,肝脏 βarrestin2表达明显增加,其可能通过增加Bcl-xL和减少Bax的表达,抑制p53导致抗凋亡作用。p53的激活的下游信号通路涉及许多细胞凋亡相关蛋白,有Bcl-xl(抗凋亡,Bcl-2的家庭成员),Bax(促凋亡),p53的凋亡调节作用是通过上调Bax和下调Bcl-2或Bcl-xL等实现的,通过他们的相互作用调节着细胞线粒体的通透性,从而影响着下游的促凋亡基因的功能[21-22]。β-arrestin2 可能通过调节MDM2蛋白的亚细胞定位,β-arrestin2的低聚物可以调节p53的功能[23],因此β-arrestin2可能通过影响p53的功能,继而影响细胞增殖和凋亡等功能。
本实验结果显示,在 siRNA β-arrestin2转染HSC后,细胞内Bcl-2基因蛋白表达下调,而Bax基因表达上调,表明β-arrestin2干扰具有影响两种凋亡因子介导细胞凋亡信号通路的作用。通过流式细胞仪检测 AnnexinV/PI双染细胞凋亡,显示转染siRNA β-arrestin2的HSC-T6细胞凋亡率明显上升。以上研究结果提示β-arrestin2干扰能通过改变活化HSC的信号转导通路促进肝细胞凋亡。因此,siRNA介导的β-arrestin2沉默可能对肝纤维化具有潜在治疗前景。
[1]Wirkowska A,Paczek L.Liver fibrosis and cirrhosis-choosen cytokines,growth factors and proteins.Part II[J].Przegl Lek,2011,68(4):228-30.
[2]孙妩弋,魏 伟.肝星状细胞信号转导机制及可能的抗肝纤维化药物作用新靶点[J].中国药理学通报,2006,22(12):1433-8.
[2]Sun W Y,Wei W.Signal transduction in hepatic stellate cells and possible drug targets[J].Chin Pharmacol Bull,2006,22(12):1433-8.
[3]Qu Z,Lou D,Pan Y.The role of IkappaBalpha in TNF-alpha-induced apoptosis in hepatic stellate cell line HSC-T6[J].J Huazhong Univ Sci Technol Med Sci,2007,27(4):407-10.
[4]Natarajan K,Berk B C.Crosstalk coregulation mechanisms of G protein-coupled receptors and receptor tyrosine kinases[J].Methods Mol Biol,2006,332:51-77.
[5]Kovacs J J,Hara M R,Davenport C L,et al.Arrestin development:emerging roles for beta-arrestins in developmental signaling pathways[J].Dev Cell,2009,17(4):443-58.
[6]Li T T,Alemayehu M,Aziziyeh A I,et al.Beta-arrestin/Ral signaling regulates lysophosphatidic acid-mediated migration and invasion of human breast tumor cells[J].Mol Cancer Res,2009,7(7):1064-77.
[7]McLennan G P,Kiss A,Miyatake M,et al.Kappa opioids promote the proliferation of astrocytes via Gbetagamma and beta-arrestin 2-dependent MAPK-mediated pathways[J].J Neurochem,2008,107(6):1753-65.
[8]Sun X,Zhang Y,Wang J,et al.Beta-arrestin 2 modulates resveratrol-induced apoptosis and regulation of Akt/GSK3ss pathways[J].Biochim Biophys Acta,2010,1800(9):912-8.
[9]Wagener B M,Marjon N A,Revankar C M,et al.Adaptor protein-2 interaction with arrestin regulates GPCR recycling and apoptosis[J].Traffic,2009,10(9):1286-300.
[10]Yu F S,Yang J S,Yu C S,et al.Safrole induces apoptosis in hu-man oral cancer HSC-3 cells[J].J Dent Res,2011,90(2):168-74.
[11]Saile B,DiRocco P,Dudas J,et al.IGF-I induces DNA synthesis and apoptosis in rat liver hepatic stellate cells(HSC)but DNA synthesis and proliferation in rat liver myofibroblasts(rMF)[J].Lab Invest,2004,84(8):1037-49.
[12]Spampanato C,De Maria S,Sarnataro M,et al.Simvastatin inhibits cancer cell growth by inducing apoptosis correlated to activation of Bax and down-regulation of BCL-2 gene expression[J].Int J Oncol,2012,40(4):935-41.
[13]Li X,Ye H,Cai L,et al.Millimeter wave radiation induces apoptosis via affecting the ratio of Bax/Bcl-2 in SW1353 human chondrosarcoma cells[J].Oncol Rep,2012,27(3):664-72.
[14]Wagener B M,Marjon N A,Revankar C M,et al.Adaptor protein-2 interaction with arrestin regulates GPCR recycling and apoptosis[J].Traffic,2009,10(9):1286-300.
[15]Kocan M,Pfleger K D.Detection of GPCR/beta-arrestin interactions in live cells using bioluminescence resonance energy transfer technology[J].Methods Mol Biol,2009,552:305-17.
[16]Miyatake M,Rubinstein T J,McLennan G P,et al.Inhibition of EGF-induced ERK/MAP kinase-mediated astrocyte proliferation by mu opioids:integration of G protein and beta-arrestin 2-dependent pathways[J].J Neurochem,2009,110(2):662-74.
[17]Ma L,Pei G.Beta-arrestin signaling and regulation of transcription[J].J Cell Sci,2007,120(Pt 2):213-8.
[18]Sun X,Zhang Y,Wang J,et al.Beta-arrestin 2 modulates resveratrol-induced apoptosis and regulation of Akt/GSK3ss pathways[J].Biochim Biophys Acta,2010,1800(9):912-8.
[19]Shi Y,Feng Y,Kang J,et al.Critical regulation of CD4+T cell survival and autoimmunity by beta-arrestin 1[J].Nat Immunol,2007,8(8):817-24.
[20]Khan M S,Devaraj H,Devaraj N.Chrysin abrogates early hepatocarcinogenesis and induces apoptosis in N-nitrosodiethylamine-induced preneoplastic nodules in rats[J].Toxicol Appl Pharmacol,2011,251(1):85-94.
[21]Cai Q,Guo Y,Xiao B,et al.Epstein-Barr Virus Nuclear Antigen 3C Stabilizes Gemin3 to Block p53-mediated Apoptosis[J].PLoS Pathog,2011,7(12):e1002418.
[22]Boulaiz H,Alvarez P J,Prados J,et al.gef Gene Expression in MCF-7 Breast Cancer Cells is Associated with a Better Prognosis and Induction of Apoptosis by p53-Mediated Signaling Pathway[J].Int J Mol Sci,2011,12(11):7445-58.
[23]Boularan C,Scott M G,Bourougaa K,et al.beta-arrestin 2 oligomerization controls the Mdm2-dependent inhibition of p53[J].Proc Natl Acad Sci USA,2007,104(46):18061-6.

