αB-晶状体蛋白在不同周龄正常大鼠晶状体中的表达
刘志涛,张 辉*,边立娟,谢明明,房学迅
(1.吉林大学第二医院 眼科医院,吉林 长春130041;2.吉林大学分子酶学教育部 重点实验室)
晶状体是人体内蛋白质含量最高的组织,晶状体蛋白是晶状体上皮细胞的主要成分,约占晶状体中水溶性蛋白的90%,依据其在电场中的迁移能力,分为α、β、γ-晶状体蛋白。其中,α-晶状体蛋白(α-crystallin)是最主要的结构蛋白,它由αA 和αB两个亚单位构成[1],两种亚单位在结构上与小热休克蛋白(small heat shock proteins,sHSPs)呈高度同源性,具有分子伴侣(molecular chaperone)的效应,主要表现为抑制蛋白质的聚集以及酶的失活[2],有利于维持晶状体的透明。
αB-晶状体蛋白(αB-crystallin)广泛表达于多种组织细胞中,以晶状体和横纹肌(心肌和骨骼肌)表达量最高[3]。在晶状体中,αB-晶状体蛋白与αA-晶状体蛋白以1:3的方式组成四聚体,发挥其生物学作用。αB-晶状体蛋白的基本功能是识别并结合有聚集倾向的非天然蛋白质或蛋白质折叠过程中的中间产物,稳定靶蛋白分子的构象,防止形成不可逆的蛋白质聚集产物[4]。因此,αB-晶状体蛋白对细胞内蛋白质的数量和质量的稳定以及细胞内环境的稳定有着十分重要的作用,近年来发现αB-晶状体蛋白参与多种细胞生理和应激过程,表现出某种抗组织细胞损伤的保护功能[4]。
在以往的试验中,我们通过免疫组织化学法证实,αB-晶状体蛋白在先天性白内障大鼠晶状体中的免疫活性,与相同周龄正常对照组相比较,随周龄的增长明显降低[5]。本实验通过SDS-PAGE凝胶电泳及Western blot方法检测αB-晶状体蛋白在不同周龄正常大鼠晶状体中的含量变化(以灰度值表示),探讨αB-晶状体蛋白在年龄相关性白内障的形成过程中的作用。
1 材料与方法
1.1 实验动物
3、6、9、12周龄健康清洁级 Wistar大鼠各10只(吉林大学实验动物中心提供),雌雄兼有,体重分别为(60±5)、(180±5)、(300±5)、(380±5)g,裂隙灯下观察晶状体均透明。
1.2 主要试剂
αB-晶状体蛋白单克隆第一抗体(美国SΑNTΑ CRUZ生物制品公司);β-肌动蛋白单克隆第一抗体(北京博奥森生物试剂公司);羊抗兔第二抗体(鼎国生物技术有限公司);标准牛血清蛋白(BSA)(宝泰克生物技术有限公司);蛋白酶抑制剂复合物(华特生生物技术有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);预染蛋白Marker(北京博迈德生物技术有限公司);硝酸纤维(PVDF)膜(英国Αmersham公司);ECL显色液(北京金式生物技术有限公司)。阿尔梅医用X射线胶片(天津国源医疗器械有限公司)。实验中的其他试剂如:样品缓冲液、SDS-PΑGE配制液、PMSF、上样Buffer、Tris-HCL、电泳液、电湿转液、TBS、TBST等缓冲液,均由吉林大学酶工程实验室提供、配制。
1.3 主要仪器
101-2B型干燥箱(天津泰斯特仪器有限司);垂直板电泳槽 (北京六一仪器厂);稳压稳流电泳仪(北京六一仪器厂);玻璃匀浆器(长春市源金医疗器械公司);78-1型磁力搅拌器(上海南江电讯器材厂);湿性转移电泳仪(大连竞迈生物科技有限公司);1700型紫外分光光度计(日本岛津公司);工XUS800数码相机 (日本佳能公司);CR-21G高速冷冻离心机(日本日立公司);SHZ-工I工型循环水真空泵(上海亚荣生化仪器厂);工T-1型裂隙灯(日本TOPCON公司)。
1.4 实验方法
1.4.1 晶状体蛋白的提取 颈椎脱臼法处死大鼠,用显微剪于角膜缘处剪开角膜,摘出完整晶状体,观察晶状体是否完全透明并冻存。取各周龄透明大鼠晶状体各10枚,冰上切碎,移入匀浆器,并加入样品缓冲液3ml(蛋白酶抑制剂、50mM Tris-HCl pH值8.0、1mMβ-琉基乙醇、2mM EDTΑ、100mM PMSF混合物),然后将其置于冰盒中匀浆约5 min,再将混合液移至EP管中(上述操作均在4℃的层析室中进行)。将混合液离心,12 000rp,20 min,4℃。弃沉淀,取上清,EP管中分装,于-80℃冰箱保存备用。
1.4.2 总蛋白浓度测定 根据标准品和样品数量,按50体积BCΑ试剂Α加1体积BCΑ试剂B(50∶1)配制适量BCΑ工作液,充分混匀。取10微升标准品用PBS稀释至100微升,使终浓度为0.5mg·ml-1。将标准品按0,1,2,4,8,12,16,20微升加到96孔板的蛋白标准品孔中,加PBS补足到20微升。加适当体积样品到96孔板的样品孔中,补加PBS到20微升。各孔加入200微升BCΑ工作液,37℃放置30分钟。冷却到室温,用酶标仪测定各样品孔在550nm处的吸光度,根据标准曲线计算出蛋白浓度。根据所测样品总蛋白浓度,将上述各组样品总蛋白浓度调至0.3mg·ml-1水平后备用,在-80℃冰箱保存。
1.4.3 SDS-PΑGE(聚丙烯酰胺)凝胶电泳 配制15%的分离胶,5%的浓缩胶,薄胶厚度为1.5mm;取上述己调平浓度的四组样品各20μl,分别加5×SDS上样Buffer 5μl,100℃的水浴煮5min,之后离心1min,12 000rp,未见沉淀;加预染蛋白Mαrker 5μl到上样孔内,再将各组样品15μl依次加到上样孔;采用稳流40mΑ,通电90分钟后,前沿条带跑至分离胶底沿时,预染蛋白Mαrker出现6条清晰彩色条带,终止电泳。
1.4.4 αB-晶状体蛋白蛋白印记及反应显色 将样品分离胶切成合适大小,再剪裁同样大小的PVDF膜和滤纸。PVDF膜先在甲醇溶液中浸泡5min,再在湿转液中浸泡5min。按“正极”—海绵—滤纸—PVDF膜—胶块—滤纸—海绵— “负极”的顺序放好,加入适量电转液,采用稳流80mA,转膜2小时。预染蛋白Mαrker的清晰条带印在PVDF膜上。先用TBS缓冲液洗膜,再用丽春红染色后PVDF膜上出现蛋白清晰条带,后用TBS缓冲液洗膜至无色。4℃的环境下,5%BSΑ封闭过夜。用TBS缓冲液洗膜3次,每次10min,然后加兔抗大鼠αB-晶状体蛋白单克隆第一抗体(1∶2 000稀释),4℃,摇床4小时。用TBS缓冲液洗膜3次,每次10min,加羊抗兔第二抗体(1∶4 000稀释),室温摇床摇1小时。用TBS缓冲液洗膜3次,每次10 min,于暗室内行ECL显色液显色。照相,封存。
1.4.5 β-肌动蛋白印记及反应显色 一抗采用β-肌动蛋白单克隆第一抗体(1∶1000稀释),4℃,摇床4小时。余实验步骤同2.4。
1.4.6 将上述曝光照片用Bandscan扫瞄分析软件进行分析。
2 结果
各周龄大鼠晶状体样品中αB-晶状体蛋白条带的显色情况、经Bandscan扫描的总灰度值,及各周龄条带灰度值与3周龄条带灰度值比较结果一致表明:不同周龄正常 Wistar大鼠晶状体中水溶性的αB-晶状体蛋白的含量随着周龄的增加呈明显下降趋势(图-1、2,表-1)。
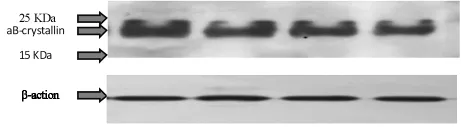
图1 晶状体中αB-晶状体蛋白的检测结果
通过图1,我们可以发现,3、6、9、12周龄正常大鼠晶状体中的αB-晶状体蛋白条带,位于15KDa和25KDa预染蛋白标记带之间,其分子量大约为23.5KDa。β-肌动蛋白(β-Actin蛋白)在细胞的表达水平通常不会随着年龄的增长发生改变,因此被广泛用于Western时上样量是否一致的参照,本实验各周龄对应的β-肌动蛋白显色程度均一无差别,进一步证明各个样品上样总蛋白含量相同。
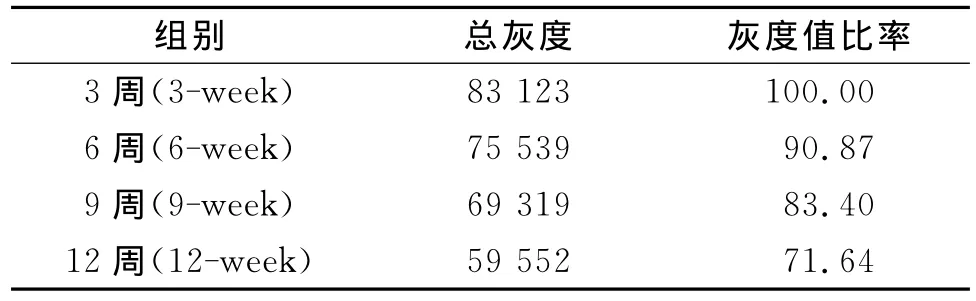
表1 Bandscan扫描的总灰度值分析结果
通过表1,我们可知3、6、9、12周龄正常大鼠晶状体中的αB-晶状体蛋白条带经Bandscan扫描的总灰度值分别为:83 123,75 539,69 319,59 552。αB-晶状体蛋白的含量随着周龄的增加呈明显下降趋势。

图2 各周龄条带灰度值与3周龄条带灰度值比较结果
通过图2,我们可以发现,各周龄正常大鼠晶状体中αB-晶状体蛋白条总灰度值与3周龄对比显示,6、9、12周龄的蛋白含量水平分别降至3周龄含量水平的90.87%、83.40%、71.64%,呈明显下降趋势。
3 讨论
αB-晶状体蛋白的基因(CRYAB)定位于染色体11q12-q23,编码由 175 个氨基酸组成蛋白质[4]。αB-晶状体蛋白的结构可分为三个部分:(1)从第60位到第151位共92个氨基酸是小分子热休克蛋白(sHSP)家族特征性的保守核心结构域,是其识别和结合非天然蛋白质底物,发挥分子伴侣功能的关键部位。(2)在核心区域的氨基端由59个氨基酸组成N末端区,主要包含有Ser19/45/59三个磷酸化位点和Met1乙酰化位点,该部分对αB-晶状体蛋白的分子构象、聚合物大小及分子伴侣的功能有一定的调节作用。(3)αB-晶状体蛋白核心区域的羧基端由24个氨基酸组成,称为C末端尾部。
αB-晶状体蛋白作为晶状体蛋白的重要组成部分,其特有的分子伴侣活性对各种致病因素造成的晶状体蛋白的非特异性凝聚具有抑制作用,其活性的减弱或丧失与白内障的发病密切相关[6-8]。Carver等[9]发现随年龄增长,伴随着α-晶状体蛋白量的减少,高相对分子量的蛋白数量增加,而高相对分子量蛋白主要由高度聚合状态的α-晶状体蛋白组成,α-晶状体蛋白的四级空间结构发生变化,导致分子伴侣活性下降和水溶性的降低。也有研究认为α-晶状体蛋白在聚合成高分子量蛋白的过程中,β片层构象增加,导致α-晶状体蛋白部分去折叠,使疏水作用强于α-晶状体蛋白,进而水溶性的降低及分子伴侣活性下降。1993年Kelly等[10]发现在大鼠白内障晶状体中内切肽酶Calpain II导致αB-晶状体蛋白的分子活性伴侣减弱。1997年Inomata等[8]观察到在白内障大鼠晶状体中αB-晶状体蛋白被Calpain分解成多肽片段,且部分降解产物为不可溶性。
在以往的试验中,我们通过探讨多种内切肽酶和外切肽酶在先天性白内障大鼠、正常大鼠及年龄相关性白内障患者晶状体中的含量及免疫活性的变化,推测在白内障的形成过程中,晶状体在受到各种致病因素的作用下,晶状体内的Ca2+浓度升高使得某些蛋白溶解酶活性增强,αB-晶状体蛋白被降解,其水溶性及生物活性下降。
本实验研究结果表明,不同周龄正常Wistar大鼠晶状体中可溶性αB-晶状体蛋白的含量随着周龄的增加呈明显下降趋势。提示在晶状体的发育过程中,αB-晶状体蛋白被某些活化性的蛋白水解酶降解,从而使α-晶状体蛋白丧失其水溶性,由可溶性蛋白变为不可溶性蛋白,而其分子伴侣活性的降低引起,导致其保护其他蛋白(β-和γ-晶状体蛋白)避免变性的作用下降[9]。晶状体内若没有足够的水溶性蛋白,其透明性及屈光作用的降低,导致白内障的形成及视力障碍。
白内障的病因学研究是一个相当复杂的课题,在白内障的形成过程中存在复杂的病理及生化现象。近年来,随着分子生物学、生物化学及基因工程的迅猛发展,白内障的发病机制研究取得重大进步。就其白内障的预防工作而言,应尽可能早的采取积极措施,避免各种致病因素,保护晶状体蛋白少受变性影响,延缓或阻止晶状体蛋白的降解、聚集,这将是预防白内障的有效手段。
[1]Bloemendal H,Jong W de,Jaenicke R,et al.Slingsby,A.Tardieu,Ageing and vision:structure,stability and function of lens crystallins[J].Prog Biophys Mol Biol,2004,86:407.
[2]Derham BK,Harding JJ.Effects of modifications ofα2crystallin on its chaperone and other p roperties[J].Biochem J,2002;364(Pt3):712.
[3]Delaye M,Tardieu A.short-range order of crystalline proteins accounts for eye len transparency[J].Nature,1983,302(5907):415.
[4]刘 双,肖献忠.aB-晶体蛋白的功能与疾病[J].生命的化学,2005,25(2):89.
[5]张 辉,赵梅生,于维芹,田 蕊.αB-晶状体蛋白在先天性白内障大鼠晶状体中免疫活性的变化[J].眼科新进展,2006,26(12):893.
[6]Muchowski PJ.Bassuk JA.Lubsen NH,et al.Human Alpha B-crystallin,small heat shock protein and molecular chaperonne[J].Biol Chem,1997,272(4):2578.
[7]Shumiya S.Estabablishment of the hereditary cataract strain(SCR)and genetic analysis[J].Lab Anim Sci,1995,45(6):671.
[8]Inomata M,Nomura K,Takehana M,et al.Evidence for the involvement of calpain in cataract ogenesis in Shumiy acataract rat(SCR )[J].Biochim Biophys Acta,1997,1362(1):11.
[9]Carver JA,Aquilina JA,Cooper PG,et al.Alpha-crystallin:molecular chaperone and protein surfactant[J].Boechim Biophys Acta,1994,1204(2):195.
[10]Kelley MJ,David LL;Iwasaki N.alpha-Crystallin chaperone activity is reduced by calpainⅡin vitro and in selenite cataract[J].Biol Chem,1993,268:18844.

