甲氨蝶呤对骨肉瘤细胞株的作用观察
万法青,刘易军,单玉兴*,张海玉
(吉林大学第一医院1.二部骨科;2.儿外科,吉林 长春130000)
骨肉瘤是最常见的原发性恶性骨肿瘤,好发于青少年。具有瘤细胞增殖迅速、恶性度高、易发生早期转移等特点。治疗以手术为主的综合治疗,化疗药物主要用甲氨蝶呤(MTX)、顺铂、异环磷酰胺、阿霉素等。本实验应用甲氨蝶呤作用于骨肉瘤细胞株(HOS),观察其对肿瘤细胞生长的影响及对端粒酶活性的作用。进而研究甲氨蝶呤的抑癌机制。
1 材料与方法
1.1 材料与试剂 人骨肉瘤(HOS)细胞株购自北京鼎国生物;胎牛血清Hyclone公司;MEM培养基Gibco公司;甲氨蝶呤上海医药有限公司;BCA蛋白试剂盒、四氮甲唑蓝(MTT)碧云天公司;TRAPPCR-ELISA试剂盒德国宝灵曼公司。
1.2 方法
1.2.1 细胞培养 人骨肉瘤HOS细胞培养于含10%胎牛血清MEM培养基中,置5%CO2、饱和湿度37℃的细胞培养箱中培养。
1.2.2 MTT法 取对数生长期细胞(制备细胞悬液为1×106/ml),接种于96孔板,每孔100μl。设立实验组和对照组,次日分别加入100μl经培养液稀释好的不同浓度的药物及相同体积的培养液,每个浓度设3个复孔,分别培养24、48、72小时后加入MTT(5g/L)20μl,继续培养4小时,吸弃培养液,每孔加150μl DMSO,终止培养,室温振荡约10 min,充分溶解蓝紫色结晶。用 Model-450酶标仪(Bio-Bad)测定波长490nm处的吸光度(A)值。细胞存活率(%)=(实验组A值/对照组A值)×100%,细胞抑制率(%)=1-细胞存活率,抑制率达到50%为最佳作用时间和浓度,并测定端粒酶活性改变的药物浓度和作用时间。
1.2.3 TRAP-PCR-ELISA 方法检测端粒酶活性,按试剂盒说明书操作 收集细胞沉淀用冷洗液悬浮,冰浴5min,4℃高速离心(10 000rpm)5min。沉淀与冷的裂解缓冲液冰浴30min,其间涡旋振荡3-5次,4℃高速离心(13 000rpm)30min,上清即所需的提取液,吸取上清液至EP管中,分装,20μl/管,BCA法测定其中一份蛋白浓度,其余-70℃保存备用。TRAP-PCR反应:在0.2ml扩增管中依次加入25μl反应混合物,3μl细胞裂解产物,加无菌水至终体积50μl。PCR步骤:25℃30min引物延伸;94℃5min端粒酶灭活;之后94℃30s,50℃30s,72℃90s共循环36个周期后72℃10min进一步延伸。4℃保存PCR产物。ELISA反应:PCR产物与变性剂以及杂交缓冲液反应后,取100μl加入有亲合素包被的反应孔中37℃振荡孵育2h。洗涤后,于各孔中加入抗地高辛-过氧化物酶,室温下振荡30min。洗涤,再依次加入四甲基联苯胺(TMB)和终止液,从酶标仪上读取其在450nm处的吸光度A值。65℃水浴10min加热灭活的(HOS)细胞提取液作阴性对照,阳性对照于试剂盒内提供。
2 结果
2.1 细胞毒性试验(MTT法) 采用MTT法检测MTX对HOS细胞生长的影响。结果如图1所示,MTX可以明显抑制HOS细胞的增殖,MTX对HOS细胞的毒性作用随着浓度的增加而增强,即MTX对HOS细胞的毒性作用呈浓度依赖性,同剂量MTX对HOS细胞的毒性作用随时间的延长而增强,即呈时间依赖性。MTX对HOS细胞株的半数致死浓度(IC50)为100mg/L。
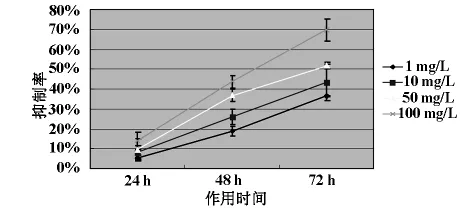
图1 MTX作用于骨肉瘤细胞株HOS后细胞抑制率
2.2 端粒酶活性改变 实验组为MTX作用组,对照组为未加任何药物的细胞,实验组吸光度值A值与对照组比较发现MTX作用后HOS细胞端粒酶活性受到明显抑制,P<0.05,端粒酶活性下调率(%)=(实验组平均A值-对照组平均A值)/对照组平均A值×100%。MTX作用后HOS细胞株端粒酶活性下降了47.49%,这表明MTX可以明显抑制HOS细胞株端粒酶活性。
3 讨论
甲氨蝶吟(MTX)为抗叶酸类抗肿瘤药,对多种肿瘤具有良好的抗肿瘤活性[1]。主要通过对二氢叶酸还原酶的抑制来阻碍嘌呤核苷酸的合成进而达到对肿瘤细胞基因表达及细胞生长与繁殖的抑制。本药选择性地作用于细胞周期中的S期,是骨与软组织肿瘤化疗的首选药物。张永民[2]等研究发现甲氨蝶呤对体外培养的软骨肉瘤细胞有一定的抑制作用且随着药物浓度的增加而增强。李萍[3]等研究也发现甲氨蝶呤对破骨细胞的增殖、骨吸收等均有明显的抑制作用,并可诱导破骨细胞凋亡。本实验表明MTX对骨肉瘤细胞株(HOS)有明显的抑制作用,且呈时间和浓度依赖性。进一步证实了MTX对体外培养骨肉瘤细胞株的生长抑制作用。
端粒酶是一种RNA依赖的DNA聚合酶,端粒酶的激活使端粒的长度得以稳定,细胞获得无限增殖能力成为永生化细胞[4]。端粒酶的作用是将端粒序列添加到染色体的末端。因此,端粒酶是在细胞周期的S期发挥作用的[5]。进年来有研究表明,在84%的骨肉瘤、60%的软骨肉瘤中可检测到端粒酶活性的表达,而在瘤旁正常组织中却检测不到[6],因此端粒酶可能成为治疗肿瘤的新靶点。有报道称顺铂可以抑制大肠癌细胞HT-29细胞的端粒酶活性[7]。而MTX对端粒酶活性的作用报道却很少,本实验表明MTX可以明显抑制骨肉瘤细胞株(HOS)端粒酶活性,下调率为47.49%。这可能与MTX选择性的作用于细胞周期中的S期有关。但是其具体作用机制还有待进一步的研究。
[1]Karasulu HY,Karabulut B,Gker E,et al.Controlled release of methotrexate from w/o microemulsion and its in vitro antitumor activity[J].Drug Deliv,2007,14(4):225.
[2]张永民,赵钢生,陈红卫,等.MTX及重组人肿瘤坏死因子对体外培养软骨肉瘤细胞株作用[J].中国医学杂志,2007,27(11):1561.
[3]李 萍,王 霖,王文杰,等.甲氨蝶呤对破骨细胞的作用及机制研究[J].药理学学报,2008,43(10):1025.
[4]江荣彬,李新庄,张丽仙,等.5-氟尿吡啶对人舌癌细胞的抑制作用和对端粒酶活性的影响[J].现代口腔医学杂志,2003,19(5):371.
[5]Shimada Y,Nakano M,Kanda N,et al.Cell cycle-dependent activation of telomerase in naturally synchronized culture of a trueslime mold,Physarum polycephalum[J].Biochem Biophy Res Commun,1997,232:492.
[6]Wen JM,Sun LB,Zhang M,et al.Anon-isotopic method for the detection of telomerase activityin tumour tissues:TRAP-silver staining assay[J].Mol Pathol,1998,51:110.
[7]鞠晓明,徐文怀,万远廉,等.化学治疗药物对大肠癌细胞端粒酶活性的影响[J].中华普通外科杂志,2002,17(4):234.

