乳腺癌细胞膜蛋白的SELDI-TOF-MS分析
韵雪雪,杨永长,姜 伟,肖代雯,闫 慧,黄文芳*
(1.四川省医学科学院 四川省人民医院,四川 成都610072;2.重庆医科大学医学检验系 临床检验诊断学教育部重点实验室,重庆400016)
乳腺癌是一种严重危害育龄妇女健康的恶性肿瘤,占全身恶性肿瘤的7-10%,据统计,全球每年发病约250万人,50万人死亡。2004年Jemal等统计,早期诊断乳腺癌五年生存率可达97%,而扩散后的五年生存率仅为23%[1]。影像学检查和CA-153标志物是目前乳腺癌检查常用的技术指标,但由于乳腺炎症,射线过敏和敏感性方面的问题[2,3],不足以满足临床和大规模筛查的需要,细胞膜在细胞生命活动中发挥重要作用,已有研究发现膜蛋白肿瘤过程中发生特异性变化[4],SELDI-TOF-MS是目前蛋白研究的先进技术,具有高通量,检测快速,敏感度和特异性高,分析全面精确的特点,在蛋白质组学研究中应用广泛,本实验拟通过SELDI-TOF-MS分析乳腺癌及正常乳腺细胞株膜,寻找差异蛋白,为乳腺癌亚细胞蛋白水平标志物的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞 人类乳腺正常细胞株HBL-100购自上海中科院细胞库,人类乳腺癌细胞株MDA-MB-231及MCF-7均由重庆医科大学惠赠。
1.1.2 主要试剂及来源 细胞膜蛋白提取试剂盒购自Sigma公司,小牛血清,1640培养基,0.25%胰酶均购自GIBCO公司,TritonX-114购自Amresco公司,芥子酸(SPA)、乙腈(ACN)、三氟乙酸(TFA)、细胞色素C和肌红蛋白均购自Sigma公司。
1.1.3 主要仪器 CO2培养箱由德国Heraeus生产;表面增强激光解吸蛋白飞行时间质谱(SELDITOF-MS)仪、Au蛋白质芯片为Ciphergen公司产品;Vortex-Genie 2涡旋振荡器为美国Scientific Industries公司产品。
1.2 方法
1.2.1 细胞培养与收集细胞MDA-MB-231,MCF-7,HBL-100培养于含有10%的小牛血清的RPMI-1640培养基中,细胞贴壁70-90%时传代,加入PBS洗2次,2×107每管冻于-80℃冰箱保存。
1.2.2 膜蛋白蛋白的分离纯化 膜蛋白的分离纯化按照试剂盒说明进行,步骤为:①每管细胞中加入600μl的裂解液,冰浴10min,②4℃×10 000g离心细胞5min,转移上清至以新的管中,③37℃孵育5min,可以观察到液体变为云雾状浑浊。④37℃×3 000g离心3min,弃上清下部沉淀为细胞膜脂筏蛋白和疏水性蛋白。
1.2.3 丙酮沉淀 加预冷丙酮至膜蛋白提取物,-20℃冰箱沉淀过夜,4℃×12 000g离心10min,弃上清重复丙酮沉淀即为膜蛋白,加4‰Tritonx-114充分溶解。
1.2.4 蛋白定量 Olympus AU 2700生化分析仪检测各管中蛋白量,用4‰TritonX-114调节样品浓度为100μg/μl。
1.2.5 质量校准 SELDI-TOF-MS仪每次使用前,采用蛋白标准品胰岛素、细胞色素C和肌红蛋白对SELDI-TOF-MS进行相对分子质量校准,确保系统的质量偏差范围控制在0.1%以内。
1.2.6 SELDI-TOF-MS分析蛋白指纹图谱 10 μl 50%饱和SPA(能量分子,含50%ACN和0.5%TFA)与经过处理的等体积膜蛋白样品混合,上样Au蛋白芯片,每孔4μl,每个标本重复2条芯片,每条2个点,待干后每孔重复加入1μl SPA2次,完全干燥后,选择激光强度为190,灵敏度为8,SELDITOF-MS分析蛋白指纹图谱,Protein-chip Software Bio-maker自动采集数据。
1.2.7 数据收集处理 采用Biomarker Wizard 3.1软件对乳腺癌和正常乳腺细胞线粒体蛋白质分别进行指纹图谱分析,设定有意义的蛋白质峰出现频率阈值为10%,分别设定5,2两次信噪比(S/N)过滤。确定两组间蛋白质峰值比较时,对初步筛选的蛋白质峰进行t检验,以P<0.05筛选差异蛋白。
1.2.8 溶剂影响 4‰TritonX-114与SPA等量混合,按照1.2.6条件点样分析蛋白指纹图。
1.2.9 长期冻存对结果影响 选择-80℃冻存达3-6个月的细胞,提取膜蛋白分析指纹图谱,与新收集细胞膜蛋白指纹图谱比较,观察两者蛋白峰数目及丰度有无统计学差异。
2 结果
2.1 细胞膜蛋白指纹图谱分析结果
经蛋白指纹图谱标准化后,MDA-MB-231和MCF-7与HBL-100相比,膜蛋白差异点分别为32个和34个(P<0.05),其中7.8kD,8.3kD和8.8 kD的蛋白在两株癌细胞中表达均降低,9.6kD的蛋白在两株癌细胞中表达均增高,见表1和图1、2。
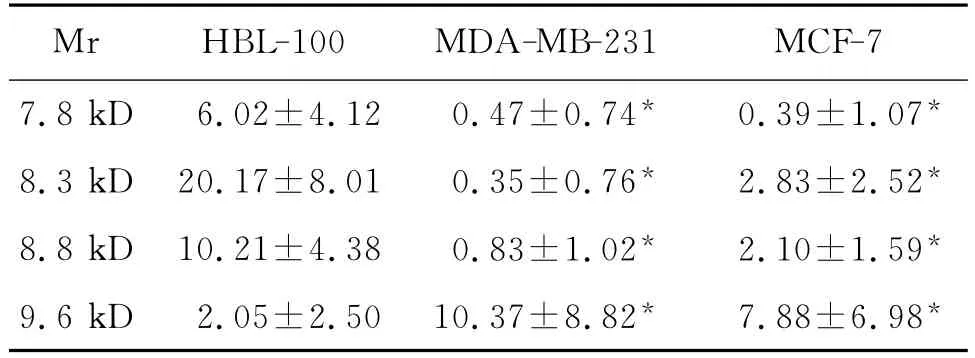
表1 乳腺正常细胞膜与乳腺癌细胞膜差异蛋白(kD)

图1 分子量7.8kD和8.3kD的差异蛋白指纹图
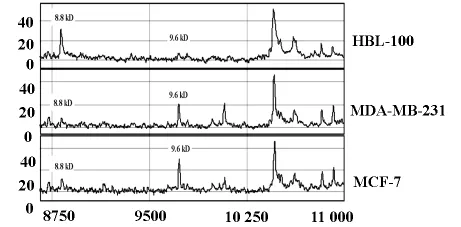
图2 分子量8.8kD和9.6kD的差异蛋白指纹图
2.2 溶液对结果影响分析
蛋白指纹图谱分析4‰TritonX-114点样Au蛋白芯片后除基质峰外无任何蛋白峰,证明该浓度TritonX-114对结果分析无影响,见图3。

图3 芯片洗涤后点样4‰TritonX-114分析图谱
2.3 长期冻存对结果影响分析
新鲜提取细胞与冻存3-6个月的细胞线粒体蛋白指纹图谱比较,两者在蛋白峰的数量和丰度上均无统计学差异(P>0.05),表明在此时间范围内保存不影响结果分析,见图4。
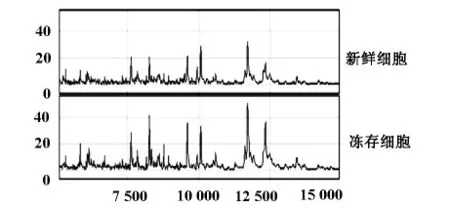
图4 新鲜细胞与冻存细胞膜蛋白指纹图谱
3 讨论
细胞膜蛋白约占蛋白总量的1/3,在信号传递,物质转运方面发挥重要的作用,肿瘤细胞膜蛋白连接数量少而且发育差,微绒毛数量增多,一些质膜蛋白如受体蛋白、转运蛋白、黏附蛋白、抗原蛋白等过量表达、缺失或发生修饰,使细胞的信号转导、物质运输、黏附作用、免疫原性等发生改变,与肿瘤细胞的恶性行为如侵袭和转移密切相关。同时膜蛋白是药物作用靶点之一,目前80%临床使用药物的靶点都集中在膜蛋白上,细胞膜蛋白改变时,会引起细胞对药物的反应改变,导致化疗失败。在乳腺癌中,Jensen等[5]研究发现一种以γ-氨基丁酸A型受体为配体的氯离子通道蛋白异常表达。Garcia Pedrero JM[6]等发现AnnexinA1在乳腺癌中表达下调,其下调程度与其上皮分化状态、局部淋巴结转移程度、组织病理学分级密切相关,恶性程度越高,表达下调程度越明显。Adam P J等[7]通过对乳腺癌细胞质膜大规模蛋白质组学分析,建立了500多个的蛋白的乳腺癌细胞质膜蛋白数据集,其中27%功能未知,进一步的定位实验、相互作用分析和免疫组化发现了3个以前未鉴定的蛋白质BCMP11、BCMP84和BCMP101可能在癌变过程中起作用。
SELDI-TOF-MS问世以来,因其分析速度快,相对分子质量范围大,可以有效捕获低分子量、低丰度的蛋白的特点,在亚细胞蛋白研究中得到极大的应用,已通过SELDI-TOF-MS在乳腺癌全细胞蛋白研究中捕获标志物[8]。本实验利用SELDI-TOFMS检测两株乳腺癌及一株乳腺正常上皮细胞株膜蛋白,发现分子量7.8kD,8.3kD和8.8kD的蛋白在两株癌细胞中表达均降低,分子量9.6kD的蛋白在两株癌细胞中表达均增高。同时本实验选择的Au芯片,与以往CM10,WCX等相比,可以重复利用,成本极低,适合大面积筛查。在标本保存时间上,比较-80℃冻存3-6月的细胞膜蛋白与新鲜细胞膜蛋白指纹图谱,发现两者在蛋白峰数目及丰度均无统计学差异,表明在此范围内保存不影响指纹图谱分析,与既往研究一致[9]。提示本实验可用于长期保存标本的研究。
本实验在亚细胞水平初步筛选出了乳腺癌特异性蛋白,但能否将筛选的蛋白用于乳腺癌的诊断,还有很长的路要走。在下一步实验中,我们对差异蛋白分离、纯化和鉴定,同时收集各种类型的临床标本进行验证,以期为乳腺癌标志物研究鉴定更多依据。
[1]Jemal A,Tiwari RC,Murray T,et al.Cancer statistics[J].CA Cancer J Clin.2004,54(1):8.
[2]Chagpar AB,McMasters KM.Trends in mammography and clinical breast examination:apopulation-based study[J].J Surg Res,2007,140(2):214.
[3]Hinestrosa MC,Dickersin K,Klein P,et al.Shaping the future of biomarker research in breast cancer to ensure clinical relevance[J].Nat Rev Cancer,2007,7(4):309.
[4]Kanzaki A,Yoi M,Nakayama K,et al.Expression of multidrug resistanc-related transporters in human breast carcinoma[J].J Cancer Res,2001,92(4):452.
[5]Roberts SS,Mendona-Torres MC,Jensen K.et al.GABA receptor expression in benign and malignant thyroid tumors[J].Pathol Oncol Res.,2009,15(4):645.
[6]Garcia Pedrero JM,Fernandez MP,Morgan RO ,et al.Annexin A1down-regulation in head and neck cancer is associated with epithelial differentiation status[J].Am J Pathol,2004,164(1):73.
[7]Adam P J,Boyd R,Tyson KL,et al.Comprehensive proteomic analysis of breast cancer cell membranes reveals unique proteins with potential roles in clinical Cancer[J].J Biol Chem,2003,278(8):6482.
[8]Mannel F,Medda V,Tonti GA,et al.Protein profile analysis of the breast microenvironment to differentiate healthy women from breast cancer patients[J].Expert Rev Proteomics,2009,6(1):43.
[9]Leong S,Christopherson RI,Baxter RC,et al.Profiling of apoptotic changes in human breast cancer cells using SELDI-TOF mass spectrometry[J].Cell Physiol Biochem,2007,20(5):579.

